血液病患者合并血流感染74例临床分析
周 云, 李享宸, 宋光彩, 吴春农
血液病患者由于疾病本身特点,病程中需要使用激素、免疫抑制剂、化疗及合并粒细胞缺乏等因素,感染是血液病患者最常见的并发症,也是导致治疗失败和死亡的主要原因。感染的部位主要是血流感染,其发生率高达10%~20%,总体病死率也较高[1-4]。早期经验选用敏感抗菌药物预防和治疗可以极大地降低患者的感染率及死亡率。但是由于各医院、各科室及不同病房之间的病原菌存在较大的差异,耐药情况也存在差异。了解本科室病原菌的分布及耐药情况,可以指导临床经验用药。现将我院血液科2015年1月1日-2019年12月31日的血液病患者血流感染情况、病原菌分布、耐药情况及预后因素进行回顾性分析,以指导临床用药及预后判断。
1 材料与方法
1.1 材料
1.1.1 病例来源 采用回顾性调查方法,分析2015年1月1日-2019年12月31日凉山州第一人民医院血液科血液病患者资料,总结经血培养确诊的74例血流感染患 者临床经过。
1.1.2 诊断标准 血流感染的诊断标准参照我国卫生部2001年颁布的《医院感染诊断标准(试行)》,在临床诊断的基础上,符合下述两条之一即可诊断:①血培养分离出病原微生物,若为常见皮肤定植菌,如类白喉棒状杆菌、肠杆菌、凝固酶阴性葡萄球菌 、丙酸杆菌等,需在不同时间采血有2次或多次培养阳性;②血液和/或骨髓培养中检测到病原体的抗原物质[5]。
1.2 方法
1.2.1 标本采集 因怀疑血流感染,在患者畏寒寒战以及抗菌药物使用之前,按照操作规范采集标本,每次采集二份,分别从不同的部位采集,每份标本采集量为8~10 mL,注入血培养瓶,充分摇匀后,送检需氧及厌氧培养。
1.2.2 病原菌鉴定、培养方法及药敏试验 应用德国西门子MicroScan公司WalkAway 96全自动血培养仪及配套培养瓶进行培养,分离所得病原菌采用德国西门子MicroScan公司WalkAway 96的MicroScan分析系统进行药敏试验检测。质控菌株为大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213和铜绿假单胞菌ATCC 27853,均由我院临床检验中心提供。根据美国临床和实验室标准化协会(CLSI)的标准[6]及常见细菌药物敏感性试验报告规范中国专家共识[7]进行药敏结果判读。
1.2.3 资料收集 收集74例患者的血培养结果、药敏试验结果以及28 d内的生存情况,将死亡患者作为死亡组,生存患者作为对照组。同时收集患者的临床资料[年龄、合并基础疾病、民族、疾病的治疗阶段,血清白蛋白、降钙素原(PCT)]进行预后相关因素分析。
1.2.4 统计分析 采用SPSS 22.0统计软件进行统计学分析,病原菌分布采用频率分布进行统计描述,药物敏感性采用频率进行统计描述。预后危险因素单因素分析采用卡方检验,P<0.05为差异有统计学意义;将单因素分析得出的P<0.05变量纳入logistic回归模型进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2. 1 临床特征
74例患者中男36例,女38例,平均年龄50岁(16~89岁);汉族53例,彝族17例,藏族4例。合并基础疾病:初诊血液病20例,初诊合并基础疾病15例,复发难治肿瘤患者22例,巩固化疗8例,合并HIV感染2例,合并丙型病毒性肝炎1例,免疫抑制剂治疗6例。血液疾病构成:急性髓系白血病(AML)26例,急性淋巴细胞白血病(ALL)13例,多发性骨髓瘤12例,骨髓增生异常综合征(MDS)9例,非霍奇金淋巴瘤8例,慢性重型再生障碍性贫血6例。74例患者发生血流感染28 d内死亡16例,死亡患者多为老年、合并基础疾病者,死亡组患者的血清白蛋白较对照组低,PCT水平高于对照组。
2.2 病原菌构成
总计分离出病原菌74株,细菌分布以革兰阴性菌为主,52株(70.3%),其次是革兰阳性菌和真菌,分别为19株(25.7%)和3株(4.1%)。前五位致病菌分别为大肠埃希菌29株(39.2%)、肺炎克雷伯菌11株(14.9%)、金黄色葡萄球菌5株(6.8%)、屎肠球菌3株(4.1%)和阴沟肠杆菌3株(4.1%)。见表1。

表1 血流感染细菌分布及构成比Table 1 Distribution of the pathogens isolated from bloodstream infections
2.3 细菌耐药情况
革兰阴性菌中的大肠埃希菌对青霉素类、头孢菌素类抗生素均有不同程度的耐药,耐药率大于50.0%,而对头孢西丁及含 β内酰胺酶抑制剂的复合制剂具有较高的敏感率,对阿米卡星、碳青霉烯类及替加环素耐药率为0。肺炎克雷伯菌对头孢菌素类显示有良好的敏感率,但对氨苄西林的耐药率较高,耐药率为81.8%,对阿米卡星、碳青霉烯类及替加环素耐药率为0。阴沟肠杆菌对青霉素类,第一、第二代头孢菌素有较高的耐药率,而对第三代头孢菌素有较高的敏感率,对阿米卡星、哌拉西林-他唑巴坦、碳青霉烯类及替加环素耐药率为0。见表 2。
革兰阳性菌中常见的5株金黄色葡萄球菌和3株屎肠球菌对多数抗菌药物均敏感,其中对达托霉素、莫西沙星、四环素、万古霉素及利奈唑胺显示有良好的敏感率。5株金黄色葡萄球菌对青霉素、红霉素、克林霉素均耐药,3株屎肠球菌对利福平均耐药,其中1株对万古霉素耐药。见表3。
2.4 预后相关危险因素单因素分析
74例血流感染患者28 d内死亡16例,占21.6%。对预后相关危险因素(年龄、民族、合并基础疾病、疾病治疗状态、PCT及白蛋白水平)采用卡方检验进行分析。结果提示:病死率在不同年龄(P=0.015)、PCT水平(P=0.015)、白蛋白水平(P=0.034)及是否合并基础疾病(P=0.006)方面差异有统计学意义,见表4。

表2 革兰阴性菌对抗菌药物的耐药情况Table 2 Resistance profile of gram-negative bacterial strains to antimicrobial agents[ n (%)]
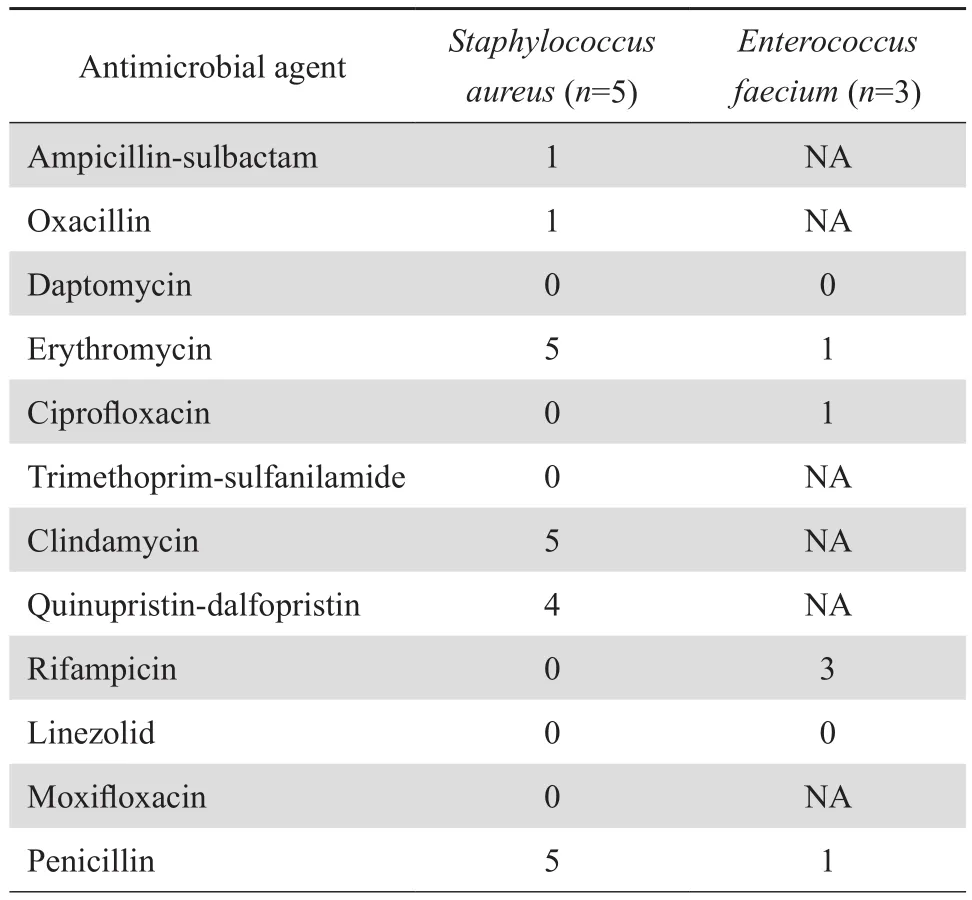
表3 革兰阳性菌对抗菌药物的耐药情况Table 3 Resistant gram-positive strains isolated from bloodstream infections
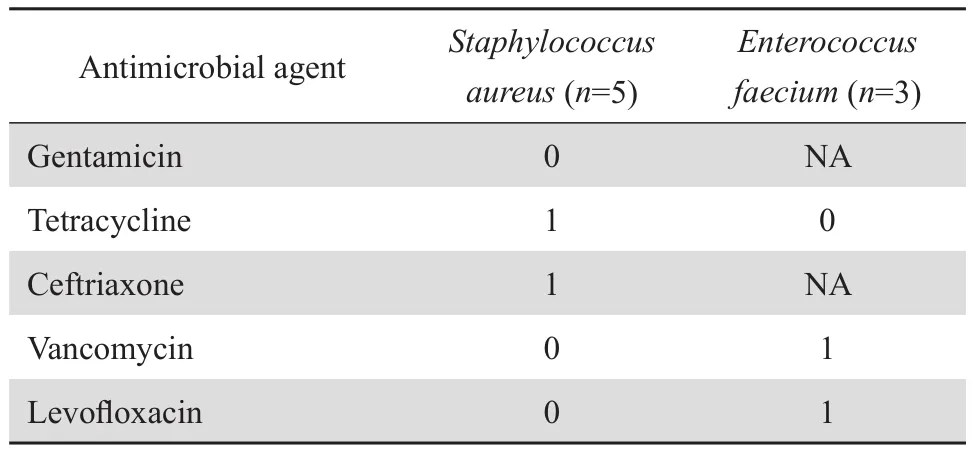
表3(续)Table 3(continued)
2.5 预后相关因素多因素logistic回归分析
将单因素分析得出P<0.05的预后相关危险因素进行多因素logistics回归分析,其中包括年龄、合并基础疾病、PCT及白蛋白水平。将变量进行赋值:无基础疾病为0,有基础疾病为 1;PCT <2.0 μg/L为0,PCT≥2.0 μg/L为 1;白蛋白 ≥30.0 g/L为0,白蛋白<30.0 g/L为1;年龄<70岁为0,反之为1。
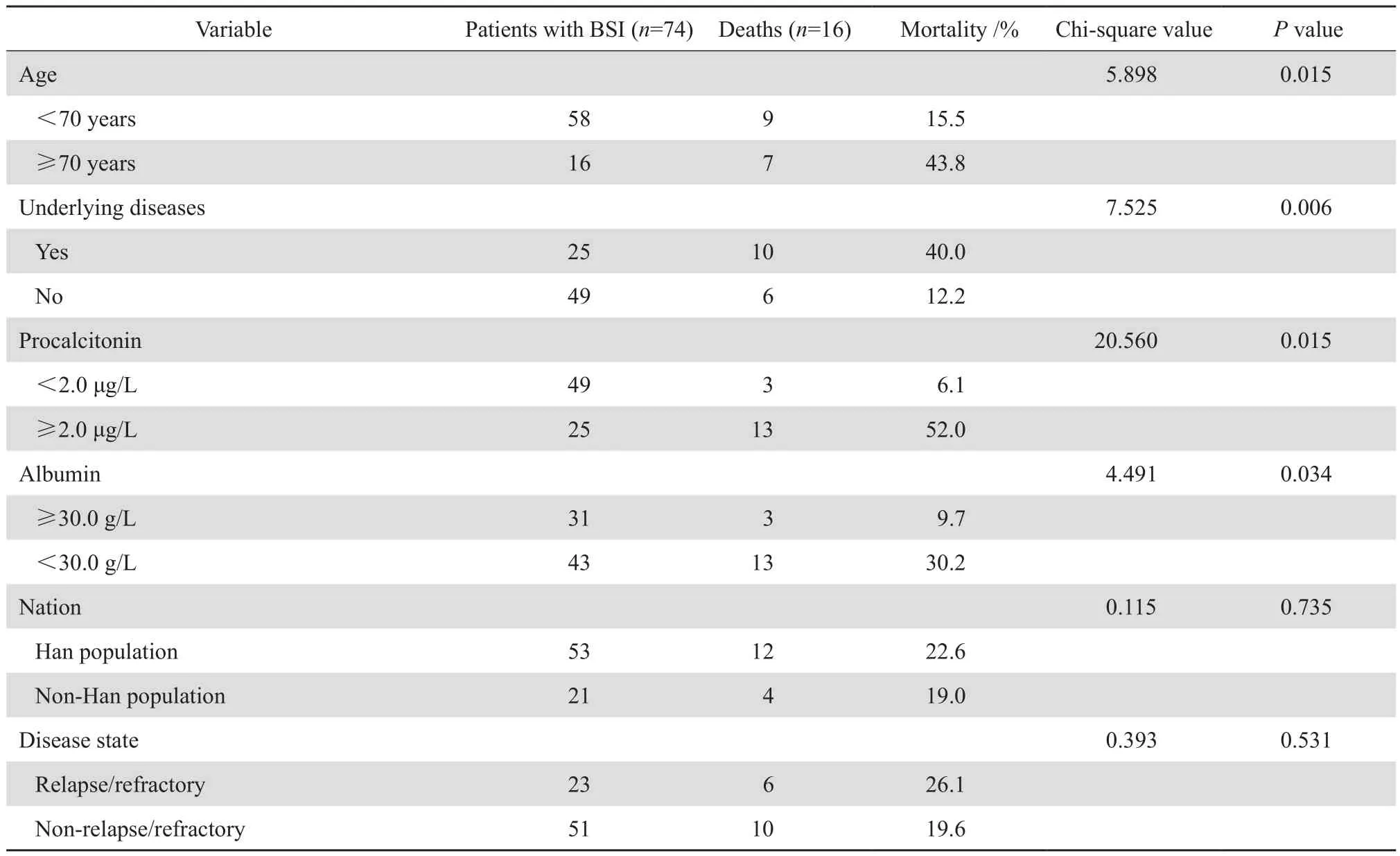
表4 血液病患者合并血流感染预后相关危险因素单因素分析Table 4 Univariate analysis of prognostic factors for the outcome of hematological patients complicated with bloodstream infection
合并基础疾病的患者发生血流感染后28 d内死亡的概率是无基础疾病的8.059倍,P=0.014,差异有统计学意义;PCT≥2.0 μg/L的患者发生血流感染28 d内死亡的概率是PCT<2.0 μg/L患者的37.921倍,P<0.001,差异有统计学意义;白蛋白 <30.0 g/L的患者发生血流感染28 d内死亡概率是白蛋白≥30.0 g/L的7.163倍,P=0.041,差异有统计学意义。分析结果显示:合并基础疾病、PCT升高(≥2.0 μg/L)及白蛋白降低(<30.0 g/L)是凉山地区血流感染28 d内死亡的独立预后危险因素。见表5。
3 讨论
血液病患者常因粒细胞缺乏,激素、化疗、免疫抑制剂等应用易继发感染而威胁生命。了解血液病患者感染的病原菌分布及其流行变迁的趋势,同时兼顾患者的预后因素评估对于提高大部分感染患者治疗的准确性具有重要意义。本研究显示,2015年1月1月-2019年12月31日我院血液科血液病患者血流感染细菌分布以革兰阴性菌为主,占70.3%,其次是革兰阳性菌和真菌,分别占25.7%和4.1%。前五位致病菌分别为大肠埃希菌(39.2%)、肺炎克雷伯菌(14.9%)、金黄色葡萄球菌(6.8%)、屎肠球菌(4.1%)及阴沟肠杆菌(4.1%)。与2018年CHINET中国细菌耐药性监测报道一致[2]。

表5 血液病患者合并血流感染预后危险因素多因素logistics回归分析Table 5 Logistics regression analysis of prognostic factors for the outcome of hematological patients complicated with bloodstream infection
大肠埃希菌和肺炎克雷伯菌是导致近年四川省肿瘤患者感染的主要病原菌。耐药性监测结果显示,这些细菌对第一、二代头孢菌素具有较高的耐药率;大肠埃希菌对第三代头孢菌素的耐药率也高于 50% ,肺炎克雷伯菌的敏感率稍高,耐药率低于30%;二者对碳青霉烯类抗生素以及含 β内酰胺酶抑制剂的复合制剂具有较高的敏感率,可考虑作为经验用药[8-11]。本组资料结果显示,本院血液病合并感染中也是以大肠埃希菌、肺炎克雷伯菌为主,对碳青霉烯类抗生素以及含 β内酰胺酶抑制剂的复合制剂具有较高的敏感率。阴沟肠杆菌均无对亚胺培南、美罗培南、厄他培南及替加环素耐药的现象。革兰阳性菌感染以金黄色葡萄球菌及屎肠球菌为主,对多数抗菌药物耐药,但对达托霉素、莫西沙星、四环素、万古霉素及利奈唑胺显示了良好的敏感性,有1株屎肠球菌对万古霉素耐药,对利奈唑胺尚无耐药发生。真菌感染率较低,但仍需继续监测。
本研究通过综合患者年龄、合并基础疾病、民族、疾病治疗的状态、PCT及白蛋白水平进行单因素分析,结果发现血流感染患者在不同的年龄组、合并基础疾病、PCT及白蛋白水平间差异存在统计学意义。进一步行多因素logistic回归分析显示:合并基础疾病、高PCT水平及低白蛋白水平是我院血液病患者血流感染28 d内死亡的独立危险因素。本研究中,合并基础疾病多为2型糖尿病,糖尿病合并血液病的血流感染患者死亡率明显高于对照组。糖尿病患者血糖过高有利于细菌繁殖,国内多个研究也显示有类似结果[12-13]。正常生理情况下,PCT水平<0.05 μg/L。全身性炎性反应时,免疫活性细胞进行黏附交流,促进炎性反应及PCT大量释放[14]。国内外研究表明,免疫功能正常的患者,PCT在全身细菌感染时异常增高,在病毒感染及局部炎症时升高并不显著,是全身性细菌感染鉴别诊断的重要指标[15]。国内顾闰夏等[16]的研究显示当血清PCT升高至2.0~<10.0 μg/ L或 ≥10.0 μg/L时,患者发生感染相关死亡的比例甚至高达25.0%或33.3%,需要引起临床高度重视。研究显示,血清PCT水平升高是患者发生感染性休克及感染相关死亡的独立危险因素。白蛋白是由肝细胞合成,低白蛋白血症可导致水肿,加重感染。本组资料显示低白蛋白血症组的死亡率更高(P=0.034)。多因素logistic回归分析显示:低白蛋白血症是我院血流感染28 d内死亡的独立危险因素,与国内多个研究结果一致[17-18]。
综上所述,我院血液病患者合并感染的病原菌与2018年CHINET中国细菌耐药性监测及四川省肿瘤患者感染报道一致,仍以革兰阴性菌为主,且以大肠埃希菌及肺炎克雷伯菌为主,耐药性分析显示,目前尚无明显耐药发生。因血液病患者自身免疫力及治疗过程的特殊性,更需要加强血液科与微生物室的沟通,指导临床合理选用抗生素,以减少患者危重感染的发生,避免耐药菌的出现。临床工作中不仅要对医院感染的病原菌流行情况进行了解,更要紧密结合临床资料综合判断以指导治疗,降低血流感染的死亡率。

