运动介导肠道微生物-肠-脑轴调控神经功能的机制
余 锋,贾芳芳,2,徐 帅,汪君民,张宪亮
(1.淮阴师范学院体育学院,江苏淮安223300;2.苏州大学体育学院,江苏苏州215021;3.山东大学体育学院,山东济南250061)
肠道微生物与肠-脑轴及其与神经相关功能的研究近年来受到广泛关注。肠道微生物与其寄居的肠道微生态环境在机体健康维护和疾病发展中的作用不容忽视。肠道微生态的失调是许多疾病的关键诱因,包括与其直接发生联系的消化系统疾病、与其存在间接关联的心血管系统及神经系统等疾病。肠道神经系统(enteric nervous system,ENS)与中枢神经系统(central nervous system,CNS)通过一系列中间神经通路相联系,肠道微生态的改变可通过ENS影响CNS的活动,进而参与神经功能的调控过程,如心理、行为、认知、情感和神经疾病[1]等。研究发现,肠道微生态环境的失调与阿尔茨海默病(Alzheimer's Disease,AD)[2]、帕金森病(Parkinson's Disease,PD)[3]、亨廷顿病(Huntington's Disease,HD)[4]和 多 发 性 硬 化 症(Multiple Sclerosis,MS)[5]等神经功能障碍性疾病密切相关。运动科学研究证实,科学的运动干预可促进脑高级功能,延缓神经功能障碍[6],改善AD 患者的学习记忆、降低其患病风险[7-8],优化 PD 患者[7,9]和 HD患者[10-11]的记忆能力、步态和肌肉力量,改善其运动能力。然而,运动干预能否通过改善肠道微生态环境进而通过肠-脑轴的联络促进神经功能、缓解或改善神经退行性疾病,目前尚无确切结论。笔者基于肠道微生物-肠-脑轴理论,分析运动介导肠道微生物调控神经功能相关的研究,探讨肠道微生物在运动干预改善神经功能中的作用机制。
1 肠道微生物、肠-脑轴与神经功能
1.1 肠道微生物与肠-脑轴
人类肠道中的微生物约 1013~1014个[12],与人体细胞总数相比,分布在体内和体表的微生物数量更加庞大。寄生于肠道的微生物群落已进化成为与其宿主具有共生关系的整体,介入宿主的整个生命过程。肠道微生物群总基因数约为人类总基因数的150 倍以上[13]。肠道壁内具有众多可感知肠道内环境变化的神经细胞,能根据肠道理化环境的改变进而自主调节肠道内的代谢与内分泌等活动,被称为肠道神经系统或“肠脑”,也被称为“机体的第二大脑”[14]。
美国学者于19 世纪末最早提出了“肠脑”的概念,使肠道系统与神经系统之间的关联进入学界。在1981年意大利佛罗伦萨召开的国际会议上,正式提出了脑-肠轴(brain-gut axis)[15]的概念。在脑-肠轴的研究基础上,2011年一个新的概念——微生物-肠-脑轴(microbiota-gut-brain axis)[16]被提出来,为探析肠道微生物与脑健康和神经系统的病因关系提供了新的方向。随着相关研究的展开,肠-脑之间的生物学关联逐渐深入。微生物-肠-脑轴将肠道微生物与肠道、神经系统在结构上串联起来,发挥介导肠道功能、神经功能和神经疾病的作用[17-19],为肠-脑健康的维持与疾病的干预找到了新的思路和靶标。
1.2 肠道微生物与神经功能
“不健康的肠道”可能导致“不健康的大脑”[18],肠道微生物群失衡(或肠道失调)是导致神经退行性变的重要诱因[20]。定植于肠道的微生物群可影响宿主的营养状况和脑高级功能[21],微生物群的多样性和均衡性可促进健康、改善脑的学习记忆能力和机体行为的灵活性[22]。临床研究和动物实验[23]均证明,肠道微生物与神经功能的关系在神经与精神疾病的发展中起重要作用,而微生物失衡及其多样性异常与学习记忆能力损害高度相关。肠道微生物群的构成与诸多因素关系密切,是胃肠道内辅助消化、营养物质摄取、合成、吸收及代谢物排泄等过程的调节者。同时,肠道微生物可通过与病原微生物竞争营养素、产生抗菌素等途径保护肠上皮完整,增强肠道的免疫功能[24]。肠道微生物群的失衡可导致肠道完整性缺失及功能受损,致使肠道通透性增加和肠道炎症,破坏肠道微生态,进而通过肠道与中枢之间的神经联系、免疫炎症因子、肠道代谢产物及通过下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴调节的肠道内分泌功能等途径,引起肠-脑轴间的信息传递障碍和神经功能异常[25],诱发相关神经退行性疾病[26]。
肠道功能失调可导致神经功能障碍[27],肠道微生物的缺乏可致使无菌小鼠学习记忆能力的显著性缺陷[28],表明肠道微生物与肠-脑联络及其与神经功能之间存在重要关联。肠道微生物具有高度复杂性、多样性和一定的自我恢复能力,在不同个体间以及在健康和疾病等不同身体状态下,肠道微生物均存在一定的差异[24]。肠道微生物群亦是一个多变性的微生态系统,不断受到机体内外环境,如运动、饮食、应激或使用抗生素等的影响而发生变化(图1)。人体研究和动物实验均发现,运动干预可通过介导肠道微生物群而调控机体的健康状态或疾病发展,尤其可通过调控神经功能而抑制神经疾病。肠道微生物所构成的多变性微生态系统,为神经功能的运动调控提供了新兴干预靶点。
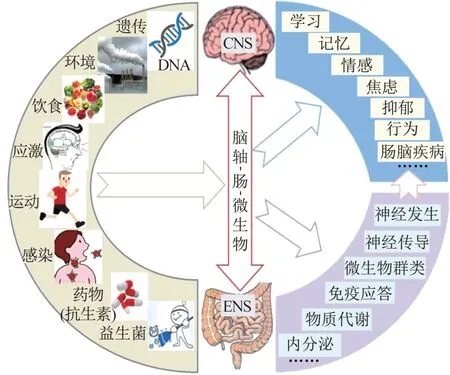
图1 影响肠道微生物的因素及其对神经功能的影响示意Figure 1 Factors affecting gut microbiota and their effects on nervous function
2 运动介导肠道微生物改善神经功能的可能机制
肠道微生物与神经系统存在直接或间接的联系:肠道是微生物生存与代谢的场所,肠道微生物是机体免疫调控的重要参与者,可分泌炎性细胞因子,直接或间接影响神经炎症状态;肠道还是机体的重要消化场所,具有内分泌功能,可分泌神经递质作用于神经系统的调节过程;肠道系统具有丰富的肠道壁内神经,通过迷走神经与中枢神经系统建立联系,传递肠-脑信息沟通。因此,肠道功能及其微生物群的稳态可影响神经功能,规律的运动干预可通过调控肠道微生物介导肠-脑间的联络。
2.1 运动介导肠道微生物多样性干预神经功能
对肠道微生物群多样性的调节是运动干预最显著的作用,大量人体研究和动物实验均证明,运动干预可通过调节肠道微生物菌群的多样性,进而改善胃肠功能,缓解或治愈疾病,促进健康。研究[29-33]发现,运动干预可增加结肠微生物多样性,改善结肠的健康状况。运动干预可促进肠道内有益菌群和致病菌群之间的平衡[34]。动物实验[35-36]发现,运动干预可引起不同模型(肥胖、非肥胖和高血压)大鼠的肠道微生物群组成的变化。不同运动模式,如自主运动[37-38]和跑台运动[39-40]均可调节实验动物肠道微生物群的多样性与丰度的变化,促进肠道功能的增强。AD 小鼠实验[41]发现,运动干预可降低AD 小鼠肠道内普雷沃菌属、厌氧菌属、松脆杆菌属和约氏乳杆菌属等参与疾病恶化的微生物群丰度,增加真细菌属、罗氏菌属和梭菌属等有益于短链脂肪酸(short⁃chain fatty acids,SCFAs)产生的微生物水平,抑制AD 小鼠脑内病理组织学标志物β-淀粉样蛋白斑块的沉积,提升了AD小鼠在Morris 水迷宫和Y 迷宫等实验测试中的学习与记忆能力。人体研究[42-43]发现,运动员的肠道微生物群的多样性显著优于非运动员。长期的运动训练可促进运动员肠道菌群适应性的增强,对运动刺激强度的反应性加快,并可通过富集肠道益生菌,对机体高强度训练产生损伤性保护作用[42]。对普通健康人群的研究[44]也发现,经常运动人群较静坐少动人群肠道微生物的良性改变。运动对肠道硬壁菌门和放线菌门调节作用较显著,运动可增加肠道中罗氏菌、巴氏粪杆菌和瘤球菌等丁酸产生菌的种类[32,45],证明运动干预对微生物种类具有积极影响。因此,运动干预可通过调节肠道微生物群的种类,增加有益微生物群,降低有害微生物群的丰度,改善肠道微生态的多样化,进而通过肠-脑轴介导神经功能的增强(表1)。
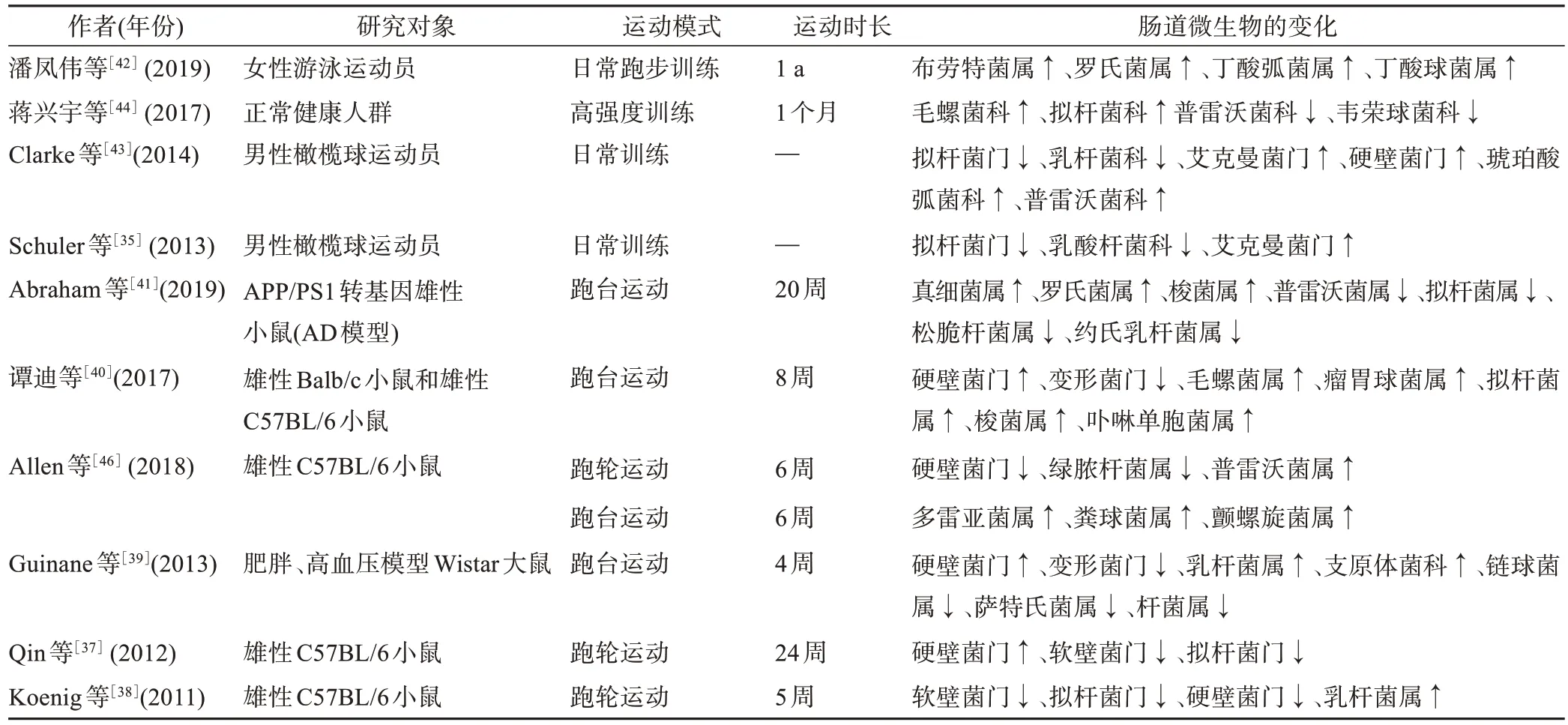
表1 运动对肠道微生物群的调节作用Table 1 The effects of exercise on gut microbiota
2.2 运动介导肠道免疫干预神经功能
肠道是微生物寄居和生存的主要场所,肠道免疫功能的正常与否受肠道微生物的影响。运动调节机体免疫系统与肠道微生物群关系密切[47-48]。Allen等[46]通过动物实验发现,42 d 的自主运动促进了小鼠肠道微生物群定植,如上调了丁酸弧菌属、艾克曼菌门、毛螺旋菌科、瘤胃球菌属和副杆状菌属等肠道微生物群的丰度,下调了普雷沃菌属的丰度,同时下调了肠道内促炎性因子白介素⁃1β/23(interleukin⁃1β/23,IL⁃1β/23)和吲哚胺 2,3 双加氧酶(indoleamine 2,3 dioxygenase,IDOl)和肿瘤坏死因子α(tumor necrosis factor⁃α,TNF⁃α)的表达,进而改善肠道炎症,缓解诱导性结肠炎反应。16周游泳运动促进了实验小鼠肠道免疫球蛋白A(immunoglobulin A,IgA)的生成,B细胞和T细胞数量减少,白介素⁃4/6/10/12(interleukin⁃4/6/10/12,IL⁃4/6/10/12)、转化生长因子⁃β(transforming growth factor⁃β,TGF⁃β)和 TNF⁃α 的基因表达上升,而白介素⁃2(interleukin⁃2,IL⁃2)基因表达下降[49]。其他通过跑轮运动[29,50-52]和跑台运动[53-54]的研究同样证实运动通过调节实验动物肠道炎症因子水平,改善了肠道炎症。运动诱导的肠道IgA水平升高可增强实验小鼠对肠道病原体感染的抵抗力,并促进肠道微生物群的定植,进而改善肠道微生物的组成[55]。临床研究[52,56]证实,运动干预可增加肠道淋巴细胞中的关键抗氧化酶过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH⁃Px)、抗炎细胞因子白介素⁃10(interleukin⁃10,IL⁃10)和抗凋亡蛋白Bcl⁃2,同时降低促炎细胞因子TNF⁃α、白介素⁃17(interleukin⁃17,IL⁃17)、促凋亡蛋白Caspase⁃3/7,进而缓解肠道炎症,改善肠道微生物的寄居环境。研究[57]发现,炎症性肠病患者的肠道微生物群明显异常。运动可通过调节抗炎细胞因子发挥抗炎作用,因在骨骼肌活动中,肌细胞可分泌IL⁃6,运动时循环血液中的IL⁃6水平可增加100倍[58],IL⁃6 可进一步触发 IL⁃10、IL⁃1 受体拮抗剂(interleukin⁃1 receptor antagonist,IL⁃1ra)及 TNF 受体(tumor necrosis factor receptor,TNF⁃R)的分泌进而发挥抗炎作用,预防慢性炎症疾病[59]。然而,运动诱导的骨骼肌细胞释放的IL⁃6及其他抗炎细胞因子能否通过血液循环进入肠道系统,进而调节肠道免疫,以及对肠道微生物群产生影响,尚未见报道。综上动物实验和临床研究可知,运动可通过调节肠道炎症相关细胞因子与肠道微生物之间的双向关系介导肠道免疫功能,进而通过肠⁃脑轴间联络,缓解神经炎症,改善神经免疫,增强神经功能(表2)。
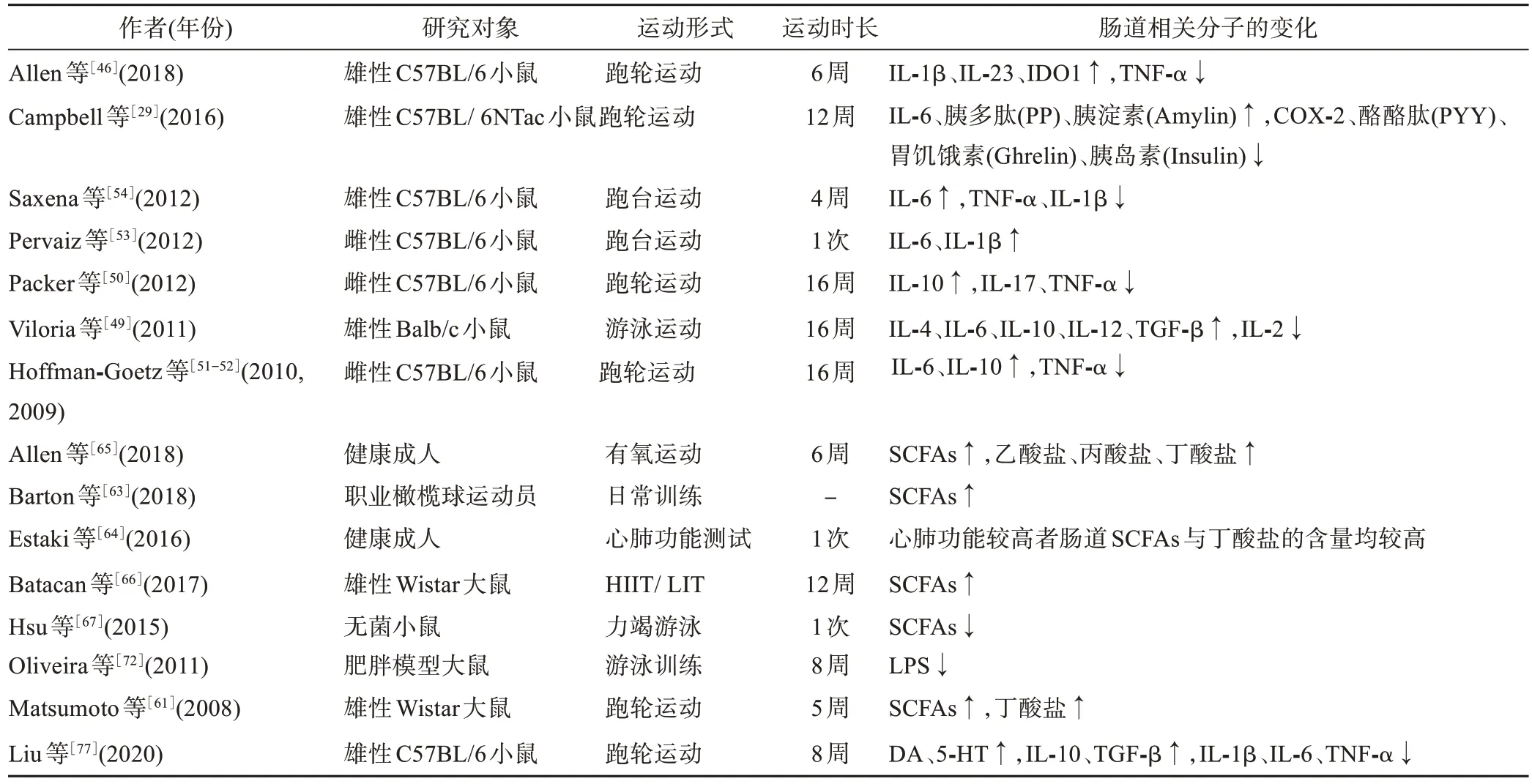
表2 运动对肠道炎症因子、代谢物和神经递质的影响Table 2 Effects of exercise on gut inflammatory factors,metabolites and neurotransmitters
2.3 运动介导肠道代谢干预神经功能
肠道的物质代谢受肠道微生物的影响和调控。肠道微生物可有效调控肠道内的物质代谢,特别是对脂代谢的作用显著,肠道微生物失衡会导致脂代谢障碍[60]。肠道微生物的种类和构成决定了其衍生代谢物,如SCFAs 和脂多糖(lipopolysaccharide,LPS)等的水平。运动可通过调节肠道微生物的代谢产物介导肠⁃脑轴间的神经联络,影响神经功能(表2)。
(1)运动对SCFAs 的调节。SCFAs 中乙酸、丙酸和丁酸等是肠道微生物发酵的主要终产物[29]。各种SCFAs 之间的平衡与肠道健康和肠道神经传导关系密切,如丁酸盐的浓度与黏蛋白的产生有关,可发挥肠道抗炎作用,并增加紧密连接蛋白水平,最终维持肠道屏障的结构、减少肠黏膜的通透性[29,61]。此外,丁酸盐还是结肠细胞的主要能量来源[62]。人体研究[63-65]和动物实验[29,46,61,66-67]均证实运动干预促进了肠道微生物群代谢产物 SCFAs 的增加。Allen 等[65]发现,有氧耐力训练可促进体瘦受试者肠道毛螺菌属和粪便细菌及SCFAs增加,而肥胖受试者肠道拟杆菌和柯林斯菌数量增加、粪便细菌数量减少,表明肠道功能的改善与瘦体质量的变化和脂肪代谢的增加有关。对运动员肠道微生物群的分析发现,其肠道内氨基酸合成率、碳水化合物吸收率和SCFAs 产生率均增加[63]。运动员肠道内可发现由肠道微生物分解蛋白质、纤维素和不易消化的淀粉等营养素产生的醋酸盐、丙酸盐和丁酸盐等SCFAs代谢产物[68]。运动干预可通过改善结肠的营养状况,降低患肠易激综合征(irritable bowel syndrome,IBS)和结肠癌的风险[69]。动物实验[70]发现,丁酸盐可刺激小鼠海马齿状回的神经增殖,尤其是可诱导成年啮齿动物缺血性脑损伤后的神经发生。因此,运动可通过介导肠道微生物代谢产生的SCFAs调控肠道的代谢功能。
(2)运动对LPS 的调节。LPS 是肠道内发挥负性调节作用的代谢产物,肠道微生物群失调可产生大量LPS 进入血液循环,诱发机体的内毒素血症和全身慢性炎症反应[71]。运动可通过调节肠道微生物代谢产生的LPS 介导相关细胞信号通路,该途径可通过LPS激活骨骼肌中的 Toll 样受体(Toll⁃Like Receptors,TLRs)实现[72]。肠道微生物代谢产生的LPS经血液循环至骨骼肌,可激活TLR4 和TLR5 受体,其活化程度取决于肠道微生物群的组成[73]。由特定肠道微生物代谢产生的LPS 可通过刺激TLRs激活核因子活化的B 细胞 κ 轻链增强剂(nuclear factor kappa⁃light⁃chain⁃enhancer of activated B cells,NF⁃κB),触发骨骼肌中产生炎性细胞因子[74]。研究发现,食用乳酸菌可通过上调2型糖尿病大鼠肠道乳杆菌属的丰度抑制革兰氏阴性菌属分泌LPS[75],运动可通过抑制高脂膳食大鼠肝脏、肌肉和脂肪组织中TLR4信号通路,改善肠道内脂代谢,降低LPS的血清水平[76]。
综上可知,运动可调控肠道微生物的代谢产物,改善肠道功能与神经系统之间的联系,表明运动对肠道和脑的积极作用可能通过调节肠道微生物的代谢来实现(表2、图2)。

图2 运动调节肠道微生物代谢介导神经功能示意Figure 2 Exercise regulates gut microbial metabolism mediating nervous function
2.4 运动介导肠道内分泌干预神经功能
肠道微生物是肠道内分泌系统的重要参与者,可参与和调节肠道的分泌活动,包括经典神经递质的分泌以及非经典神经递质如神经营养因子的分泌等。运动可通过调节微生物介导的肠道内分泌活动影响肠⁃脑轴间神经联络,改善神经功能。
(1)运动对肠道神经递质分泌的调节。肠道中的神经递质种类繁多、功能复杂,在维持肠道神经与中枢神经之间的信息交流中发挥重要作用。肠道微生物可分泌5⁃羟色胺(5⁃hydroxytryptamine,5⁃HT)、多巴胺(dopamine,DA)和去甲肾上腺素等经典神经递质,进而通过肠道神经传导系统影响中枢的兴奋或抑制状态[78]。运动对脑的调控可通过调节肠道微生物群神经递质的分泌发挥作用,其中,5⁃HT 发挥重要作用。研究发现,肠道是5⁃HT 产生的主要来源[79],无菌小鼠的相关行为可因肠道内5⁃HT 信号变化而改变[80]。肠道微生物群中的乳酸乳球菌、植物乳杆菌、嗜热链球菌、摩根氏菌和肺炎克雷伯菌等可分泌5⁃HT[81],这些产生 5⁃HT 的菌株主要来自乳酸杆菌属(硬壁菌门),运动可能通过调节肠道微生物的多样化促进这些菌株的增加[39-40,82]。运动锻炼(如跑步)可促进肠道5⁃HT 的分泌,同时,运动还可促进脑内5⁃TH的合成和代谢加快,抑制神经焦虑症[83]。Liu 等[77]最新研究发现,8 周的跑轮运动通过介导实验小鼠肠⁃脑轴间的化学改变,促进了DA 和5⁃TH 表达,同时改善了肠道和脑的功能,缓解了小鼠的抑郁症状。研究[84]还发现,运动干预可调节肠道内胃饥饿素、神经肽Y、胆囊收缩素等脑肠肽类激素的水平,缓解机体的焦虑或抑郁样行为。运动诱导的肠道5⁃HT 或脑肠肽等分泌增多可能在一定程度上解释了受试者身体活动后焦虑和抑郁等应激相关症状减轻的现象。此外,大强度运动可诱导肠道通透性改变,是导致肠道激素或神经递质紊乱和微生物代谢失调的重要因素。研究[85]证实,长时间的剧烈运动可导致大脑的谷氨酰胺耗竭增加,诱发肠道通透性增加和肠黏膜细胞分泌神经递质γ⁃氨基丁酸(γ⁃amino butyric acid,GABA)的紊乱,进而对GABA⁃谷氨酸稳态产生负性调节作用,诱导疲劳发生。
(2)运动对肠道神经营养因子分泌的调节。神经营养因子(neurotrophic factors,NFs)属于非典型神经递质,但其同样可介导外周和中枢之间的神经联系。NFs 本身又具有多种家族成员,是一类在外周和中枢神经系统中均可发挥生物学效应的蛋白分子[86]。NFs在神经元的生长、发育及凋亡等过程中发挥重要作用,可促进神经元的增殖、分化、成熟、突触发生等[87]。研究[88]发现,NFs 对肠道神经元的生长和功能维持具有重要意义,肠道中NFs 的缺失可影响微生物的生存并导致肠道神经元的功能障碍。在诸多NFs 中,脑源性神经营养因子(brain⁃derived neurotrophic factor,BDNF)在运动调控神经功能中发挥着尤为关键的作用。BDNF 可促进神经发生,对认知功能至关重要,BDNF 的基因缺失会导致小鼠神经细胞异常凋亡。BDNF 是胃肠道紧密连接蛋白的关键调节因子,无菌小鼠海马和大脑皮层BDNF 表达低于正常小鼠[89]。BDNF 在运动干预调节学习、记忆和情感等脑高级功能中起着关键作用[90]。海马中BDNF 水平降低与焦虑和IBS 及炎症性肠病等相关[91]。动物实验发现,益生菌补充和运动干预均可促进实验动物脑BDNF 的表达[92],有氧运动可通过调节实验动物肠道中的双歧杆菌丰度增加BDNF 表达[45],表明运动可通过调节肠道双歧杆菌介导神经系统BDNF 的表达。但目前尚未发现运动调控肠道BDNF 水平进而介导肠-脑间神经或化学联络的直接证据,这也是今后研究的一个关注点。
综上研究表明,运动可通过调节肠道微生物介导肠道神经递质的分泌,影响肠-脑轴间的化学信号传导,进而调控和改善神经功能(表2)。综合2.2~2.4 所述,结合表2所列研究发现,运动干预可通过调节肠道微生物介导的炎症因子、代谢产物、神经递质或激素的改变,调控肠-脑轴间联络,影响神经功能。
2.5 运动介导肠道微生物调控肠-脑轴间神经传导
肠道具有完整的神经结构(ENS)与功能,由肠道壁内平滑肌间神经丛组成,位于肠道的纵行平滑肌和环行平滑肌之间,是独立于CNS的内源性神经网络系统。肠道神经元可释放调节肠道蠕动、内分泌、血液循环和物质转运等活动相关的神经递质,是连接肠道与CNS 的桥梁,故ENS 可看作是肠道内的大脑(肠脑)。肠道微生物构成的变化可通过直接或间接途径影响CNS 功能。ENS 与CNS 之间的直接联系是迷走神经通过突触结构传递肠⁃脑轴间的信息,形成“肠道微生物⁃ENS⁃迷走神经⁃CNS”的信息传递方式[93]。ENS 与CNS 之间的间接联系是通过相关分子或神经递质发挥作用,如肠道微生物介导产生的SCFAs、膳食氨基酸和细胞因子等[94]。肠道微生物可通过将机体摄入的碳水化合物降解为SCFAs,其可穿过血脑屏障(blood brain barrier,BBB),维持下丘脑胶质细胞的能量供应及促进厌食神经肽的表达[95]。
运动可增强迷走神经活动、降低交感神经活动,促进迷走神经与交感神经对身体机能的良性调节作用,如运动对心率、呼吸和肠道运动的调节[96]。研究发现,运动锻炼可通过调节迷走神经介导HPA轴改变肠道微生物群[31],有氧运动可通过调节肠道代谢产物多样性增强迷走神经活动[97]。运动可促进肠道微生物代谢产生 SCFAs 的增多[46,63,65-66],进而激活肠道迷走神经的传入受体[98],增强迷走神经的信息传递效应。但剧烈运动可引起肠源性LPS 易位和白细胞增殖跨越BBB,改变DA 能系统,导致神经功能障碍和中枢疲劳[99]。提示,SCFAs 和 LPS 可作为运动调控ENS 与CNS 间的干预媒介,运动可通过对SCFAs 和LPS的介导作用,促进微生物⁃肠⁃脑轴间的信息传递。此外,长时间大强度运动可通过消耗脑内谷氨酰胺引起肠道通透性和神经递质GABA 的代谢紊乱,诱发GABA⁃谷氨酸稳态失调[85]。这表明运动介导ENS 与CNS 之间的神经信息传递既可通过直接调控迷走神经的活动触发,也可通过调控肠道微生物的代谢产物和神经递质而间接发挥效应。
2.6 运动介导肠道微生物调控神经发生
神经发生与海马依赖性学习、记忆等脑高级功能关系密切,是脑组织产生新神经元的生物学基础。研究[100]表明,成年期哺乳动物的脑细胞依然具有产生新生神经元的能力,其中,脑边缘系统的海马齿状回颗粒细胞下层是终身产生新生神经元和神经元发生可塑性的区域。成人神经发生受机体的内在因素如细胞因子、神经递质、激素和神经营养因子等,以及环境应激、身体活动和饮食营养等机体外部因素的共同调节[101]。研究[102-103]发现,肠道微生物可影响脑的神经发生,益生菌介入可通过增强脑组织的神经发生降低小鼠的应激行为。动物实验证实,经无菌干预的小鼠学习记忆能力会下降[28],同样,使用抗生素抑制肠道微生物群可导致小鼠学习记忆能力受损,且其脑组织中 BDNF 表达会显著减少[104]。因 BDNF 是神经生长和存活的关键神经营养素,其可能代表一种诱导神经发生的中枢效应器,而肠道微生物代谢产物[105]以及微生物诱导的炎性细胞因子[106]可能代表肠端的触发因素,微生物对神经发生的影响可能是肠道代谢和炎症环境改变而产生的间接作用。这些研究说明肠道微生物对脑的神经发生和脑高级功能具有重要作用。
运动干预可促进成年脑的神经发生,进而改善脑的学习与记忆功能、抑制神经退行性病变,已得到大量研究[107-109]证实,但先前的研究并未涉及肠道微生物的相关机制。Mohle 等[103]发现,采用自主跑轮运动干预和益生菌补充2种方式单独作用均促进了使用抗生素抑制肠道微生物群的实验小鼠脑组织神经发生,缓解了小鼠的记忆功能下降。据上文所述,研究[70]发现,肠道微生物代谢产生的SCFAs(主要是丁酸盐)可刺激和诱导小鼠海马组织的神经发生,缓解脑组织损伤;而先前大量研究均证实,运动干预可改善肠道微生物介导的炎症反应[29,46-54]及其代谢功能进而促进SCFAs 的产生[29,48,61,65-66],同时运动可调节肠道微生物促进脑内 BDNF 表达[45,92]。因而推测,运动调节肠道微生物介导的神经发生,可能与运动调节肠道代谢产生的SCFAs 等微生物代谢产物以及运动改善的肠道炎症环境,进而通过肠-脑轴间的神经联络和中枢BDNF 表达,诱导脑神经发生有关(图3)。但目前在运动科学领域,探讨运动介导肠道微生物调控脑神经发生的研究报道较少,肠道微生物是否为运动干预与脑神经发生之间的纽带,尚需深入探究。
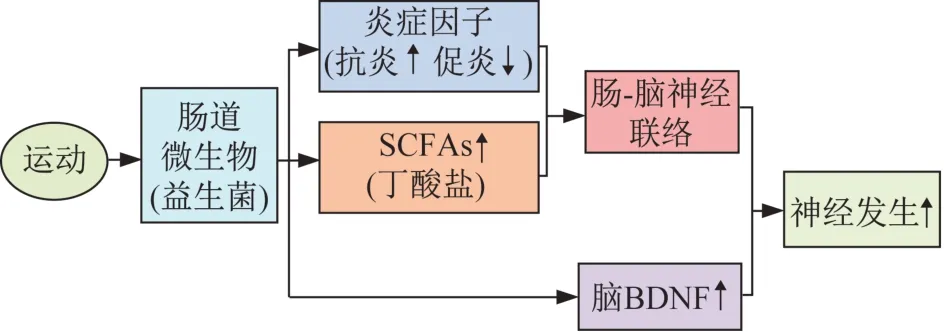
图3 运动调节肠道微生物介导神经发生示意Figure 3 Exercise regulates gut microbial metabolism mediating neurogenesis
综上所述,肠道微生物及其活动通过肠-脑轴间的神经途径和化学信号建立了肠-脑间的紧密联系。大量动物实验和部分人体研究证实,运动干预可通过调控肠道微生物及其活动,介导肠-脑间的神经联络。但目前运动调控肠道微生物介导精神疾病(如抑郁症[84])或神经退行性病变(如AD[41])的研究主要通过动物实验进行验证,且大多为间接证据,直接证据较少,而通过运动干预治疗精神疾病或神经退行性病变的人体研究案例更是鲜有报道。因此,除了加深对模型动物的运动干预研究外,应加快对精神疾病或神经退行性病变患者的运动干预工作。
3 结论与展望
肠道微生物与高级神经功能的学习、记忆与情感等关系密切,运动对肠道微生物和神经功能及神经疾病具有积极的影响。综合运动对肠道微生态的良好效应,适宜运动可能通过增加消化系统的血液、氧与营养的供应,刺激胃肠的蠕动,促进胃肠道消化液的分泌,提高肠道微生物菌群的种属及其生态平衡,进而优化肠道微生态,降低肠源性疾病的风险。其深层机制可能与运动调节肠道微生物的多样性,改善肠道免疫、肠道代谢、肠道内分泌和肠-脑神经传导,介导神经发生等调控ENS 与CNS 之间的肠-脑轴联系,进而增强神经可塑性、抑制神经功能障碍相关(图4)。然而,运动介导肠道微生物调控神经功能的机制尚不明确,探究运动介导肠道微生物调控神经功能对明晰运动干预神经退行性疾病的机制具有重要意义。

图4 运动调控肠道微生物-肠-脑轴的可能机制示意Figure 4 The possible mechanism of exercise regulating microbiota-gut-brain axis
目前该领域的研究还存在一定的局限性:①肠道微生态的多变性、复杂性与多样性等特征对运动干预所产生的影响带来了不确定性,运动干预是否还参与介导了其他相关调控途径,尚不明确;②运动介导肠道微生物-肠-脑轴调控神经功能和神经退行性疾病的动物实验和临床研究仍很有限,应加强运动干预AD、PD 和HD 等神经病理模型动物和病患者肠道微生物的研究;③运动对实验动物肠道微生物多样性的干预还存在不一致的结果,同种微生物在不同或相似的研究中呈现不同的变化结果,其原因尚不明确。今后应系统地研究肠道微生物的功能,从更广、更深层次的生物学机制探寻运动干预肠道微生物介导ENS与CNS中的可能变化,为运动干预肠道微生物与健康的维持、疾病的预防及其介入治疗提供依据。可考虑通过合理运动干预兼适当补充益生菌饮食的联合干预方式改善肠道微生态,进而影响肠-脑轴间的神经传导,改善神经功能,抑制神经退行性疾病。
作者贡献声明:
余 锋:提出论文选题,设计论文框架,检索、筛选文献,撰写、修改论文;
贾芳芳:协助检索、筛选文献,修改论文;
徐 帅:协助收集、整理部分外文文献;
汪君民:协助修改论文;
张宪亮:协助修改、审核论文。

