超选择前列腺动脉栓塞联合经尿道前列腺切除术治疗体积>80 mL良性前列腺增生的临床疗效
朱琳杰 王伟 王海东 赵新建
良性前列腺增生(BPH)是老年男性泌尿外科常见病之一,可引起排尿困难、尿潴留甚至血尿等多种症状[1]。目前临床治疗BPH常规采用经尿道前列腺切除术(TURP),但对于前列腺体积较大者存在手术时间长、术中出血量较多、难以彻底切除增生腺体及TURP综合征发生风险高等问题[2]。超选择性前列腺动脉栓塞术(PAE)是一种新型微创介入手术,其通过栓塞前列腺主要供血动脉及毛细血管,使该区域供血量减少,局部组织缺血坏死,前列腺体积明显缩小,故能够在一定程度上改善下尿路症状[3]。但对于前列腺体积较大的BPH病人单纯行超选择PAE治疗后,其前列腺体积较基线缩小往往不足20%,大部分需和其他治疗手段联合应用[4];而目前有关超选择PAE与TURP联合治疗的报道相对较少。本研究回顾性分析了我院2016年1月至2019年1月收治的84例前列腺体积>80 mL BPH病人的临床资料,探讨超选择PAE+TURP治疗体积>80 mL BPH的疗效及安全性,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析我院2016年1月至2019年1月收治的84例前列腺体积>80 mL BPH病人的临床资料,其中行单纯TURP治疗者44例为对照组,行超选择PAE+TURP治疗者40例为观察组。纳入标准:(1)影像学检查或穿刺病理活检确诊BPH[5];(2)前列腺体积>80 mL;(3)基线国际前列腺症状评分(IPSS)>20分;(4)年龄≥60岁。排除标准:(1)膀胱颈挛缩;(2)既往泌尿生殖系统手术史;(3)严重泌尿系统感染;(4)前列腺癌;(5)尿道狭窄;(6)神经源性膀胱;(7)泌尿系统畸形;(8)膀胱巨大结石。对照组年龄64~79岁,平均(72.90±5.34)岁,平均病程为(5.02±1.29)年,平均前列腺体积为(114.36±26.80) mL,其中合并膀胱结石6例,占总数的13.64%;观察组年龄63~80岁,平均年龄(70.86±6.71)岁,平均病程为(4.90±1.22)年,平均前列腺体积为(112.84±23.47)mL,其中合并膀胱结石6例,占总数的15.00%。2组一般资料比较,差异无统计学意义(P>0.05)。研究方案符合《赫尔辛基宣言》要求,病人及家属签署知情同意书。
1.2 治疗方法 全部手术均由同一组临床医师完成。观察组先行超选择PAE:术前常规留置尿管,局麻及数字减影血管造影(DSA)辅助下行Seldinger法完成右侧股动脉穿刺,经F5动脉鞘送至腹主动脉后行左右侧髂内动脉造影;继续采用F2.7微导管超选择性进入左侧前列腺主供血动脉,确定主供血动脉后选择性置入微导管,X线监视下缓慢注入明胶海绵完成栓塞,直至主干血流停滞;再行相同方法完成右侧前列腺动脉主干栓塞;术后常规预防应用抗生素2 d。如未见明显感染及并发症则观察组在术后4~5 d行TURP治疗。TURP治疗:选择硬膜外麻醉,采用奥林巴斯UES50型等离子双极电切镜切除增生组织,术前完成耻骨上膀胱穿刺造瘘引流,经尿道直视将电切镜置入膀胱内,观察确定增生及周围毗邻情况,首先自膀胱颈6点处向精阜侧切割中叶达包膜,再依次按照顺时针1~5点、逆时针11~7点切除两侧叶,最后清除前列腺组织碎块及电凝止血完成手术;术后常规留置F22气囊尿管。
1.3 观察指标 (1)记录手术时间、切除病变组织重量和速率、膀胱持续冲洗时间及尿管留置时间。(2)临床症状严重程度评价采用IPSS量表,总分35分,分值越高提示症状越严重[5]。(3)生活质量评价采用生存质量测定量表(QOL),总分6分,分值越高提示生活质量越差[5]。(4)膀胱功能评价指标包括最大尿流率(Qmax)和残余尿量(PVR),其中Qmax检测采用德国Ellipse公司生产的Nidoc-910型尿动力检测仪;PVR检测采用美国GE公司生产的Logiq 5型彩色多普勒超声诊断仪。(5)记录泌尿系统感染、再次出血、短暂性尿失禁及再次TURP发生情况,其中短暂性尿失禁判定标准为术后可见尿失禁症状但在24 h内消失。
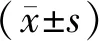
2 结果
2.1 2组手术相关临床指标比较 观察组的手术时间、膀胱持续冲洗时间及尿管留置时间均显著少于对照组(P<0.05),切除病变组织的质量和速率均显著大于对照组(P<0.05)。见表1。

表1 2组手术相关临床指标比较
2.2 2组手术前后IPSS评分、QOL评分、Qmax及PVR比较 2组术后IPSS评分、QOL评分及PVR水平均显著低于手术前(P<0.05),Qmax水平显著高于手术前(P<0.05);但上述指标2组间差异均无统计学意义(P>0.05)。见表2。

表2 2组手术前后IPSS评分、QOL评分、Qmax及PVR比较
2.3 2组术后并发症发生率比较 观察组术后并发症发生率显著低于对照组(P<0.05),见表3。
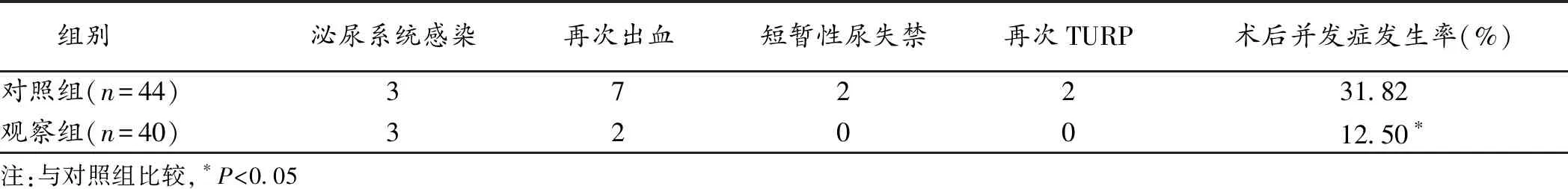
表3 2组术后并发症发生率比较(n)
3 讨论
BPH是一种临床进展性疾病,随着年龄增加,病情不断加重,前列腺体积显著增大。目前对于体积>80 mL BPH病人(特别是老年病人)单纯采用微创外科手术治疗难度较大,其中TURP应用存在较多局限,如创伤增加、操作时间延长等[6];同时该术式往往难以彻底清除增生前列腺组织,相当部分需再次电切治疗,严重影响病人治疗的依从性及耐受性[7]。尽管BPH病人前列腺体积与下尿路梗阻症状严重程度并非完全呈正相关,但仍需要根据腺体大小选择正确手术方式以保证疗效及安全性。对于前列腺体积较大的BPH病人,如何有效减少手术时间、降低医源性创伤程度及手术风险已成为医学界关注的热点问题。
超选择PAE属于微创介入治疗技术,其用于治疗BPH的机制为:阻断前列腺动脉主干供血,诱导前列腺缺血、萎缩及坏死,从而达到减小前列腺体积和缓解临床症状的目的[8]。有学者报道,超选择PAE治疗BPH后随访2年,治疗成功率可达93%,IPSS评分较基线水平下降15分,QOL评分则增加2分[9],提示该方案用于BPH具有可行性。同时因超选择PAE一般在局麻下完成,相较于传统TURP能够有效降低围手术期并发症,尤其适用于无法耐受全麻手术高危/高龄病人。但超选择PAE方案用于BPH亦存在明显缺点:仅能通过缩小前列腺体积进行症状改善,且往往需要较长时间[10]。Ayyagari等[11]研究发现,BPH病人行超选择PAE治疗后6个月,其前列腺体积较基线水平仅减少20%,近期症状改善有效率过低,同时中远期疗效评估研究亦缺乏。
本研究采用超选择PAE+TURP方案治疗体积>80 mL BPH病人,病人在行超选择PAE后4~5 d再给予TURP治疗,观察组的手术时间、膀胱持续冲洗时间及尿管留置时间均显著少于对照组(P<0.05),切除病变组织质量和速率均显著大于对照组(P<0.05),总体疗效令人满意。超选择PAE可以有效减少增生区域血供量,TURP手术操作过程中出血量随之减少,手术视野更为清晰,进一步降低手术操作难度,缩短操作时间[12]。病人接受超选择PAE治疗后2~4周,其前列腺动脉主干血液循环可再通,这对预防栓塞后会阴部放射痛、膀胱肠道缺血穿孔等并发症具有重要意义。此外,研究中采用的等离子双极电切镜的热穿透性、电切效率及安全性均优于传统单极设备,以生理盐水作为冲洗液亦有助于降低TURP综合征发生风险[13]。本研究结果还显示,2组术后IPSS评分、QOL评分及PVR水平均显著低于手术前(P<0.05),Qmax水平显著高于手术前(P<0.05);但上述指标2组间差异均无统计学意义(P>0.05),说明超选择PAE+TURP方案治疗体积>80 mL BPH远期疗效令人满意。
在安全性方面,观察组术后并发症发生率显著低于对照组(P<0.05),说明超选择PAE+TURP方案较单纯TURP在提高体积>80 mL BPH病人术后安全性方面具有明显优势。另外,对照组病人术后1年内有2例因排尿困难改善欠佳再次行TURP治疗,笔者认为这可能与单纯TURP术中出血量过多、视野欠清晰,为缩短手术时间而无法彻底清除前列腺腺体有关。而且单纯TURP术中医源性创伤较大、术后彻底凝血难度较大可能是对照组发生再次出血,情况更为严重的原因[14]。目前临床上对于超选择PAE+TURP治疗体积>80 mL BPH的适应证和禁忌证并无统一标准,笔者认为对于因前列腺增生体积过大所致急性下尿路梗阻症状且可耐受手术者均可考虑该方案。

