不同产地扁担藤茎原儿茶酸和香草酸含量测定的研究
丘琴,卢显兴,陈明伟,甄丹丹,黄秋艳,蒋兰兰,刘玉雯,甄汉深
(广西中医药大学 药学院, 广西 南宁 530200)
0 引言
扁担藤为葡萄科崖爬藤属植物扁担藤Tetrastigmaplanicaule(Hook.f.)Gagnep.,分布于广西各地,主要以藤茎、根入药,为广西壮医常用药材。壮医认为扁担藤具有祛风毒,除湿毒,通龙路、火路之功效,可用于治疗发旺(痹病),兵吟(筋病),林得叮相(跌打损伤),麻邦(半身不遂)等病症,现代药理研究表明,扁担藤具有抗氧化、抑菌、抗肿瘤等作用[1-5]。目前对扁担藤质量控制的研究,主要是对其性状和显微鉴别进行研究[6-7]。酚酸类成分是扁担藤的主要化学成分之一[8-10],现代药理研究表明,酚酸类成分具有抗过敏、抗氧化、抗肝癌作用,其中的原儿茶酸具有保肝、抗氧化、抑菌、抗炎等作用[11-13],香草酸具有抗菌、消炎、抗氧化,抑制酪氨酸酶活性,调节神经,抗血小板聚集等药理作用[14-15]。本课题以原儿茶酸和香草酸为指标,采用正交试验优选扁担藤茎的提取工艺,采用高效液相色谱法(HPLC)同时测定扁担藤茎中原儿茶酸和香草酸的含量,为建立扁担藤的质量控制方法和进一步开发利用提供科学依据。
1 实验材料
1.1 仪器
高效液相色谱仪(1100,美国安捷伦科技有限公司);色谱工作站(1100series,美国安捷伦科技公司);C18色谱柱(热电Thermo Hypersil ODS, 5 μm, 4.6 mm×250 mm);电子分析天平(SQP,赛多利斯科学仪器北京有限公司);超纯水器(美国理博公司);高速微量离心机(LG16-W,上海安亭科学仪器);电热恒温水浴锅(DK-98-ⅡA,天津市泰斯特仪器有限公司)。
1.2 试药
10批扁担藤药材分别产自广西省内不同产地(表1),经广西一心药业公司马利飞副主任中药师鉴定为葡萄科崖爬藤属植物扁担藤Tetrastigmaplanicaule(Hook.f.) Gagnep.的茎。阴干,打成粗粉,备用。原儿茶酸(中国食品药品检定研究院,批号:110809-201205,用于含量测定);香草酸(中国食品药品检定研究院,批号:110776-200402,用于含量测定)。

表1 扁担藤药材来源信息表Tab.1 Source information of Tetrastigma planicaule
1.3 试剂
甲醇和乙腈(色谱纯,美国Fisher科学世界公司);甲醇(分析纯,北京化工厂);乙醇(分析纯,北京化工厂);磷酸(85.0 %,国药集团化学试剂有限公司 );冰醋酸(99.5 %,上海试一化学试剂有限公司);水为超纯水。
2 方法与结果
2.1 提取工艺优选
2.1.1 单因素考察
2.1.1.1 提取溶剂的选择
由于原儿茶酸和香草酸均可溶于醇、水,参照《中华人民共和国药典(2015年版)》,分别考察了乙醇、甲醇、水、乙醇∶0.5 %冰醋酸(75∶25)、甲醇∶0.5 %冰醋酸(75∶25)等提取溶剂,具体方法如下:
① 取1号药材粉末约3 g,精密称定,加入10倍量的乙醇溶液,加热回流提取1 h,放冷过滤,滤液浓缩,定容至2 mL,得样品1溶液,备用。取样品1溶液,13 000 r/min离心10 min,取上清液进样,结果见图1。
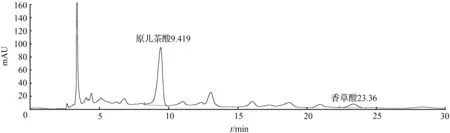
图1 扁担藤茎样品1溶液HPLC色谱图Fig.1 HPLC chromatogram of stem of Tetrastigma planicaule sample 1 solution
② 取1号药材粉末约3 g,精密称定,加入10倍量的甲醇溶液,加热回流提取1 h,放冷过滤,滤液浓缩,定容至2 mL,得样品2溶液,备用。取样品2溶液,13 000 r/min离心10 min,取上清液进样,结果见图2。
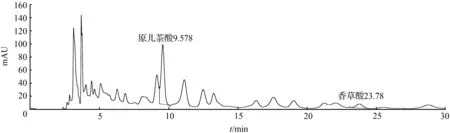
图2 扁担藤茎样品2溶液HPLC色谱图Fig.2 HPLC chromatogram of stem of Tetrastigma planicaule sample 2 solution
③ 取1号药材粉末约3 g,精密称定,加入10倍量的水溶液,加热回流提取1 h,放冷过滤,滤液浓缩,定容至2 mL,得样品3溶液,备用。取样品3溶液,13 000 r/min离心10 min,取上清液进样,结果见图3。
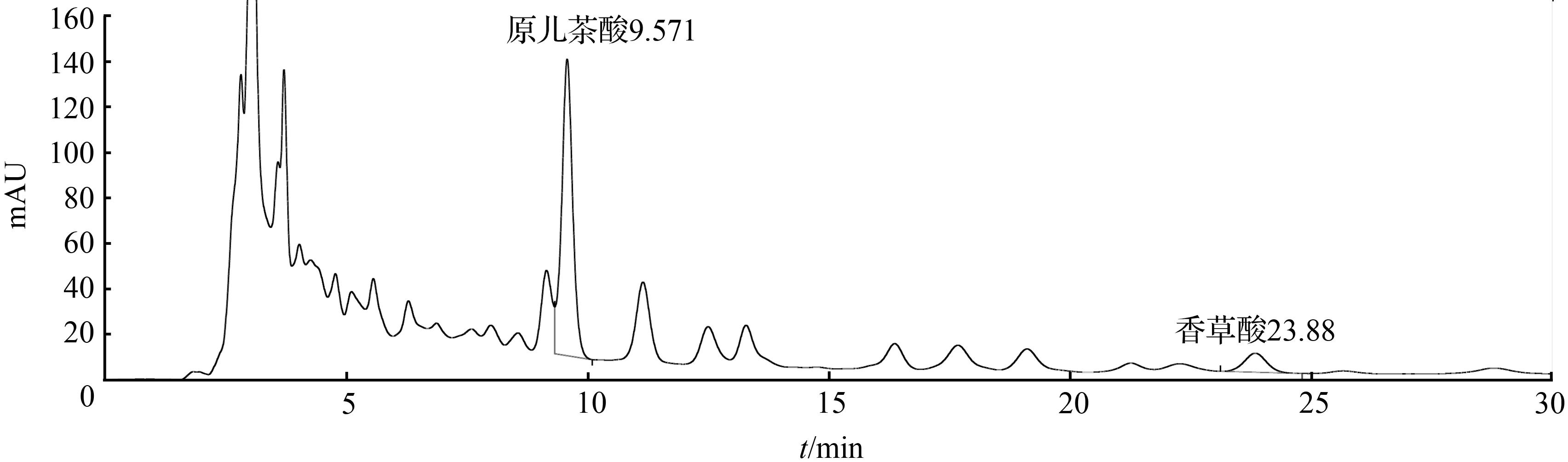
图3 扁担藤茎样品3溶液HPLC色谱图Fig.3 HPLC chromatogram of stem of Tetrastigma planicaule sample 3 solution
④ 取1号药材粉末约3 g,精密称定,加入10倍量的乙醇∶0.5 %冰醋酸(75∶25)溶液,回流提取1 h,放冷过滤,滤液浓缩,定容至2 mL,得样品4溶液,备用。取样品4溶液,13 000 r/min离心10 min,取上清液进样,结果见图4。
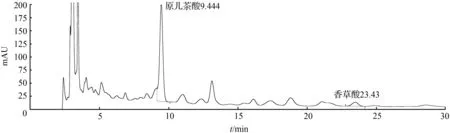
图4 扁担藤茎样品4溶液HPLC色谱图Fig.4 HPLC chromatogram of stem of Tetrastigma planicaule sample 4 solution
⑤ 取1号药材粉末约3 g,精密称定,加入10倍量的甲醇∶0.5 %冰醋酸(75∶25)溶液,回流提取1 h,放冷过滤,滤液浓缩,定容至2 mL,得样品5溶液,备用。取样品5溶液,13 000 r/min离心,取上清液进样,结果见图5。
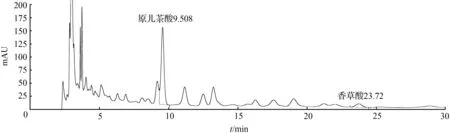
图5 扁担藤茎样品5溶液HPLC色谱图Fig.5 HPLC chromatogram of stem of Tetrastigma planicaule sample 5 solution
⑥ 取1号药材粉末约3 g,精密称定,加入10倍量的甲醇∶0.5 %冰醋酸(75∶25)溶液,回流提取1 h,放冷过滤,滤液蒸干至无醇味再用乙酸乙酯萃取5次,每次10 mL,合并蒸干,用甲醇定容至2 mL,得样品6溶液,备用。取样品6溶液,13 000 r/min离心,取上清液进样,结果见图6。

图6 扁担藤茎样品6溶液HPLC色谱图Fig.6 HPLC chromatogram of stem of Tetrastigma planicaule sample 6 solution
根据以上6种提取溶剂的考察结果,采用甲醇∶0.5 %冰醋酸(75∶25)溶液,回流提取1 h,放冷过滤,滤液蒸干至无醇味再用乙酸乙酯萃取5次,分离效果较好,含量较高,故选择采用甲醇∶0.5 %冰醋酸(75∶25)溶液作为提取溶剂,乙酸乙酯作为萃取溶剂。
2.1.1.2 提取方法的选择
取1号茎粉末3份,每份3 g,精密称定,加入10倍量的甲醇∶0.5 %冰醋酸(75∶25)溶液,分别采用冷浸法、回流提取法、超声波提取法提取1 h,放冷过滤,滤液蒸干至无醇味再用乙酸乙酯萃取5次,每次10 mL,合并蒸干,用甲醇定容至2 mL,13 000 r/min离心,取上清液进样测定,结果见表2。结果表明:采用回流提取方法含量最高,故选用此方法。

表2 提取方法考察结果Tab.2 Investigation results of extraction method
2.1.1.3 提取次数的考察
取1号扁担藤茎粉末约3 g,精密称定,加10倍量的甲醇∶0.5 %冰醋酸(75∶25)溶液,回流提取1 h,放冷过滤,滤液蒸至无醇味再用乙酸乙酯萃取,将乙酸乙酯部分蒸干,用甲醇定容至2 mL,13 000 r/min离心,取上清液作为提取第1次的供试品溶液。将上述药渣再进行1次上述同样方法的提取,得到提取第2次的供试品溶液。从提取第2次的色谱图中可看到,香草酸的色谱峰已经接近与基线平,可知第二次已提取完全,结果见图7和图8。
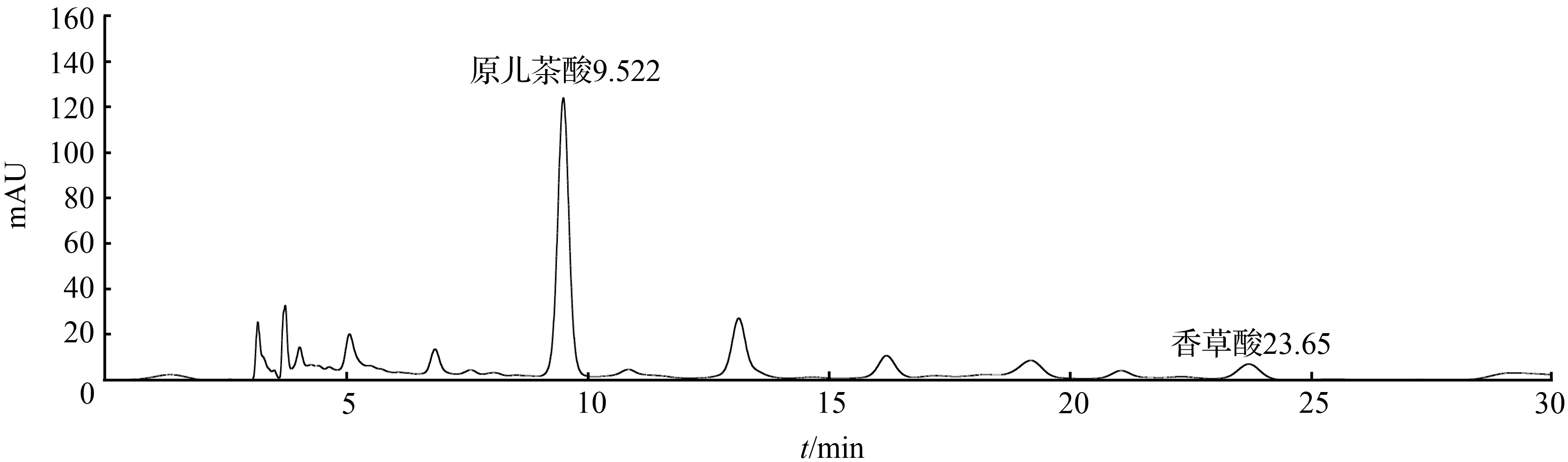
图7 扁担藤茎HPLC色谱图(回流提取第一次)Fig.7 HPLC chromatogram of stem of Tetrastigma planicaule (The first reflux extraction)
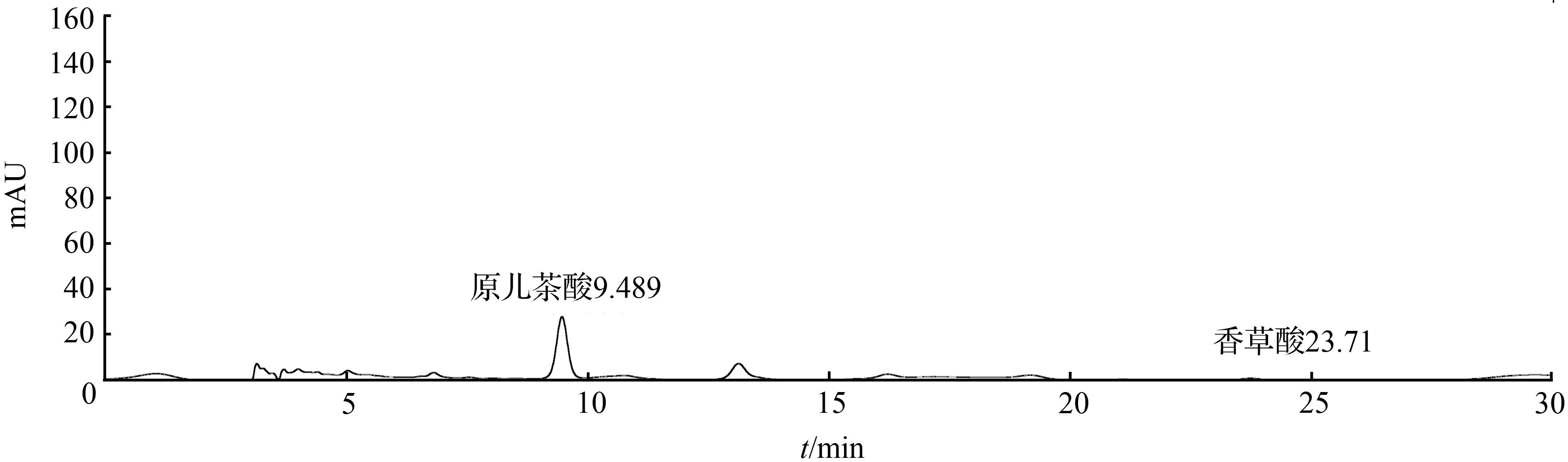
图8 扁担藤茎HPLC色谱图(回流提取第二次)Fig.8 HPLC chromatogram of stem of Tetrastigma planicaule (The second reflux extraction)
2.1.2 正交试验优选最佳提取工艺
在单因素考察的基础上,以原儿茶酸和香草酸的含量作为评价指标,选择不同提取溶剂比例A、料液比B、提取时间C为考察因素,采用 L9(34)表进行正交试验,优选出最佳的提取工艺。因素水平见表3,正交试验设计与结果见表4,方差分析结果见表5。

表3 正交试验设计因素水平表Tab.3 Factors and levels of orthogonal experiment

表4 正交试验设计与结果L9(34)Tab.4 Design and results of orthogonal experiment L9(34)
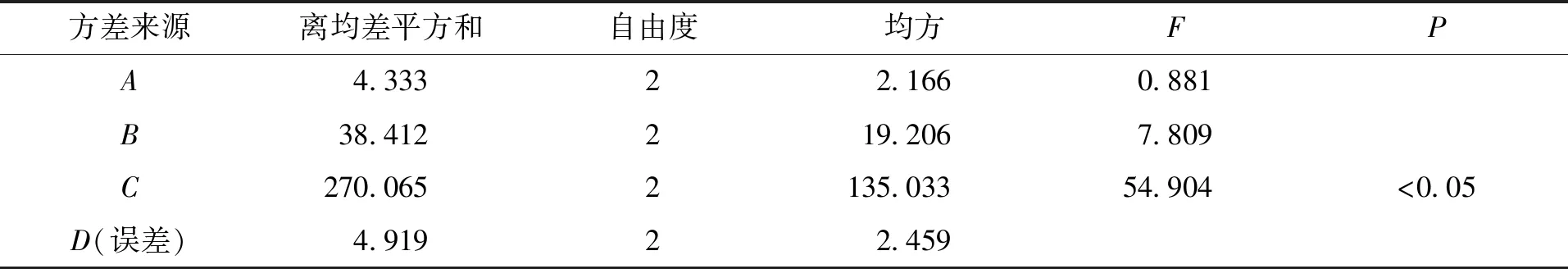
表5 方差分析结果Tab.5 Results of variance analysis
从正交试验结果可知,影响原儿茶酸和香草酸含量的因素大小顺序为:C>B>A,即提取时间>料液比>溶剂比例,由此可见提取时间对试验结果的影响最大,且具有显著性,根据试验结果综合考虑,确定最佳提取工艺为A3B2C3:取适量的扁担藤茎粉末,精密加入10倍量的甲醇∶0.5 %冰醋酸溶液(70∶30)溶液,回流提取2 h。
2.2 原儿茶酸和香草酸的含量测定
2.2.1 色谱条件
色谱柱:热电 Thermo Hypersil ODS C18(5 μm, 4.6 mm×250 mm);流动相:乙腈-0.1 %磷酸(6∶94);流速:1.0 mL/min;检测波长:370 nm;柱温:25 ℃;进样量:10.0 μL。
2.2.2 对照品溶液的制备
称取原儿茶酸对照品适量,精密称定为6.68 mg,置于10 mL容量瓶中,用甲醇定容至刻度线,摇匀即得,备用;再称取香草酸对照品适量,精密称定为1.82 mg,置于10 mL容量瓶中,用甲醇定容至刻度线,摇匀即得,备用。
2.2.3 供试品溶液的制备
按正交试验优选的提取工艺制备。取扁担藤药材茎粉末约5 g,精密称定,精密加入10倍量的甲醇∶0.5 %冰醋酸(70∶30)溶液,回流提取2 h,蒸干至无醇味后再用乙酸乙酯萃取5次,每次10 mL,将乙酸乙酯部分合并蒸干,用2 mL甲醇溶解,即制成供试品溶液。
2.2.4 系统适应性试验
分别精密吸取原儿茶酸对照品溶液、香草酸对照品溶液及供试品溶液各10 μL,注入液相色谱仪,测定。结果表明原儿茶酸保留时间为9.54 min,香草酸保留时间为23.80 min,原儿茶酸、香草酸与供试品其他组分分离度良好(R>1.5),理论塔板数按原儿茶酸和香草酸不低于5 000,色谱图见图9、图10和图11。

图9 扁担藤茎HPLC色谱图Fig.9 HPLC Chromatogram of stem of Tetrastigma planicaule
图10 原儿茶酸对照品HPLC色谱图Fig.10 HPLC chromatogram of protocatechuic acid

图11 香草酸对照品HPLC色谱图Fig.11 HPLC chromatogram of vanillic acid
2.2.5 线性关系考察
精密吸取2.2.2节制备的原儿茶酸和香草酸对照品溶液各0.1、0.4、0.8、1.0、1.2、1.6 mL,分别置于5 mL的容量瓶中,加入甲醇定容至刻度,摇匀,再取6个不同浓度的对照品溶液各10 μL进样,按照2.2.1节的色谱条件测定峰面积。以对照品溶液进样量为横坐标,峰面积为纵坐标,绘制标准工作曲线,分别得出原儿茶酸回归方程为:Y=37.398 8X-11.896 0,r=0.999 7;原儿茶酸在进样量为13.76×10-2~213.76×10-2μg,呈良好的线性关系。香草酸回归方程为:Y=35.929 6X-18.611 9,r=0.999 3;表明香草酸在进样量为3.64×10-2~58.24×10-2μg,呈良好的线性关系。具体见图12和图13。

图12 原儿茶酸的标准曲线Fig.12 Standard curve of protocatechuic acid

图13 香草酸的标准曲线Fig.13 Standard curve of vanillic acid
2.2.6 精密度试验
取1号扁担藤茎药材粗粉约5 g,精密称定,按照2.2.3节方法制备供试品溶液,精密吸取供试品溶液10 μL,按2.2.1节的色谱条件连续进样6次,测定样品中原儿茶酸和香草酸的峰面积。结果原儿茶酸和香草酸的峰面积RSD分别为1.58 %和2.70 %(n=6),表明精密度较好,结果见表6。

表6 扁担藤茎精密度试验结果Tab.6 Result of precision tests in Tetrastigma planicaule (n=6)
2.2.7 稳定性试验
取1号扁担藤茎药材粗粉约5 g,精密称定,按2.2.3节制备供试品溶液,分别在0、2、4、6、8、16、24 h时精密吸取供试品溶液10 μL,注入高效液相色谱仪中,按2.2.1节的色谱条件下进行测定,考察其稳定性。结果原儿茶酸和香草酸的峰面积RSD值分别为0.41 %和1.95 %,表明供试品溶液在24 h内能保持稳定,结果见表7。
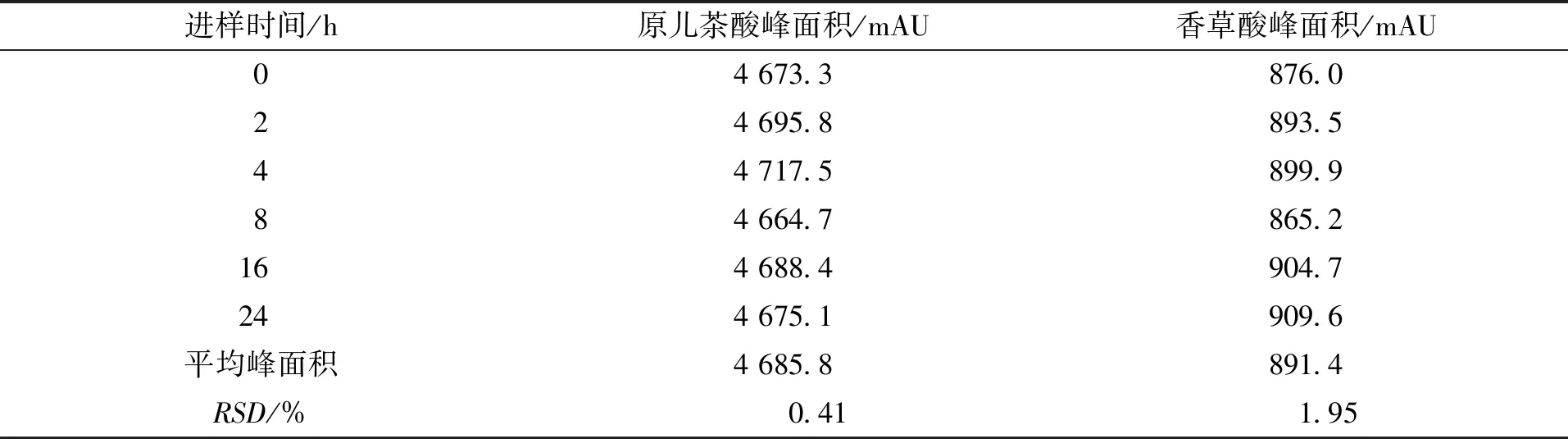
表7 扁担藤茎稳定性试验结果Tab.7 Stability test of Tetrastigma planicaule (n=6)
2.2.8 重复性试验
取1号扁担藤茎粗粉约5 g,精密称定,共称取6份,按照2.2.3节制备供试品溶液,精密吸取供试品溶液10 μL,按2.2.1节的色谱条件进样测定,得到原儿茶酸和香草酸的峰面积,并分别计算含量,结果原儿茶酸和香草酸的峰面积RSD分别为0.52 %和1.96 % (n=6)。表明重复性良好,结果见表8。

表8 扁担藤药材重复性试验结果Tab.8 Repeatability results of Tetrastigma planicaule (n=6)
2.2.9 加样回收试验
取已知含量的1号扁担藤茎药材粗粉约2.5 g,精密称定,共6份,分别精密加入原儿茶酸20 μg、香草酸4 μg(加入量为样品含量的80 %),原儿茶酸25 μg、香草酸5 μg(加入量为样品含量的100 %)、原儿茶酸30 μg、香草酸6 μg(加入量为样品含量的120 %),各平行3份,并按2.2.3节供试品溶液的制备方法进行制备,按照2.2.1节色谱条件进样测定,进样量为10 μL,分别测定原儿茶酸和香草酸的含量,计算加样回收率。原儿茶酸和香草酸的平均加样回收率为100.34 %和98.08 %,其相应的RSD值分别为1.48 %和2.28 %,结果见表9。

表9 加样回收试验结果Tab.9 Results of recovery test (n=9)
2.2.10 样品测定
分别取10个不同产地扁担藤茎粉末各约5 g,精密称定,按照2.2.3节方法进行提取和制备,13 000 r/min离心10 min,取上清液,分别吸取10 μL注入高效液相色谱仪,按照2.2.1节色谱条件下测定,计算样品中原儿茶酸和香草酸的含量。结果见表10。
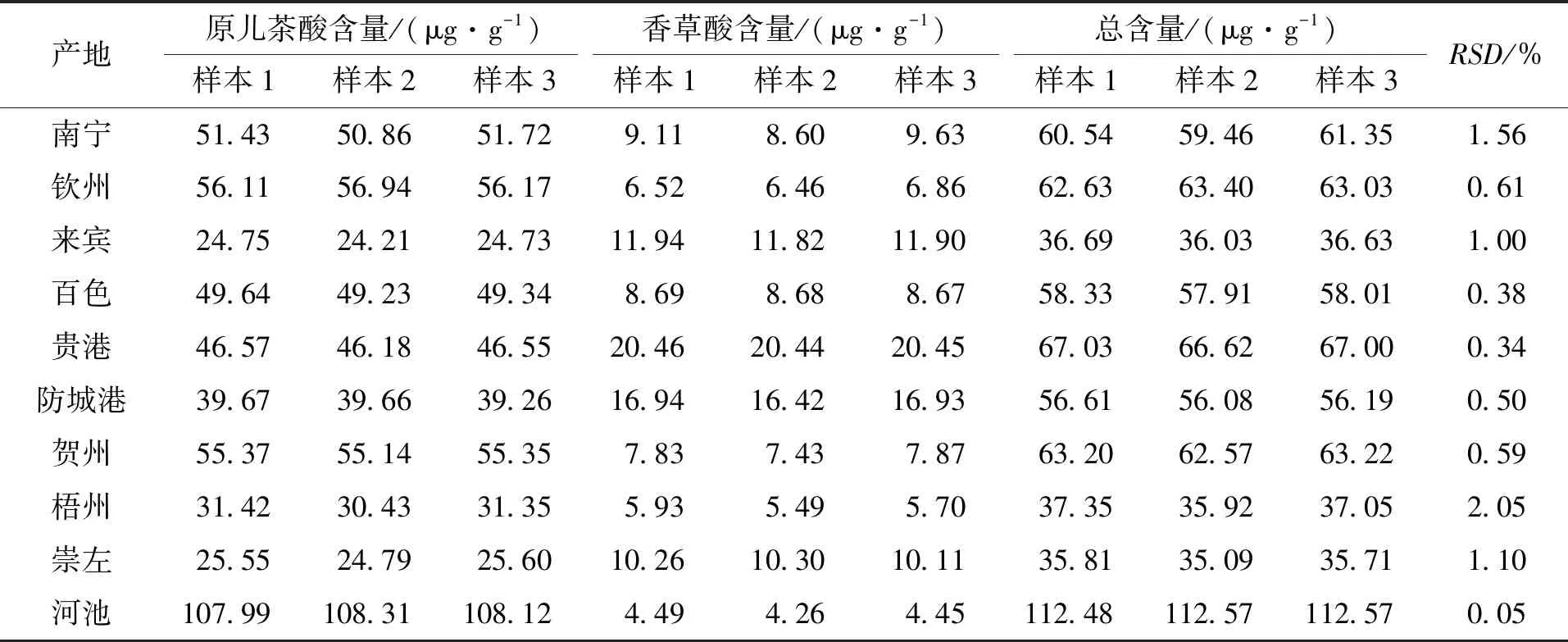
表10 不同产地扁担藤茎含量测定结果Tab.10 Content of stem of Tetrastigma planicaule from different producing areas (n=3)
3 讨论与小结
在对扁担藤中原儿茶酸和香草酸提取工艺的考察过程中,首先对提取方法、提取溶剂和提取次数进行了单因素考察,在此基础上,再选择提取时间、料液比、溶剂比例为考察因素,以原儿茶酸和香草酸的含量为评价指标进行正交试验。试验结果表明,三个因素对原儿茶酸和香草酸含量的影响大小为:提取时间>料液比>溶剂比例,确定了原儿茶酸和香草酸较优的提取工艺。
酚酸类成分是扁担藤药材的主要成分之一[8-10],现代药理研究表明,原儿茶酸和香草酸具有较好的药理活性[11-15],因此,在未明确扁担藤的药效物质基础前,原儿茶酸和香草酸可作为扁担藤质量控制的指标成分。本实验采用了高效液相色谱法同时测定扁担藤茎的原儿茶酸和香草酸的含量,进行了方法学考察,符合《中华人民共和国药典(2015年版)》要求,方法简单、准确、快速,通过对10个不同产地的扁担藤进行含量测定,研究结果表明:不同产地的扁担藤茎的含量差异较大,可能是不同产地环境中阳光、温度、湿度和采收的时间不同,影响了扁担藤茎中原儿茶酸和香草酸的含量。本实验结果可为建立扁担藤的质量控制方法和进一步开发利用扁担藤提供实验基础和科学依据。

