基于智能手机同时检测4种兽药残留的免疫芯片技术
吴 颖,范丛丛,苏晓娜,沈玉栋,谭 庶,钟翠丽,许小炫,曾道平,杨金易,*
(1.华南农业大学食品学院,广东 广州 510642;2.温氏食品集团股份有限公司,广东 云浮 527499)
兽药在防治动物疾病、提高生产效率、改善畜产品质量等方面起着十分重要的作用,但部分养殖人员在养殖过程滥用兽药,甚至使用违禁药物、假劣药物,造成了严重的兽药残留问题[1-5]。动物性食物兽药残留在人体内不断的蓄积会引起人体的多种急慢性反应,如莱克多巴胺(ractopamine,RAC)和氯霉素(chloramphenicol,CAP)对人体有毒副作用,盐酸克仑特罗(clenbuterol,CL)有致癌风险,氟苯尼考(florfenicol,FF)具有一定的免疫毒性和胚胎毒性[6-10]。动物源性食品中兽药的残留不仅直接危害着人类生命健康,同时也极大危害着畜牧业的发展和生态环境,已引起国际有关组织及许多国家、地区的高度重视。
现阶段,根据我国第176号农业部公告,RAC禁止在饲料和动物饮用水中使用;根据我国第235号农业部公告,CL及CAP在动物性食品中不得检出,FF在猪肉组织中残留量不得超过300 μg/kg。研究表明,RAC、CL、CAP和FF在猪、牛等动物体内易残留、消除缓慢,主要经尿液排出体外[11-14]。通过检测尿液中排出的药物浓度,可对屠宰前动物体内药物的残留情况进行监测,对有效监控食品安全有重要意义。
目前,国内外报道的关于RAC、CL、CAP、FF及其代谢物氟苯尼考胺(florfenicol amine,FFA)的传统检测方法主要包括气相色谱法、高效液相色谱(high performance liquid chromatography,HPLC)法、超高效液相色谱法、液相色谱-串联质谱法、液相色谱-四极杆-飞行时间串联质谱法等。这些方法准确度高、稳定性好,被广泛应用于兽药残留检测[15-22]。但上述方法多数需要配合大仪器,且操作繁琐、检测耗时较长、前处理复杂,不适用于快速检测分析。常用快速检测方法主要有酶联免疫分析(enzyme-linked immunosorbent assay,ELISA)法、化学发光免疫分析法、胶体金免疫层析(colloidal gold immunochromatography assay,GICA)法等[23-27],这些方法或需专业人员操作、或只能检测单一指标,无法实现兽药多残留的简便快速检测[28-29]。免疫蛋白芯片测定方法相对于以上各种方法具有低成本、高通量、灵敏度高等优点[30-33]。本实验利用免疫蛋白芯片技术建立了同时检测猪尿中RAC、CL、CAP、FF及其代谢物FFA的方法,同时基于智能手机开发了与免疫芯片匹配的检测应用程序(application,APP),适用于现场大量筛选分析。
1 材料与方法
1.1 材料与试剂
驴抗山羊血清、HRP标记羊抗鼠血清、HRP羊抗兔血清 广州优抗多生物技术有限公司;RAC单克隆抗体、RAC抗原、CL单克隆抗体、CL抗原、CAP单克隆抗体、CAP抗原、FF单克隆抗体、FF抗原 广东省食品质量安全重点实验室;RAC(GR,100 mg/瓶)、CL(GR,100 mg/瓶)、CAP(GR,250 mg/瓶)、FF(GR,250 mg/瓶)、FFA(GR,100 mg) 德国Dr. Ehrenstorfer公司;紫色沉淀型单组分3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液湖州英创生物科技有限公司;P液:含10%蔗糖、0.4%鱼明胶、0.5%酪蛋白的磷酸盐缓冲液;T液:含8%蔗糖、0.4%鱼明胶、0.5%酪蛋白的三羟甲基氨基甲烷盐酸缓冲液;PBST:含0.1% Tween-20的磷酸缓冲液。
1.2 仪器与设备
免疫芯片反应盒 广东省食品质量安全重点实验室;硝酸纤维素膜(NC膜) 美国Millipore公司;M227fdw多功能一体机 中国惠普有限公司。
1.3 方法
1.3.1 免疫芯片分析方法基本步骤
本免疫芯片测定兽药残留的基础是目标检测物与抗原竞争抗体的反应。免疫芯片上固定有药物抗原,检测时在反应格加入药物的单克隆抗体和药物标准溶液或待测样品,待抗原抗体反应后洗涤,再加入HRP标记二抗,反应后洗涤并加入显色液,最后通过显色强度进行药物定量分析。基本步骤如下:
点样包被:用碳酸盐缓冲液(carbonate buffer solution,CBS)稀释驴抗山羊血清作为质控点样液备用,稀释RAC抗原、CL抗原、CAP抗原、FF抗原作为检测点样液备用。将孔径为0.22 μm的NC膜裁剪成合适大小,粘贴于PVC板上后置于反应盒中,吸取点样液按照0.5 cm×0.5 cm的间距点样,每个样品点样量为1 μL。将点样芯片置于37 ℃恒温水浴锅中孵育1 h使蛋白质固定在芯片上。
封闭:包被抗原或抗体后的NC膜上尚有未被抗原或抗体填充的空隙,需对NC膜进行封闭处理,防止非特异性吸附。将上述芯片用PBST洗涤2 次,双蒸水洗涤1 次,反应格中加入500 μL含1%牛血清蛋白的封闭液,于37 ℃封闭30 min。
一抗孵育:将上述芯片用PBST洗涤2 次,双蒸水洗涤1 次。反应格中加入T液稀释的单克隆抗体及标准品溶液或待测样品液,置于摇床上反应15 min。
二抗孵育:将上述芯片用PBST、双蒸水各洗涤2 次。反应格中加入200 μL用T液稀释的HRP标记羊抗鼠、HRP标记羊抗兔混合液,置于摇床上反应15 min。
显色反应:将上述芯片用PBST、双蒸水各洗涤2 次。反应格中加入200 μL TMB显色液,反应3 min,随后将芯片取出置于洁净滤纸,风干后用扫描仪扫描,运用Photoshop软件获取显色斑点灰度值进行数据处理分析。
1.3.2 标准曲线与智能手机检测系统的建立
以确定的最佳工作质量浓度、最佳反应条件制备免疫芯片,以6 个不同质量浓度的药物标准溶液进行检测,每个质量浓度重复3 次,使用广东省食品质量安全重点实验室开发的智能手机APP“天眼测”获取芯片显色斑点灰度值与空白值(CBS点样)的差值ΔI,以药物质量浓度(ng/mL)为横坐标,灰度值差值ΔI作为纵坐标绘制标准曲线。在检测软件中添加兽药残留检测项目,导入RAC、CL、CAP、FF兽药残留检测标准曲线。检测时配合实验室开发的图片采集暗箱装置,运行检测APP识别芯片显色斑点,软件即可显示兽药残留浓度并做出阴阳性判断。
1.3.3 基于智能手机检测兽药多残留免疫芯片分析方法的验证评价
选取经HPLC确证未被RAC、CL、CAP及FF污染的20 份猪尿样品,离心取上清液后向其中分别添加3 种质量浓度的RAC、CL、CAP、FF/FFA药物标准品,采用基于智能手机免疫芯片的分析方法进行检测,计算检测限(limit of detection,LOD),分析其添加回收率与批内、批间变异系数(coefficient of variation,CV)。
1.3.4 与其他快速检测方法比较实验
采集30 份猪尿样品,经前处理后向猪尿中添加不同质量浓度的RAC、CL、CAP、FF/FFA标准品,采用基于智能手机的免疫芯片的分析方法进行检测,同时与市售胶体金免疫层析检测卡、ELISA试剂盒检测进行比较。
2 结果与分析
2.1 NC膜孔径、点样液、抗体稀释液的选择及反应时间的优化
NC膜固定蛋白质的能力与其孔径大小相关,对于低分子质量的蛋白,NC膜孔径越小,膜结合越牢固;点样稀释液、抗体稀释液的选择影响抗体、抗原在液体中的分散均匀性、显色效果,从而影响芯片检测灵敏度;抗原包被时间影响蛋白质固定效果及有效性;显色反应时间影响显色效果,反应时间太短则显色不明显,反应时间太长易产生背景干扰。
选用孔径大小分别为0.22、0.45 μm的NC膜作为固定蛋白质的载体制备检测单种兽药残留的免疫蛋白芯片,选用CBS和PBS作为点样稀释液稀释驴抗羊血清与抗原,选用P液、T液、PBS作为抗体稀释液稀释单克隆抗体,选择0.5、1、2、8 h作为包被时间固定蛋白质,选择1、3、5、10、20 min作为显色时间进行显色反应,观察芯片显色效果与检测灵敏度。结果显示,当使用0.22 μm的NC膜作为蛋白固定载体、CBS作为点样稀释液、T液作为抗体稀释液时,显色反应后芯片背景干扰较少、点样斑点形状较规则、显色较均匀、灵敏度较高;当包被时间为1 h(37 ℃)时芯片对蛋白固定量最大,斑点显色最深;显色反应时间3 min时斑点显色明显,背景干扰较少。
2.2 抗原、抗体最佳工作质量浓度的优化
抗原、抗体的工作质量浓度影响芯片显色效果与检测灵敏度,随着点样抗原与抗体质量浓度的增高,芯片斑点显色越深,灰度值越高,药物与抗原竞争抗体的反应越不明显,灵敏度越低。使用棋盘法优化本实验中抗原、抗体的最佳工作质量浓度,各抗原、抗体稀释倍数如表1所示。

表1 各抗原、抗体稀释倍数的确定Table 1 Determination of optimal dilution factors of coating antigens and monoclonal antibodies
在综合检测斑点显色强度、竞争反应灵敏度、原料用量的基础上,根据实验结果最终确定RAC抗原、CL抗原、CAP抗原、FF抗原最佳稀释倍数为1∶1 000、1∶500、1∶2 500、1∶100,RAC抗体、CL抗体、CAP抗体、FF抗体最佳稀释倍数分别为1∶30 000、1∶400 000、1∶300 000、1∶200 000。在最优反应条件下,免疫芯片对RAC、CL、CAP、FF的检测灵敏度分别为2、2、0.5、50 ng/mL。免疫芯片检测不同质量浓度RAC的结果如图1所示(CL、CAP、FF检测结果图类似不再列出)。

图1 免疫芯片分析RAC残留的检测灵敏度Fig. 1 Sensitivity of immunochip assay for RAC
2.3 抗体特异性与交叉反应评价
当4 种检测项目集成于同一免疫芯片时,4 种检测对象的抗原-抗体-药物之间特异性影响检测结果的准确性。根据间接竞争的原理,对抗原-抗体-药物之间的特异性进行评价。以确定的最优条件进行实验,将免疫芯片裁剪成2.5 cm×0.5 cm,吸取质控、检测点样液按照5×1(驴抗山羊血清、RAC抗原、CL抗原、CAP抗原、FF抗原)阵式点样,其余步骤如1.3.1节,其中一抗孵育时1~4号点样芯片所在反应格中分别加入RAC单克隆抗体、CL单克隆抗体、CAP单克隆抗体、FF单克隆抗体和缓冲溶液,5~8号点样芯片所在反应格中加入4 种药物单克隆抗体的混合液及RAC、CL、CAP、FF单种药物标准溶液。
从图2a可知,使用包被了驴抗羊血清及多种药物抗原的免疫芯片进行实验,当一抗孵育只加入一种单克隆抗体及缓冲液时,只有质控区及该单克隆抗体对应的抗原包被区显现斑点,其余抗原包被区不显现斑点,说明该实验中一种单克隆抗体只与驴抗羊血清及其所对应的抗原产生特异性结合,不与其余3 种药物抗原发生明显特异性结合。从图2b可看出,当一抗孵育只加入混合抗体及单种药物标准品时,只有该药物对应检测区不显现斑点,说明一种药物只特异性抑制对应药物抗原与其单克隆抗体的结合,对其余3 种药物抗原与其对应抗体的结合无明显抑制。由此可知,各抗体对其抗原的特异性较好,同时检测4 种兽药残留时各对象的检测无明显干扰。

图2 抗体特异性分析(a)和各分析物交叉反应(b)结果Fig. 2 Evaluation of antibody specificity (a) and cross-reactivities between analytes (b)
2.4 标准曲线的建立
以药物质量浓度(ng/mL)为横坐标、灰度值差值ΔI作为纵坐标绘制标准曲线,曲线方程及免疫芯片检测4 种兽药残留的分析参数如表2所示,该方法对RAC、CL、CAP、FF的检出限(20 份空白样品平均值与3 倍标准差的和)分别为0.146、0.137、0.035、3.7 3 n g/m L,线性范围(I C20~I C80)分别为0.35 3 ~1.0 17、0.309~0.897、0.082~0.249、9.424~35.594 ng/mL,相关系数大于0.99。
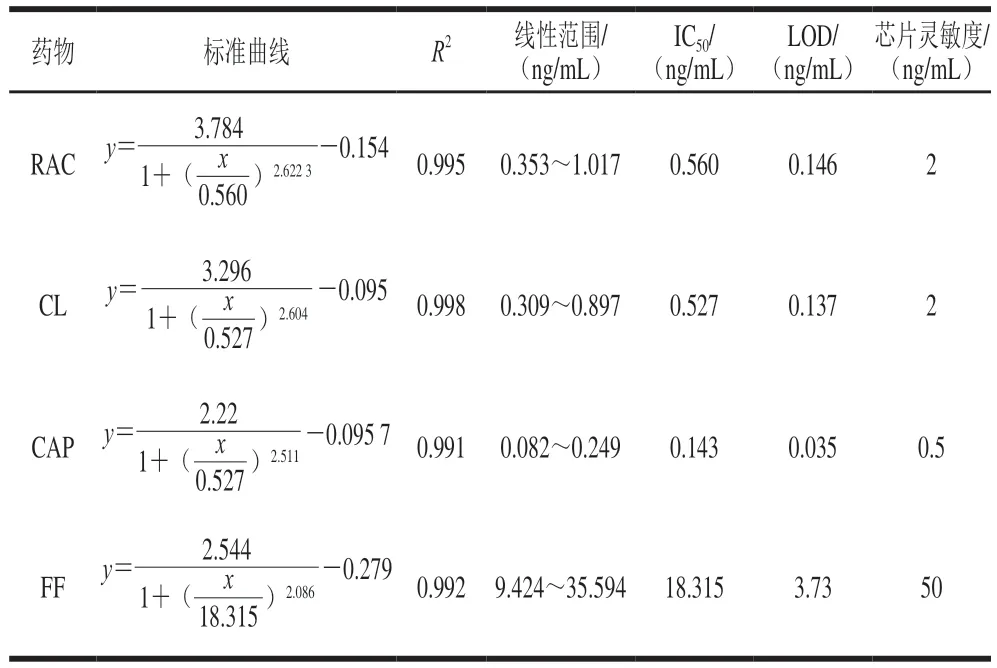
表2 免疫芯片检测4 种兽药残留的分析参数Table 2 Figures of merit of the immunochip assays for the detection of four veterinary drugs
使用本方法测出FFA的IC50,计算交叉反应率(交叉反应率/%=IC50(FF)/IC50(FFA)×100)。结果显示IC50(FFA)为22.465 ng/mL,交叉反应率为81.5%。说明该方法可同时检测FF与FFA。
2.5 基于智能手机检测兽药多残留免疫芯片分析方法的准确度、精密度
使用20 份猪尿样品进行药物添加检测,回收率与CV如表3所示,添加回收率在85.69%~110.66%之间,批内CV不高于12.53%,批间CV小于15%。由此可见,本方法具有良好的回收率,可同时检测猪尿样品中RAC、CL、CAP、FF/FFA的残留量。
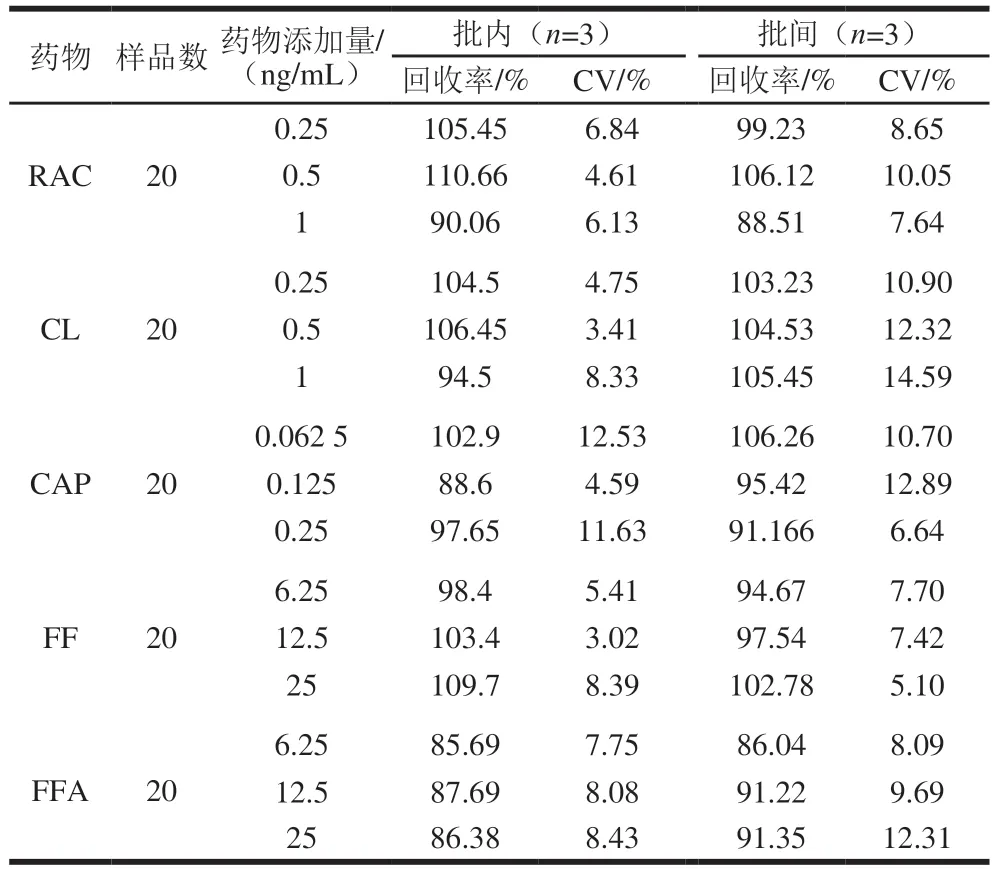
表3 猪尿中各药物回收率和CV值Table 3Recoveries and inter-batch and intra-batch coefficients of variation of four veterinary drugs spiked into pig urine samples
2.6 与其他快速检测方法比较结果
使用基于智能手机的免疫芯片法、GICA、ELISA法检测猪尿中RAC、CL、CAP、FF/FFA残留量,检测结果如表4所示,免疫芯片法与市售胶体金免疫层析法检测结果的符合率为99.2%、与ELISA法检测结果的符合率为98.3%,说明本方法与常用快速检测方法相比有较高的符合性,可用于现场快速检测猪尿中RAC、CL、CAP、FF/FFA的残留量。
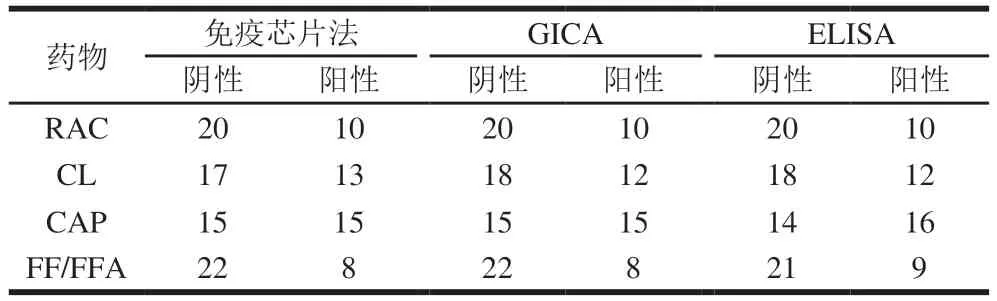
表4 免疫芯片法与GICA法、ELISA试剂盒法检测结果对比Table 4 Comparison of results of detection using immunochip assay,GICA and ELISA
3 结 论
本实验研制了基于智能手机检测多种兽药的免疫芯片,能同时检测猪尿中RAC、CL、CAP、FF及其代谢物FFA。该方法对RAC、CL、CAP、FF的检出限分别为0.146、0.137、0.035、3.73 ng/mL,线性范围分别为0.353~1.017、0.309~0.897、0.082~0.249、9.424~35.594 ng/mL。猪尿中药物添加回收率为85.69%~110.66%,批内CV不高于12.53%,批间CV小于15%,与GICA和ELISA两种传统快速检测方法相比检测符合率大于98%,是一种方便快速、高通量、低成本检测多种兽药残留的方法,适用于现场大量筛选分析。

