元宝枫籽蛋白的营养性及理化性质
刘昱迪,李佳美,王坤华,王小晶,徐怀德
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
元宝枫(Acer truncatumBunge.)属于槭树科槭树属落叶乔木,又名平基槭、色树、元宝树、枫香树,因其翅果形状像“金元宝”而得名。元宝枫是我国特有的树种,在我国主要分布在黄河流域中下游的各省份以及东南部等地区。目前,随着元宝枫人工栽培技术的提高,人工种植元宝枫的面积也越来越大,其中,在我国西部、华北等地的元宝枫人工林面积突破了3.13万 hm2[1]。
元宝枫作为一种食用木本油料树种,具有优良的营养功能和药用价值,其种仁含脂肪约46%~48%,其中不饱和脂肪酸含量达92%以上,神经酸含量为5.52%,且富含多种维生素与微量元素等,元宝枫油在增强免疫力、促进大脑发育、抗肿瘤、抗菌[2]等方面具有重要作用。此外,元宝枫种仁蛋白含量约27%,高于花生(约23%)、葵花籽(约20%)等坚果种子的蛋白含量[3]。王性炎等[3]研究表明,元宝枫蛋白富含18 种氨基酸,必需氨基酸中的亮氨酸、色氨酸与甲硫氨酸含量高于花生蛋白和棉籽蛋白,与大豆蛋白接近;在非必需氨基酸中,谷氨酸和甘氨酸远高于其他植物蛋白。因此元宝枫蛋白是一种营养价值很高的优质蛋白。近年来,国内外对元宝枫油的研究较多,主要表现在油的提取纯化、结构表征及生物活性等方面,而关于元宝枫蛋白的理化性质及功能特性的研究,国内外鲜有报道。
本研究以元宝枫籽粕为原料,对元宝枫分离蛋白(Acer truncatumBunge. protein isolate,ABPI)与元宝枫盐提蛋白(A. truncatumBunge. salt extractable protein,ABSPI)的理化性质、营养特性进行研究,旨在为元宝枫的综合利用以及相关蛋白产品的进一步开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
元宝枫籽粕 山东大宗集团; 三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris)、甘氨酸、十二烷基硫酸钠(sodiumdodecyl sulfate,SDS)、丙烯酰胺、过硫酸氨(ammonium persulphate,AP)、N,N,N’,N’-四甲基乙二氨(N,N,N’,N’-tetramethylethylenediamine,TEMED)北京索莱宝生物科技有限公司;考马斯亮蓝G-250、8-苯胺基-1-萘磺酸钠(8-aniline-1-naphthalenesulfonate sodium,ANS)、5,5’-二硫代-2-硝基苯甲酸(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
GL-10MD大容量高速冷冻离心机 湖南湘仪离心机仪器有限公司;ALC-210.3型电子分析天平 赛多利斯艾科勒公司;K9840型自动凯氏定氮仪 济南海能仪器有限公司;UV-1780型紫外-可见分光光度计 岛津仪器(苏州)有限公司;FD5-2.5E型冻干机 金西盟(北京)仪器有限公司;S-4800场发射扫描电镜、L8900氨基酸分析仪 日本日立公司;Vetex70傅里叶变换红外光谱仪 德国布鲁克公司;Q2000差示扫描量热仪(differential scanning calorimeter,DSC) 美国Waters公司;LS55荧光分光光度计 美国PE公司。
1.3 方法
1.3.1 材料处理
原料预处理:元宝枫籽粕用高速粉碎机粉碎过60 目筛,于4 ℃冰箱中贮藏备用。
元宝枫脱脂粉的制备:将元宝枫粉以1∶4(g/mL)的料液比加入正己烷,室温下磁力搅拌20 h,抽滤分离油脂,重复3 次脱脂后于通风橱中挥干正己烷,即得元宝枫脱脂粉,于4 ℃冰箱中贮藏备用。
1.3.2 元宝枫基本成分测定
蛋白质测定:GB/T 5009.5—2016《食品中蛋白质的测定》;水分测定:GB/T 5009.3—2010《食品中水分的测定》;灰分测定:GB/T 6438—2007《食品中灰分的测定》;粗脂肪测定:GB/T 5009.6—2016《食品种脂肪的测定》;粗纤维测定:GB/T 5009.10—2003《植物类食品中粗纤维的测定》;总糖测定:SN/T 4206—2015《植物源食品种粗多糖含量的测定》。
1.3.3 ABPI与ABSPI的制备
1.3.3.1 ABPI的制备
参照王性炎等[3]的碱溶酸沉法制备ABPI。将脱脂粉与去离子水以料液比1∶15(g/mL)混合,用1% NaOH溶液调pH值至10.0,40 ℃浸提1 h后,4 000 r/min离心20 min。收集上清液,用1% HCl溶液调至ABPI等电点3.5,静置30 min后4 000 r/min离心20 min,收集沉淀,水洗至中性后透析48 h,真空冷冻干燥得到ABPI,4 ℃保存备用。
1.3.3.2 ABSPI的制备
将元宝枫脱脂粉与0.1 mol/L NaCl溶液以1∶20(g/mL)的料液比混合,40 ℃搅拌2 h,室温下4 000 r/min离心20 min后收集上清液,并用1 mol/L HCl溶液调pH值至3.5使蛋白沉淀,以4 000 r/min离心15 min,收集沉淀蛋白,4 ℃透析48 h,冻干后即为ABSPI。
1.3.4 元宝枫蛋白性质的测定
1.3.4.1 蛋白质纯度的测定
采用凯氏定氮法测定蛋白质含量(换算系数6.28),按式(1)计算蛋白质纯度。

1.3.4.2 溶解度测定
精确称取50 mg蛋白样品分散在25 mL蒸馏水中,磁力搅拌20 min,用0.1 mol/L HCl或0.1 mol/L NaOH溶液调节溶液pH值为2.0~10.0,室温搅拌20 min后,再于4 000 r/min离心20 min,上清液采用Bradford法测定蛋白含量,用牛血清蛋白作标准曲线,根据式(2)计算蛋白溶解性:

1.3.4.3 氨基酸分析
精确称取一定量的蛋白,再加入10 mL 6 mol/L的HCl溶液、1 g苯酚,在110 ℃真空条件下水解24 h后冷却。采用L8966自动氨基酸分析仪进行测定。
1.3.4.4 表面疏水性及巯基含量的测定
表面疏水性采用ANS作荧光探针的方法测定[4]。配制1 mg/mL的蛋白溶液,并用磷酸缓冲液稀释成质量浓度为0.1~1.0 mg/mL,取稀释后的蛋白溶液4 mL,加入20 μL的8 mmol/L ANS溶液后涡旋振荡,避光静置10 min后摇匀,使用LS55荧光光度计测定蛋白样品的荧光强度(fluorescence intensity,FI)。以蛋白质量浓度为横坐标,FI为纵坐标作图,曲线的斜率即为蛋白质的表面疏水性指数(H0),以此表征表面疏水性。
总巯基含量变化测定采用Beveridge等[5]的方法。将1.0 mL蛋白样品溶液与4.0 mL Tris-Gly-10mol/L Urea溶液混合,再加入50 μL的Ellman试剂(10 mmol/L)。25 ℃保温反应15 min后,在412 nm波长处测定吸光度A。以不加Ellman试剂的溶液作为对照,同时测定空白值。每个样品测定3 次取平均值。游离巯基含量测定只需将Tris-Gly-10 mol/L Urea溶液用Tris-Gly缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,4 mmol/L Na2EDTA,pH 8.0)代替即可。巯基含量与二硫键含量分别按照式(3)、(4)进行计算。
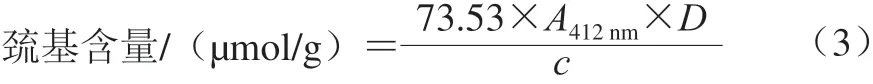
式中:A412nm为加Ellman试剂时样品溶液和不加Ellman试剂时样品溶液吸光度的差值;D为稀释系数;c为蛋白样品的质量浓度/(mg/mL)。

1.3.4.5 持水性和持油性的测定
称取0.1 g蛋白样品,置于离心管中,将5 mL蒸馏水(大豆油)加入到离心管中,使用涡旋混合器混合,静置30 min,4 000 r/min离心20 min,倾出上清液测量其体积,体积减少量即为持水量与持油量。
1.3.4.6 起泡性和起泡稳定性的测定
参照Lassissi等[6]的方法测定,将50 mg蛋白均匀分散在10 mL蒸馏水中,用0.1 mol/L HCl或NaOH溶液调节pH值为2.0~10.0,记录最初体积为V0/mL,用分散机分散均质,转速为10 000 r/min,均质2 min后记录体积为V1/mL,放置30 min后的体积记为V2/mL。分别利用式(5)、(6)计算起泡性和起泡稳定性:
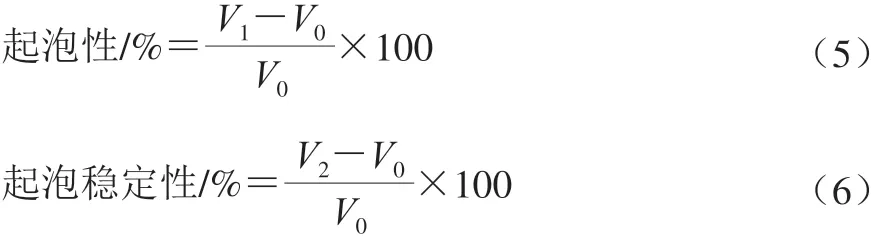
1.3.4.7 乳化性和乳化稳定性的测定
配制1 g/100 mL蛋白溶液,用0.1 mol/L HCl或NaOH溶液调节pH值为2.0~10.0,取10 mL蛋白溶液加入3.0 mL大豆油,10 000 r/min均质2 min后立即从底部取50 μL乳状液,加入5 mL 0.1% SDS溶液混匀,在500 nm波长处测定吸光度,记为A0。静置10 min后,再次用上述方法测定吸光度,记为A10。根据式(7)、(8)分别计算乳化性和乳化稳定性:
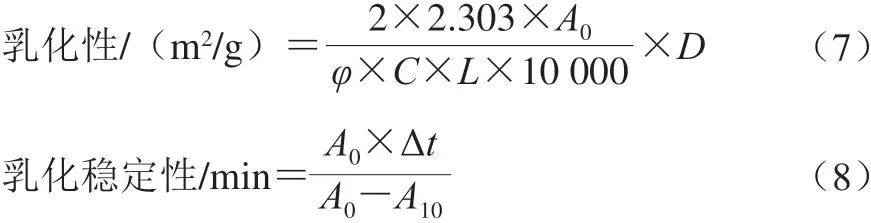
式中:D为稀释倍数;φ为油相的体积分数/%;L为光程(1 cm);C为乳浊液形成前蛋白溶液中的蛋白质量浓度/(g/mL);t为时间/min。
1.3.4.8 热稳定测定
称取一定量蛋白于坩埚中,密封,在0~200 ℃范围内测定其差示扫描量热图谱,升温速率为10 ℃/min,空坩埚作为参照。
1.3.4.9 傅里叶变换红外光谱分析
参考Tamilmozhi等[7]的方法对元宝枫蛋白进行傅里叶变换红外光谱分析。准确称取2 mg样品与200 mg KBr混合碾磨,压片后置于样品架上进行光谱扫描,扫描范围400~4 000 cm-1光谱分辨率为4 cm-1,信号扫描累加32 次。
1.3.4.10 微观结构观察
根据参考文献[8]的方法,使用扫描电子显微镜(scanning electron microscope,SEM)观察蛋白质的微观结构。将粉末均匀置于贴有导电胶的样品台上,喷金处理,观察成像时加速电压30 kV。
1.4 数据处理
实验结果使用SPSS 17.0软件对实验数据进行显著性和相关性分析,采用Origin 2017软件进行数据图像处理,Tukey法比较平均值之间的差异性(P<0.05)。
2 结果与分析
2.1 元宝枫籽粕基本组成成分
元宝枫籽粕水分、粗纤维、总糖以及灰分质量分数(以干质量计)分别为(7.59±0.21)%、(5.18±0.06)%、(22.58±0.12)%以及(7.18±0.21)%;粗脂肪质量分数为(25.79±0.32)%,其理化指标与大豆油、花生油等食用油相似,是一种优良的油脂新资源[9];蛋白质量分数为(29.79±0.52)%,仅次于大豆(35.1%)和青豆(34.6%)的蛋白质量分数[10],说明元宝枫作为一种潜在的蛋白来源,具有很大开发潜力。
经过盐提和碱溶酸沉2 种方法从元宝枫籽粕中得到ABSPI与ABPI,ABSPI的纯度(蛋白质含量)为75.52%,提取率为27.92%,ABPI的纯度为78.81%,提取率为43.61%。
2.2 ABSPI和ABPI氨基酸组成及营养评价
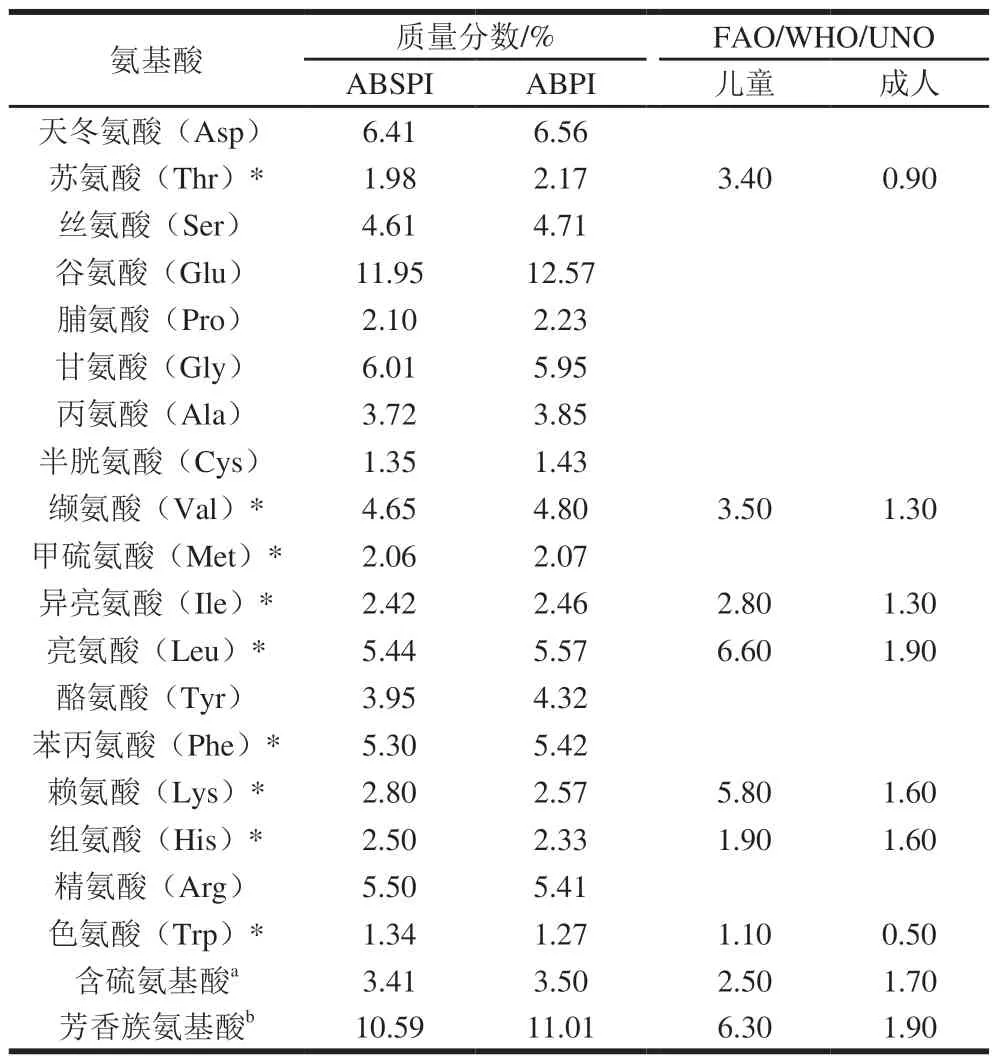
表1 两种方法提取元宝枫蛋白的氨基酸组成对比分析Table 1 Comparison of amino acid composition between ABSPI and ABPI
如表1所示,天冬氨酸与谷氨酸是ABPI与ABSPI氨基酸的主要成分,分别占8.67%、16.61%和8.65%、16.13%,这与许多植物种子的贮藏蛋白一致[11]。ABSPI和ABPI均含有人体所必需的8 种氨基酸,必需氨基酸占总氨基酸的比例分别为38.45%和37.86%,其中缬氨酸、组氨酸、色氨酸、含硫氨基酸与芳香族氨基酸含量均能达到儿童标准,苏氨酸、异亮氨酸、亮氨酸与赖氨酸含量能满足成人需求。ABSPI与ABPI必需氨基酸与非必需氨基酸的比值分别为0.624 8和0.609 3,高于大豆蛋白(0.480 4)[12],表明ABSPI与ABPI可作为一种优质的蛋白来源。从必需氨基酸评价分析,ABSPI与ABPI的第1限制性氨基酸分别为苏氨酸和赖氨酸,第2限制氨基酸分别为赖氨酸和苏氨酸;异亮氨酸是ABPI与ABSPI的第3限制氨基酸。二者的亲水性氨基酸总量均大于疏水基氨基酸总量,这将有利于在食品工业中应用。
2.3 ABSPI和ABPI的表面疏水性、巯基和二硫键含量结果
表面疏水性主要反映蛋白质分子疏水基团的暴露程度,是评价蛋白质分子构象与稳定性的重要指标。如表2所示,ABPI的表面疏水性(664.86)显著高于ABSPI(167.96)(P<0.05),与腰果蛋白、鹰嘴豆分离蛋白的结果相似[13-14]。这可能是因为ABPI经过酸碱处理后,较多的疏水基团暴露,与ANS结合后得到较高的表面疏水性[15-16],而ABSPI通过盐离子吸附,分子间彼此排斥并使其与水之间的相互作用增强,从而得到蛋白质分子,这种方法能较大程度地保持天然构象[17],因此,与ABPI相比,ABSPI表现出较低的表面疏水性。
巯基基团与二硫键是蛋白中重要的功能基团,其含量变化可反映蛋白的变性程度,对蛋白质功能性质有关键的影响[18]。由表2可知,ABPI的总巯基含量(35.79 μmol/g)高于ABSPI(21.45 μmol/g)(P<0.05),游离巯基与蛋白的抗氧化特性相关,在一定条件下可形成分子内或者分子间二硫键,ABPI的游离巯基含量(12.79 μmol/g)显著高于ABSPI(2.98 μmol/g),表明ABPI的抗氧化特性较高。ABSPI中主要以二硫键的形式存在,二硫键是天然存在于蛋白质中的唯一的共价侧链交联,有利于蛋白质空间结构的稳定,而ABPI的二硫键含量(11.50 μmol/g)高于ABSPI(9.24 μmol/g),因此,ABPI结构更稳定,热稳定也更好。
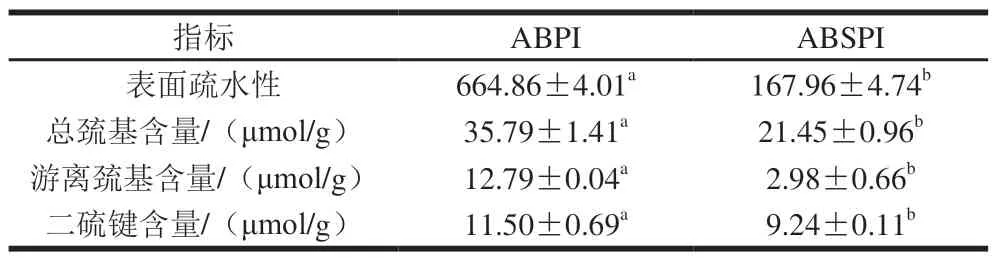
表2 ABSPI和ABPI的表面疏水性、巯基及二硫键含量Table 2 Surface hydrophobicity, and sulfydryl content and disulfide bond content of ABSPI and ABPI
2.4 ABSPI和ABPI的持水性与持油性分析
持水性用于评估蛋白质产品与水之间的相互作用,并反映产品中保留的水量[19]。ABSPI的持水性(4.64 mL/g)显著高于ABPI(2.46 mL/g)(P<0.05),这可能是由于中性条件下,ABSPI比ABPI暴露出更多的亲水基团,增强了蛋白质与水相互作用[19],蛋白质的持油性是影响食品风味保留,改善适口性并延长保质期的重要功能特性[20]。ABPI的持油性(4.82 mL/g)显著高于ABSPI(3.58 mL/g)(P<0.05),可能是因为ABPI比ABSPI具有更多的非共轭链和疏水性物质[20-21]。因此,ABSPI与ABPI作为一种潜在功能成分用于高脂产品,如烘焙产品和乳液型食品。
2.5 ABSPI和ABPI的热稳定性分析
蛋白质变性过程中都会伴随着能量的变化,当温度不断升高时,蛋白质内部氢键断裂,从而导致蛋白质分子展开,此过程中需要吸收热量。通常用变性温度T和诱导变性所需的能量变性焓ΔH表示蛋白的热稳定性。如图1所示,ABPI的变性温度(128.05 ℃)高于ABSPI(118.33 ℃),与其羟脯氨酸和脯氨酸的含量有关,据研究表明,羟脯氨酸和脯氨酸含量越高,蛋白的热稳定性越高[22],在氨基酸组成分析中也显示,ABPI的脯氨酸含量高于ABSPI,故其热变性温度高于ABSPI。此外,ABPI的热变性焓(79.28 J/g)高于ABSPI(31.21 J/g),这可能是由于ABPI内部疏水性残基含量较高,分子较为平整。
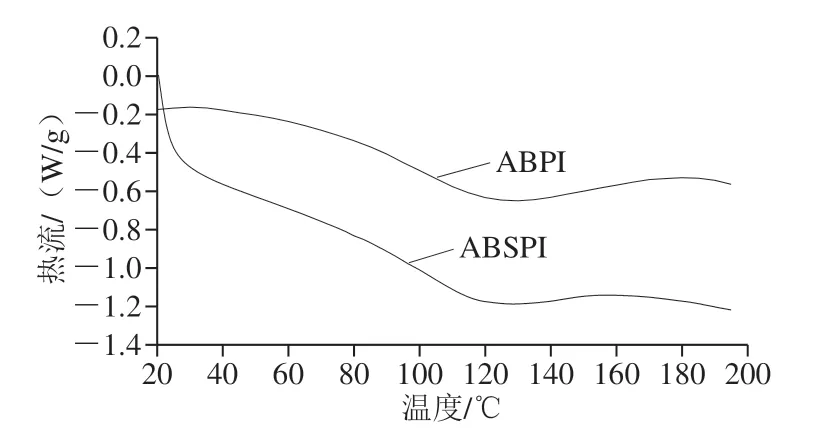
图1 ABPI和ABSPI的DSC图Fig. 1 DSC graphs of ABPI and ABSPI
2.6 ABSPI和ABPI的溶解性
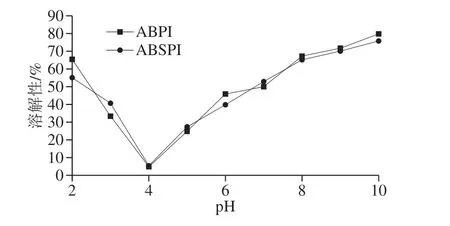
图2 ABPI和ABSPI溶解性Fig. 2 Solubilities of ABPI and ABSPI
由图2可知,在pH 2~10之间ABSPI与ABPI的溶解性图大致呈“V”型,在pH值为4时溶解性均达到最小值,分别为5.31%和4.88%,这与王性炎等[9]报道的在等电点处溶解度最低相似。随着pH值从4增加到10,ABSPI与ABPI溶解度分别达到79.76%与75.76%,这可能是因为碱性环境可能会增强蛋白质与水的相互作用,从而增加其溶解度。对于小麦胚芽蛋白[19]也观察到类似的pH值溶解度曲线。在pH值为7时,ABSPI与ABPI的溶解度(52.90%和50.00%)接近SPI(58.00%)[23]。因此,ABSPI与ABPI可作为一种新的蛋白资源被应用于是食品工业中。
2.7 ABPI和ABSPI的起泡性和起泡稳定性分析
蛋白质的起泡性和起泡稳定性在食品产品中具有重要作用[21]。如图3A所示,ABPI的起泡性优于ABSPI,当pH值为4时,ABPI和ABSPI的起泡性最低,这可能是由于在等电点附近时,蛋白溶解度低,结合空气-水界面的蛋白不足导致的。当pH值从4增加到10时,ABSPI和ABPI的起泡性分别从1.56%和3.03%增加到12.22%和19.03%,在pH 10时达到最大值。在碱性条件下的较高起泡能力表明ABPI与ABSPI有更灵活的结构,可增强蛋白质分子包封空气的能力,产生较高的起泡性。除pH 2和pH 8时,ABPI的起泡稳定性高于ABSPI,这可能是由于在此条件下,ABSPI的溶解度高,分子间作用较强导致溶液较为稳定。当pH值升高时,起泡稳定性降低可能与其高溶解有关,这将降低蛋白质-蛋白质相互作用并形成弱界面膜,导致泡沫不稳定。
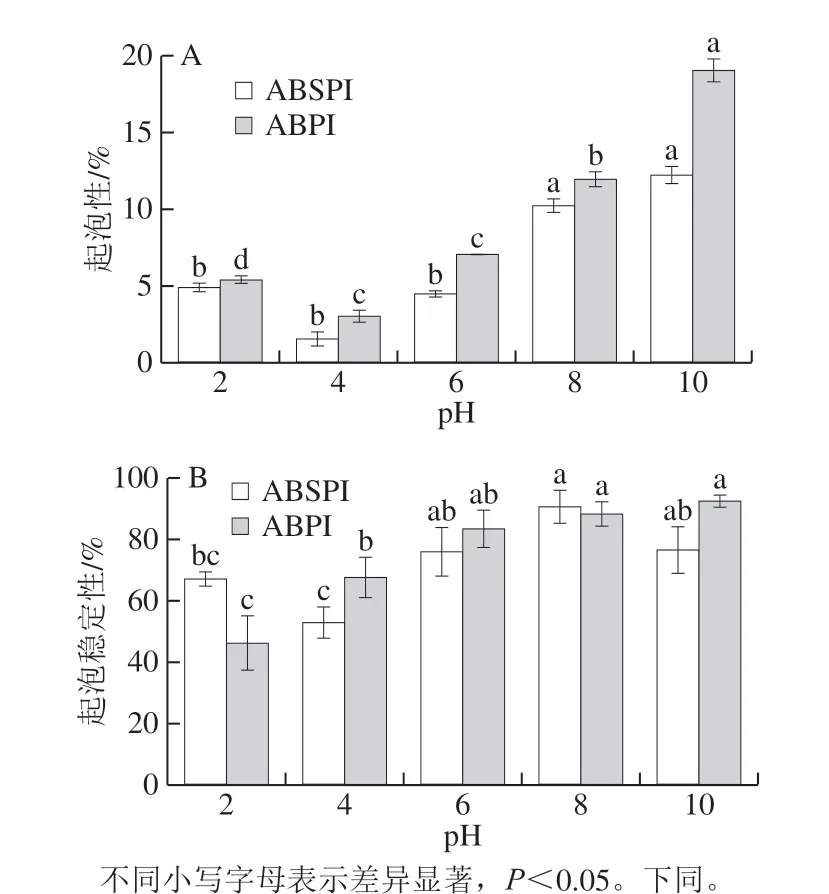
图3 不同pH值条件下ABPI和ABSPI的起泡性(A)和起泡稳定性(B)Fig. 3 Foaming capacities (A) and foam stabilities (B) of ABPI and ABSPI at different pH levels
2.8 ABPI和ABSPI的乳化性和乳化稳定性分析
乳化性是衡量蛋白质帮助形成稳定乳液的能力,与表面电荷,疏水性和溶解度等因素有关,乳化稳定性是衡量乳液在一定时间内保持其结构的能力[24]。如图4A所示,当pH 2~8时,ABSPI的乳化性均高于ABPI,这可能与蛋白的提取方法有关,盐提法提取的蛋白质溶解度较高,促进了油相与水相之间的相互作用,这一结果与盐溶法提取南非班巴拉花生蛋白一致[25]。当pH值为10时,ABPI的乳化性高于ABSPI,这是因为高碱性条件下,蛋白溶解度增大所致。图4B中ABPI的乳化稳定性显著高于ABSPI(P<0.05),在pH值为6时乳化稳定性达到最大值(50.66 min),这可能是由于在水-油界面周围形成了更多的水合层,从而降低了界面能和阻止液滴聚结[26]。当pH值进一步增加到10时,ABPI乳化稳定性下降,可能原因是碱性条件限制了蛋白质分子之间的相互作用,形成的界面膜较弱,这与研究报道的大麻籽蛋白的ESI趋势相似[27]。而ABSPI在pH值为4时,乳化稳定性最低,当pH 4~10时,乳化稳定性升高并逐渐趋于稳定,这可能是由于在接近等电点时,蛋白质的排斥力弱,有利于液滴的乳化聚合,乳化稳定性差。在pH值升高时,水-油界面周围充斥着较多电荷,静电斥力促进了液滴稳定和延缓乳液聚合[28]。
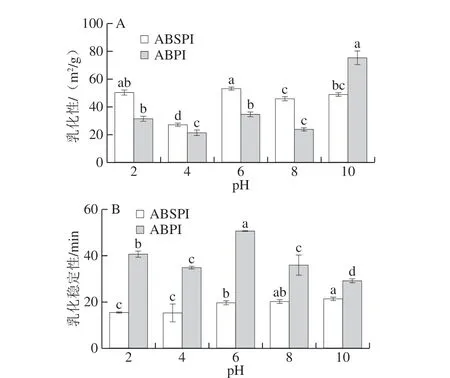
图4 不同pH值条件下ABPI和ABSPI的乳化性(A)和乳化稳定性(B)Fig. 4 Emulsifying capacities (A) and emulsion stabilities (B) of ABPI and ABSPI at different pH levels
2.9 ABSPI和ABPI的傅里叶红外光谱分析
蛋白质的红外光谱中有许多特征吸收峰,其中酰胺I带(或H—O—H弯曲振动和C=O伸缩振动)、酰胺II带(N—H弯曲)、酰胺III带(或C—O和C—O—C振动)、蛋白质环状结构中的C—C振动,以及C—O—O糖苷键振动拥有丰富的二级结构信息[29]。据文献[30]报道,酰胺A的吸收峰在3 440~3 400 cm-1处,ABSPI在3 400 cm-1左右为酰胺A带,是蛋白质的特征吸收峰,当含N—H基团的肽段参与氢键形成时,N—H基团的伸缩振动产生的吸收峰会降低100 cm-1左右,ABPI在3 300 cm-1左右有吸收峰出现,说明ABPI分子有氢键的存在。酰胺B的吸收峰在2 850~2 980 cm-1之间,是由饱和结构中的CH3和CH2基团中C—H伸缩振动产生,ABPI的酰胺B吸收峰为2 854.55 cm-1,而ABSPI中没有出现酰胺B,可能是由于分子中亚甲基被破坏。酰胺I的特征吸收峰位于1 700~1 600 cm-1,其与蛋白肽链骨架的有序程度密切相关,有序度越高,则酰胺I吸收峰波数越大[31]。从ABSPI与ABPI均具有酰胺I带的吸收峰,其中ABSPI吸收峰波数较小,因此与ABPI相比,有序度较低。酰胺II的吸收峰通常位于1 600~1 500 cm-1范围内[32]。从图5可知,ABSPI与ABPI均具有酰胺II带。酰胺III的吸收峰通常位于1 300~1 200 cm-1,ABSPI没有出现此特征峰,而酰胺III带的存在与蛋白三螺旋结构是否保持完整相关[33],由此推断ABSPI可能不具有三螺旋结构。
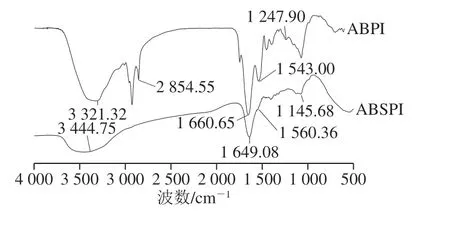
图5 ABSPI和ABPI的傅里叶变换红外光谱图Fig. 5 FTIR spectra of ABSPI and ABPI
2.1 0 ABPI和ABSPI的SEM分析
对元宝枫籽粕中提取的ABSPI与ABPI进行微观结构观察,如图6所示,2 种蛋白的微观形态存在显著差异,ABSPI呈明显的有序簇状球形蛋白,ABPI表面呈不规则山脊状,且结构较为紧密,无球状结构。此外,ABSPI结构分布相对均匀,表明在提取过程中基本没有破坏它本身的纤维结构,而ABPI的山脊状形状不一,说明碱溶酸沉提取法对元宝枫蛋白的结构有部分改变,但仍较好地保持了其网状结构。对比这2 种提取方法下蛋白的微观形貌可以看出,元宝枫蛋白的提取方式不同,其结构也不尽相同。

图6 ABSPI(A、C)和ABPI(B、D)的SEM图Fig. 6 Scanning electron micrographs of ABSPI (A and C) and ABPI (B and D)
3 结 论
本研究对比了ABSPI和ABPI在功能特性和结构方面的区别。结果表明,不同提取方法对元宝枫籽粕蛋白的结构和功能特性产生了显著性差异。ABSPI和ABPI均含有人体所必需的8 种氨基酸,其中谷氨酸是主要氨基酸,苏氨酸、异亮氨酸、亮氨酸与赖氨酸含量能满足成人需求。ABPI表面疏水性,总巯基含量、游离巯基含量与二硫键含量均高于ABSPI;与ABSPI相比,ABPI的起泡性及起泡稳定性更好。ABSPI的乳化性高于ABPI,但其乳化稳定性差。ABPI与ABSPI的热变性温度分别为128.05 ℃与118.33 ℃,红外光谱显示ABPI与ABSPI均有典型的蛋白吸收峰,但ABSPI可能不具有三螺旋结构。SEM结果显示提取过程中会使元宝枫籽粕蛋白的微观结构发生改变,ABSPI呈明显的有序簇状球形蛋白,ABPI表面呈不规则山脊状,结构紧密。本研究结果可为元宝枫籽粕产品的开发及加工利用中提供实验支撑,在实际加工生产过程中,选择合适的提取方法,可使元宝枫籽粕蛋白发挥其最大功效。

