不同采收期香椿茶发酵前后活性成分、降糖活性及其挥发性成分比较分析
蒋鹏飞,高海东,赵丽丽,王赵改,*,史冠莹,张 乐,王晓敏,王旭增
(1.河南省农业科学院农副产品加工研究中心,河南 郑州 450000;2.河南省商业科学研究所有限责任公司,河南 郑州 450002)
香椿(Toona sinensis(A. Juss.) Roem)为楝科香椿属落叶乔木,已有2 300多年的栽培历史,是我国特有的集材、菜、药于一体的珍贵木本植物[1]。香椿嫩芽香气浓郁,口味独特,富含人体所必需的氨基酸、蛋白质、维生素和微量元素等多种营养成分,具有较高的食用价值[2]。此外,香椿的根、树皮、种子等均可入药,富含黄酮、多酚、萜类、生物碱等多种生物活性成分,具有显著的抗氧化、抗癌、降血糖、降血压、减肥等功效,且在生长过程中自身能够分泌驱虫物质,无需喷施农药,是名副其实的绿色蔬菜[3-4]。随着人们生活水平的提高和保健意识的增强,茶饮作为一种保健饮品,在调整机体代谢平衡、保持身心健康方面具有较好的预防甚至治疗作用,因此倍受消费者关注。红茶因茶性温和、兼容性强,具有红汤红叶、香甜味醇、保健功效等特征[5],成为全球消费量最大的茶类,约占消费总量的80%。
近年来,在市场经济的驱使下,香椿种植在全国范围内出现规模化猛增,而研究者对香椿的研究主要集中在品种选育[6]、栽培管理[7]、贮藏保鲜[8]、品质分析[9-12]等方面,但对香椿加工制品的研究较少。目前香椿加工制品多以腌制为主,存在营养损失大、产品单一且附加值低、产业链短等诸多问题,严重阻碍了香椿产业的健康发展[13]。基于此,项目组以香椿嫩芽为原料,利用红茶发酵工艺制备香椿发酵茶[14],不仅保留了香椿的淡香味道,消除了香椿中较为刺激的含硫类物质的味道,而且通过适度的萎凋与发酵,激发鲜叶中酶活,促使鲜叶中大分子营养物质被降解为可吸收的小分子,茶水中营养物丰富,口感醇厚甜爽。为了较全面系统地研究不同采收期香椿茶发酵前后品质的变化情况,选取4、5、6月香椿嫩芽为材料制备香椿发酵茶,对不同采收期香椿茶发酵前后6 个样品中主要活性成分、抗氧化活性、降糖活性及挥发性成分的变化规律进行分析研究,以期为香椿发酵茶的开发、质量控制及采收时期提供理论依据,同时为香椿的开发应用及产业化发展提供参考依据。
1 材料与方法
1.1 材料与试剂
香椿嫩芽系2018年4~6月份采自河南省登封市三一香椿示范基地,采收日期分别为4月10日、5月10日、6月10日。将样品分为2 组,并在采收当天进行处理。一组用于制备发酵样品,将采摘的新鲜香椿嫩芽按照本实验室现有的香椿红茶发酵技术制备香椿发酵茶。制作工艺:原料选择→清洗→萎凋→揉捻→发酵→毛火初烘→足火烘干→摊凉→包装。另一组用于制备未发酵样品,将采摘的新鲜香椿嫩芽40 ℃烘箱烘干,水分质量分数控制在8%以下。将2 组样品粉碎后置于干燥器中备用,使用前测定粉末的含水量。
标准品α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG) 美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 东京化成工业株式会社;芦丁、人参皂苷、咖啡碱、L-茶氨酸(均为优级纯) 北京索莱宝生物科技有限公司;葡萄糖(分析纯) 天津市化学试剂六厂三分厂;没食子酸标准品 天津市光复精细化工研究所;其他试剂均为国产分析纯;水为去离子水。
1.2 仪器与设备
BL-250 A型高速多功能粉碎机 浙江省永康市青松五金厂;DGG-9140型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;SB-5200 DTD超声波清洗机 宁波新芝生物科技股份有限公司;ME204E型电子天平 梅特勒-托利多仪器(上海)有限公司;GENESYS 10S型UVVIS紫外分光光度计 美国Thermo公司;H1850R型高速冷冻离心机 湖南湘仪实验仪器开发有限公司;MA150赛多利斯红外水分测定仪 上海全扶实业有限公司;7890A-5975C气相色谱-质谱联用仪、HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm)、顶空固相微萃取装置(包括手持式手柄,50/30 μm DVB/CAR/PDMS,15 mL顶空瓶) 美国安捷伦公司。
1.3 方法
1.3.1 活性成分提取
准确称取3.0 g样品粉末置于250 mL锥形瓶中,加入100 mL沸水混合均匀,于100 ℃恒温水浴锅中浸泡提取30 min,收集上清液,残渣再在相同条件下提取2 次。最后合并所有上清液,减压浓缩后用蒸馏水定容至50 mL,4 ℃贮藏备用。使用时以相应溶剂稀释至合适质量浓度。
1.3.2 活性物质指标测定
总黄酮含量测定:参照Al(NO3)3-NaNO2-NaOH分光光度法[15];多糖含量测定:参考硫酸-苯酚显色法[16];总皂苷含量测定:参照香草醛-冰醋酸比色法[16];茶多酚含量测定:参照GB/T 8313—2008《茶叶中茶多酚和儿茶素类含量的检测方法》[17]中福林-酚比色法;游离氨基酸含量测定:参照GB/T 8314—2013《茶 游离氨基酸总量的测定》[18]中水合茚三酮比色法;咖啡碱含量测定:参照GB/T 8312—2013《茶 咖啡碱测定》[19]中紫外分光光度法;茶色素含量测定:参考紫外分光光度法[20]。
1.3.3 DPPH自由基清除率的测定
称取7.896 mg DPPH,用无水乙醇定容到100 mL,即配成0.20 mmol/L的DPPH醇溶液,4 ℃冰箱避光保存。样品提取液配制成1 250.00 μg/mL的母液,再梯度稀释成1 250.00、625.00、312.50、156.25、78.13、39.06、19.53、9.77、4.88 μg/mL。分别取2 mL稀释适当浓度的样品提取液,再加入2 mL 0.20 mmol/L的DPPH醇溶液,将其充分混匀后避光放置30 min,波长517 nm处测试不同浓度样品的吸光度,平行测定3 次[21]。DPPH自由基清除率按式(1)计算。
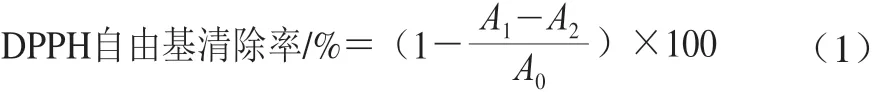
式中:A1为样品提取液吸光度;A2为无水乙醇代替DPPH醇溶液的对照实验吸光度;A0为蒸馏水代替样品提取液或VC的空白实验吸光度。
1.3.4α-葡萄糖苷酶活性抑制能力
以pNPG为反应底物,经α-葡萄糖苷酶水解α-1,4-葡萄糖苷键后释放出对硝基苯酚,在波长410 nm处检测黄色对硝基苯酚的生成量作为酶活力大小的判定标准[22]。样品提取液配制成5.00 mg/mL的母液,再稀释成5.00、4.00 、3.00、2.00、1.00、0.20、0.10、0.05 mg/mL。
向5 mL试管中依次加入0.10 mol/L的磷酸钾缓冲液(pH 6.8)、不同质量浓度的样品提取液和α-葡萄糖苷酶(1 U/mL)后,37 ℃水浴加热20 min。然后加入pNPG溶液(2.50 mmol/L)作为反应底物以启动反应,于37 ℃水浴条件下反应30 min。最后加入610 μL 1 mol/L Na2CO3溶液终止反应,于波长410 nm处测定各组OD值,每组实验平行测定3 次。实验各组物质加入量如表1所示。
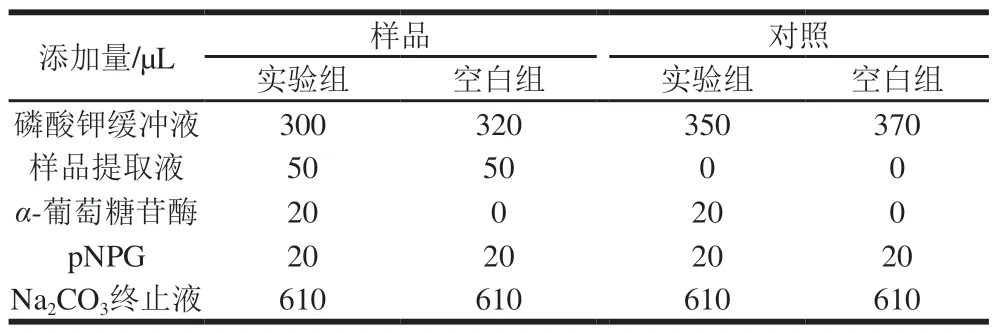
表1 pNPG法测定α-葡萄糖苷酶活力方法Table 1 Preparation of reaction systems used for measurement of α-glucosidase activity by pNPG method
不同浓度样品提取液对α-葡萄糖苷酶活性抑制能力按式(2)计算:
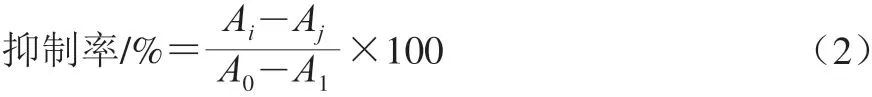
式中:Ai为样品实验组的吸光度;Aj为样品空白组的吸光度;A0为对照实验组的吸光度;A1为对照空白组的吸光度。
1.3.5 挥发性成分分析
顶空固相微萃取:准确称取0.50 g样品于15 mL顶空瓶中,密封后于40 ℃水浴中平衡15 min,插入50/30 μm DVB/CAR/PDMS萃取头,萃取30 min后取出萃取头,插入GC-MS进样口解吸5 min。
G C 条件: H P - 5 M S 弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:初温40 ℃,保持3 min,以5 ℃/min的速率升温至150 ℃,保持2 min,以8 ℃/min的速率升温至230 ℃,保持5 min结束;进样口温度250 ℃;载气高纯氦气;无分流比,流速1.0 mL/min。
MS条件:电子电离源;四极杆温度150 ℃;离子源温度230 ℃;传输线温度250 ℃;电子能力70 eV;质量扫描范围40~800 u;检索图库为NIST08.LIB。
定性和定量:采用顶空固相微萃取GC-MS联用技术进行检索分析,检索图谱与随机Xcalibur工作站NIST08.LIB标准质谱库相匹配,并与参考文献中相关化合物的保留指数进行比对分析;只记录相似度大于80%的挥发性物质,采用峰面积归一法计算各组分的相对含量[23-24]。
1.4 数据处理
2 结果与分析
2.1 不同采收期香椿茶发酵前后活性成分分析
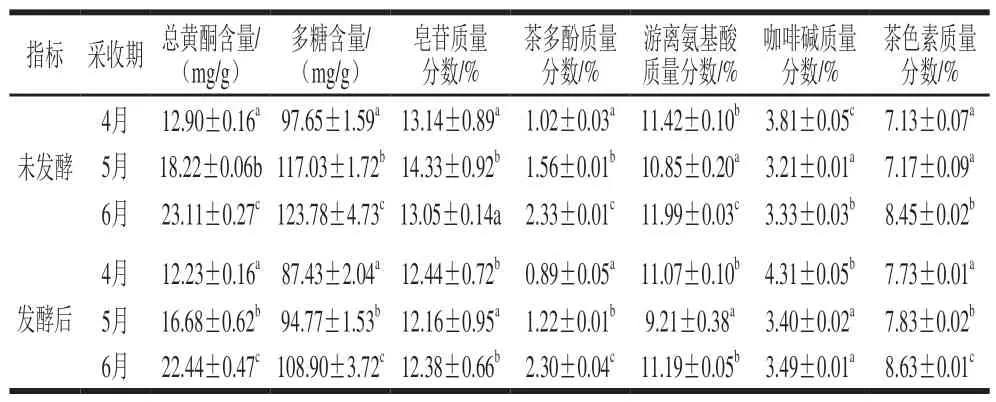
表2 不同采收期香椿茶发酵前后活性成分比较Table 2 Bioactive components of fermented and unfermented T. sinensis tea at different harvest periods
多糖和游离氨基酸是茶汤滋味的重要化学成分,分别提供甜味和鲜味;总黄酮、皂苷、茶多酚是茶叶中具有保健功能的主要成分;咖啡碱是茶叶中的重要代谢产物,有利于提高茶汤整体的鲜爽度;茶色素主要包含茶黄素、茶红素、茶褐素,是构成茶汤“亮、红、褐”的主要成分。由表1可知,6 个样品中总黄酮、多糖、皂苷、茶多酚、游离氨基酸、咖啡碱和茶色素的含量范围分别为12.23~23.11 mg/g、87.43~123.78 mg/g、12.16%~14.33%、0.89%~2.33%、9.21%~11.99%、3.21%~4.31%、7.13%~8.63%。随着采收期的延长,香椿茶发酵前后样品中总黄酮、多糖、茶多酚和茶色素的含量逐渐增加,皂苷、游离氨基酸和咖啡碱含量呈波动变化趋势。与刘常金[25]和Wang Kaijin[26]等研究结果中黄酮和皂苷的变化趋势一致,但含量具有一定的差异,这可能是因为所选的香椿嫩芽品种和生长环境不同所致。不同采收期香椿茶样品经发酵处理后,总黄酮、多糖、皂苷、茶多酚和游离氨基酸含量比发酵前逐渐减少,咖啡碱和茶色素含量逐渐增加。这可能是因为发酵过程中,代谢作用旺盛,多糖类物质被逐渐消耗,总黄酮、皂苷、茶多酚和游离氨基酸等物质在湿热作用下发生氧化、降解和转化所致,同时促进了咖啡碱的合成[27]。茶色素是茶多酚的主要水溶性氧化产物,在发酵过程中,香椿茶中茶多酚在酶的作用下,氧化成邻醌,再缩聚成茶黄素、茶红素等物质,同时茶黄素、茶红素又进一步氧化聚合成茶褐素,最终使茶色素含量不断积累[28]。
2.2 不同采收期香椿茶发酵前后DPPH自由基清除能力分析
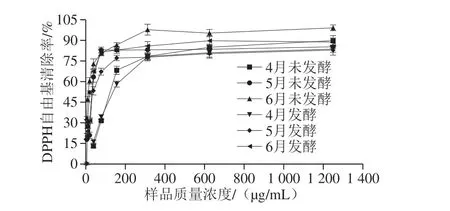
图1 不同采收期香椿茶发酵前后样品提取液的DPPH自由基清除能力Fig. 1 DPPH radical scavenging activity of extracts from fermented and unfermented T. sinensis tea at different harvest periods

表3 不同采收期香椿茶发酵前后样品提取液的抗氧化能力和α-葡萄糖苷酶活性抑制能力的IC50值Table 3 IC50 values of extracts from fermented and unfermented T. sinensis tea at different harvest periods for DPPH radical scavenging and α-glucosidase inhibition
如图1、表3所示。当样品提取液质量浓度从4.88 μg/mL增加至312.50 μg/mL时,所有样品的DPPH自由基清除能力逐渐增强,当样品提取液质量浓度大于312.50 μg/mL时,清除能力趋于平缓,且当清除能力低于80%时,样品的DPPH自由基清除能力表现出明显的量效关系。不同采收期发酵后香椿茶IC50值均高于未发酵,未发酵香椿茶对DPPH自由基清除能力略大于发酵后的香椿茶。香椿茶发酵前后DPPH自由基清除能力的IC50值大小均为6月<5月<4月,DPPH自由基清除能力随采收时间的延长而逐渐增加。杨清[29]研究发现桑叶对DPPH自由基清除能力略高于桑红茶和新型桑红茶,刘佳奇等[30]研究也发现乳酸菌发酵后红茶饮料对DPPH自由基、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐阳离子自由基、羟自由基清除能力比发酵前略有降低,这可能是因为发酵过程中,起到主要抗氧化作用的多酚类物质被部分氧化为某些色素物质。
2.3 不同采收期香椿茶发酵前后的α-葡萄糖苷酶活性抑制作用分析
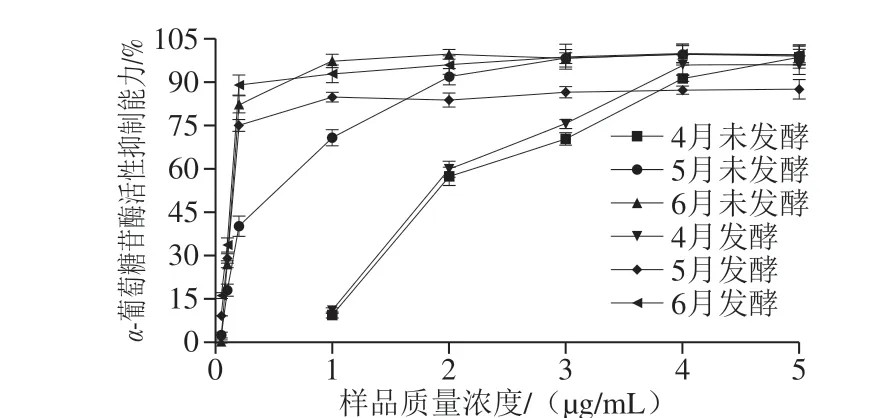
图2 不同采收期香椿茶发酵前后样品提取液的α-葡萄糖苷酶活性抑制作用Fig. 2 α-Glucosidase inhibitory activity of extracts from fermented and unfermented T. sinensis tea at different harvest periods
如图2、表3所示,随着样品提取液质量浓度的增加,4月香椿茶发酵前后对α-葡萄糖苷酶活性抑制作用先增强后趋于平稳。5月和6月香椿茶发酵前后对α-葡萄糖苷酶活性抑制作用表现为:当样品提取液质量浓度小于0.20 mg/mL时,此时酶促反应处于一级反应阶段,抑制率与抑制浓度呈明显的量效关系;当样品提取液质量浓度在0.20~3.00 mg/mL范围内,酶促反应处于混合反应阶段;当样品提取液质量浓度大于3.00 mg/mL时,酶促反应处于零级反应阶段,抑制率不再随着样品提取液质量浓度的增加而上升,趋于平稳。6 个样品提取液对α-葡萄糖苷酶活性抑制作用的IC50值由小到大为6月发酵<6月未发酵<5月发酵<5月未发酵<4月发酵<4月未发酵,可以看出香椿茶发酵前后对α-葡萄糖苷酶活性抑制能力均为6月>5月>4月,不同月份香椿发酵茶对α-葡萄糖苷酶活性抑制能力略高于未发酵。
2.4 不同采收期香椿茶发酵前后各指标相关性分析

表4 6 种样品中活性物质与其DPPH自由基清除能力和α-葡萄糖苷酶活性抑制作用的相关性分析Table 4 Correlation coefficients between bioactive substances of six tea samples and their DPPH radical-scavenging and α-glucosidase inhibitory activity
如表4所示,DPPH自由基清除能力与总黄酮含量呈极显著正相关(P<0.01),与茶多酚含量呈显著正相关(P<0.05),与咖啡碱含量呈显著负相关(P<0.05);而α-葡萄糖苷酶活性抑制能力与黄酮含量呈显著正相关(P<0.05),与咖啡碱含量呈显著负相关(P<0.05)。由此可看出,样品中总黄酮和茶多酚含量与DPPH自由基清除能力之间、总黄酮含量与α-葡萄糖苷酶活性抑制能力之间可能具备一定的量效关系,是主要的抗氧化活性物质和降糖活性物质,而其他测定物质则无显著贡献。由相关性分析结果可推测,样品中抗氧化和降糖活性物质来源较复杂,除总皂苷、总黄酮、总多酚外,有机酸、维生素等其他活性物质也可能通过直接猝灭或抑制自由基、提供质子或电子、抑制α-葡萄糖苷酶活性等方式,共同发挥抗氧化和降糖效应[31-32]。
2.5 不同采收期香椿茶发酵前后的挥发性成分比较分析
2.5.1 不同采收期香椿茶发酵前后挥发性成分种类及相对含量
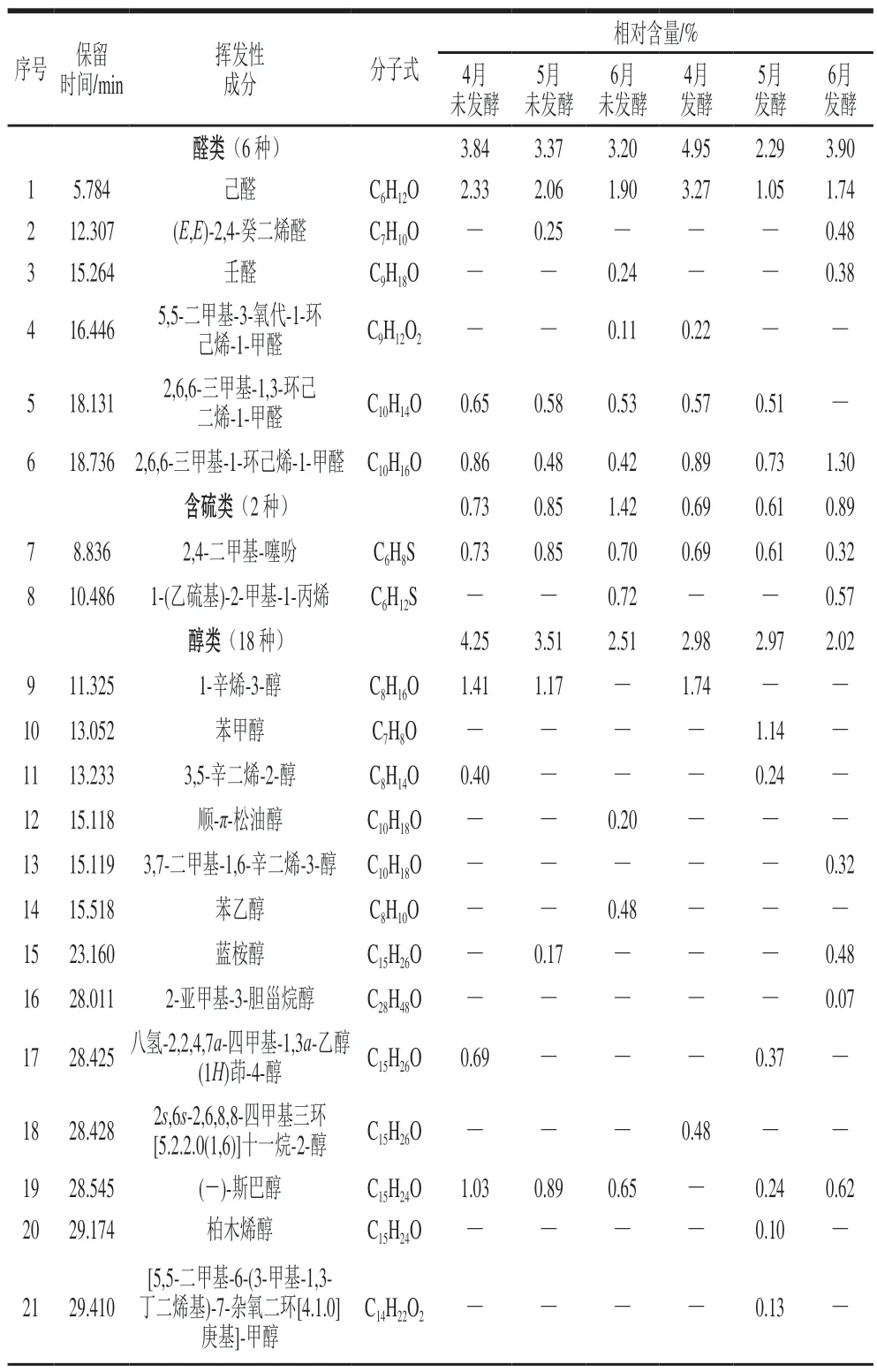
表5 不同采收期香椿茶发酵前后挥发性成分的GC-MS分析结果Table 5 GC-MS analysis results of volatile components of fermented and unfermented T. sinensis tea at different harvest periods
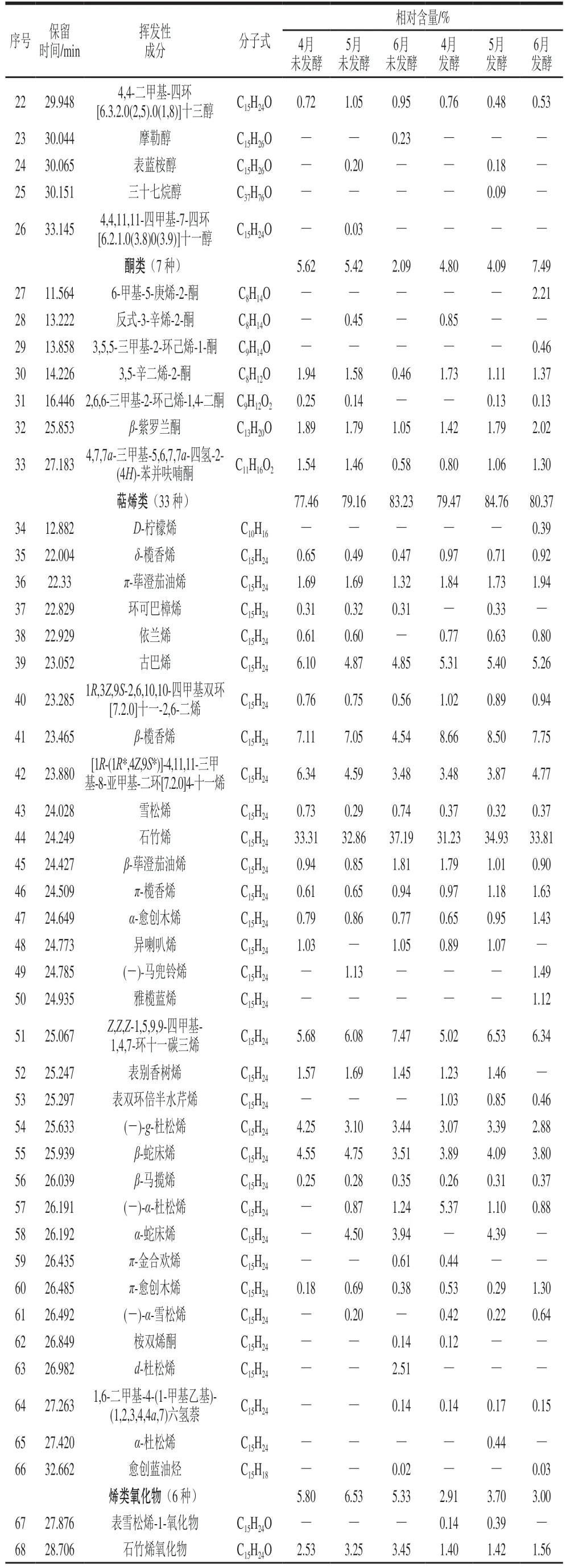
续表5
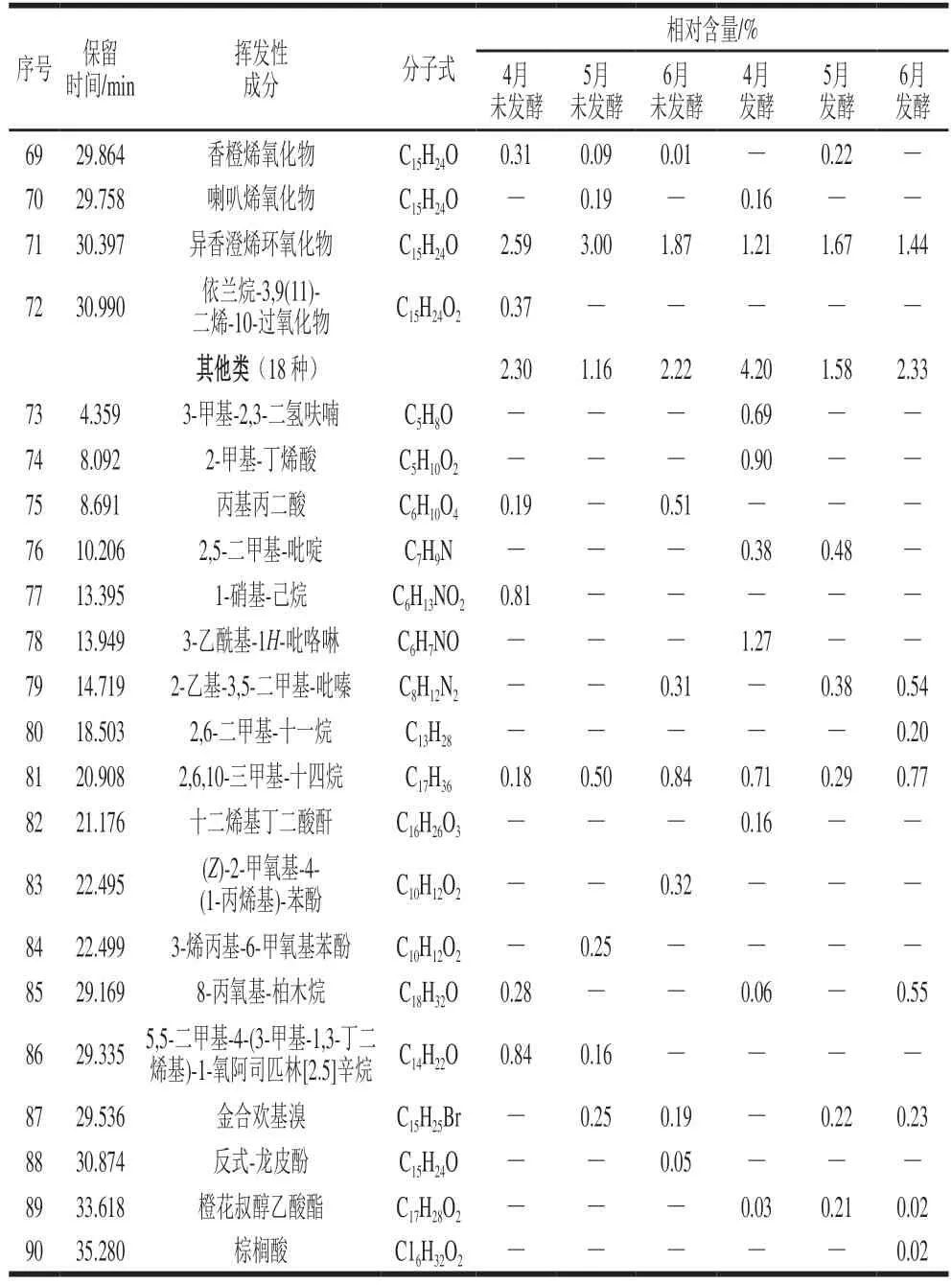
续表5
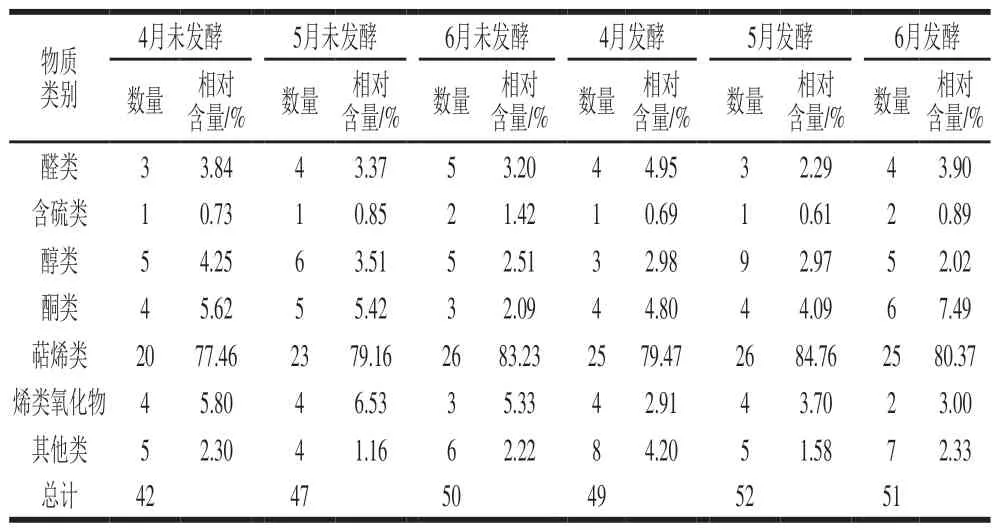
表6 不同采收期香椿茶发酵前后挥发性成分种类及相对含量Table 6 Types and relative contents of volatile components of fermented and unfermented T. sinensis tea at different harvest periods
由表5和表6可知,不同采收期香椿茶发酵前后6 个样品中共检测鉴别出醛类、含硫类、醇类、酮类、萜烯类、烯类氧化物和其他类7 类90 种挥发性成分,其中4月、5月、6月香椿茶发酵前后分别检出42 种和49 种、47 种和52 种、50 种和51 种。
萜烯类是新鲜香椿挥发性风味物质中含量最高和种类最多的一类化合物,对香椿风味起着重要作用。6 个样品中萜烯类物质的相对含量最高(77.46%~84.76%),且多为倍半萜烯(C15H24),相对含量最高的为石竹烯(31.23%~37.19%)。检测到萜烯类化和物共有16 种,分别为δ-榄香烯、π-荜澄茄油烯、古巴烯、1R,3Z,9S-2,6,10,10-四甲基双环[7.2.0]十一-2,6-二烯、β-榄香烯、[1R-(1R*,4Z,9S*)]-4,11,11-三甲基-8-亚甲基-二环[7.2.0]4-十一烯、雪松烯、石竹烯、β-荜澄茄油烯、π-榄香烯、α-愈创木烯、Z,Z,Z-1,5,9,9-四甲基-1,4,7-环十一碳三烯、(-)-g-杜松烯、β-蛇床烯、β-马揽烯、π-愈创木烯。随着采收期的延长萜烯类物质的含量呈上升趋势,有些物质仅出现在特定的采收期样品中,这说明不同采收期可能对香椿茶挥发性成分存在一定影响。研究表明萜烯类化合物大多具有花香、甜香及水果香等比较柔和的气味,可以起到中和噻吩类物质刺激性气味的作用[33]。
含硫类物质一般具有较低的感知阈值和较强的气味,呈现出类似于大蒜、韭菜、洋葱等刺激性气味,对香椿的独特风味起着至关重要的作用,也是目前新鲜香椿中公认的重要挥发性物质[34]。6 个样品检测到的含硫类物质只有2,4-二甲基噻吩和1-(乙巯基)-2-甲基-1-丙烯2 种,相对含量仅在1%左右。含硫类物质随着采收期的延长逐渐增加,但经发酵后却逐渐减少,这可能是因为干燥和发酵处理使挥发性成分发生变化,含硫类物质的减少使样品的香气更加柔和协调[35]。
醛酮类物质也是构成香椿主要香气特征的一大类物质,其含量占总挥发性成分的8%左右。6 个样品中共同检出己醛、2,6,6-三甲基-1-环己烯-1-甲醛、3,5-辛二烯-2-酮、β-紫罗兰酮、4,7,7a-三甲基-5,6,7,7a-四氢-2-(4H)-苯并呋喃酮5 种物质,其中己醛含量最高,占比1.05%~3.27%,具有青草气及苹果香味。随着采收期的延长,醛酮类物质相对含量逐渐减少。发酵后4月和6月醛酮类物质相对含量增加,5月却减少。
酯醇类化合物也是香椿挥发性成分的重要组成部分,大多具有不同的果香、花香、清香等香气味道,且阈值一般比较低,对新鲜香椿的刺激性气味起到一定的中和作用。6 个样品中醇类物质相对含量随着采收期的延长而逐渐减少,经发酵处理后也逐渐减少。仅在发酵后的3 个香椿茶样品中检测出橙花叔醇乙酸酯这一种酯类物质,相对含量为0.02%~0.21%。
烯类氧化物是萜烯类发生氧化反应得到的一类物质,具有部分萜烯类物质的性质。发酵之后烯类氧化物含量逐渐减少,这可能是因为在发酵过程中发生反应转化为萜烯类物质,使发酵后萜烯类物质增加。
2.5.2 不同采收期香椿茶发酵前后挥发性成分PCA
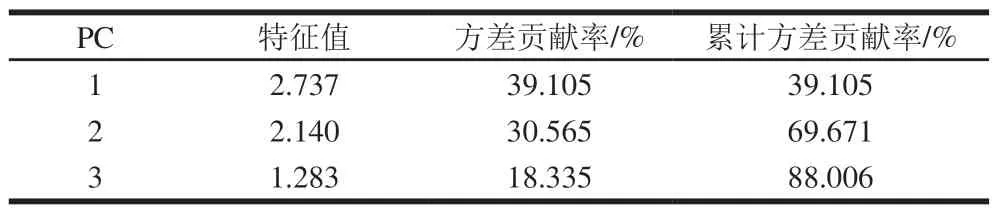
表7 PC的特征值及方差贡献率Table 7 Eigenvalues and of the first three principal components and their contribution rates tot total variance
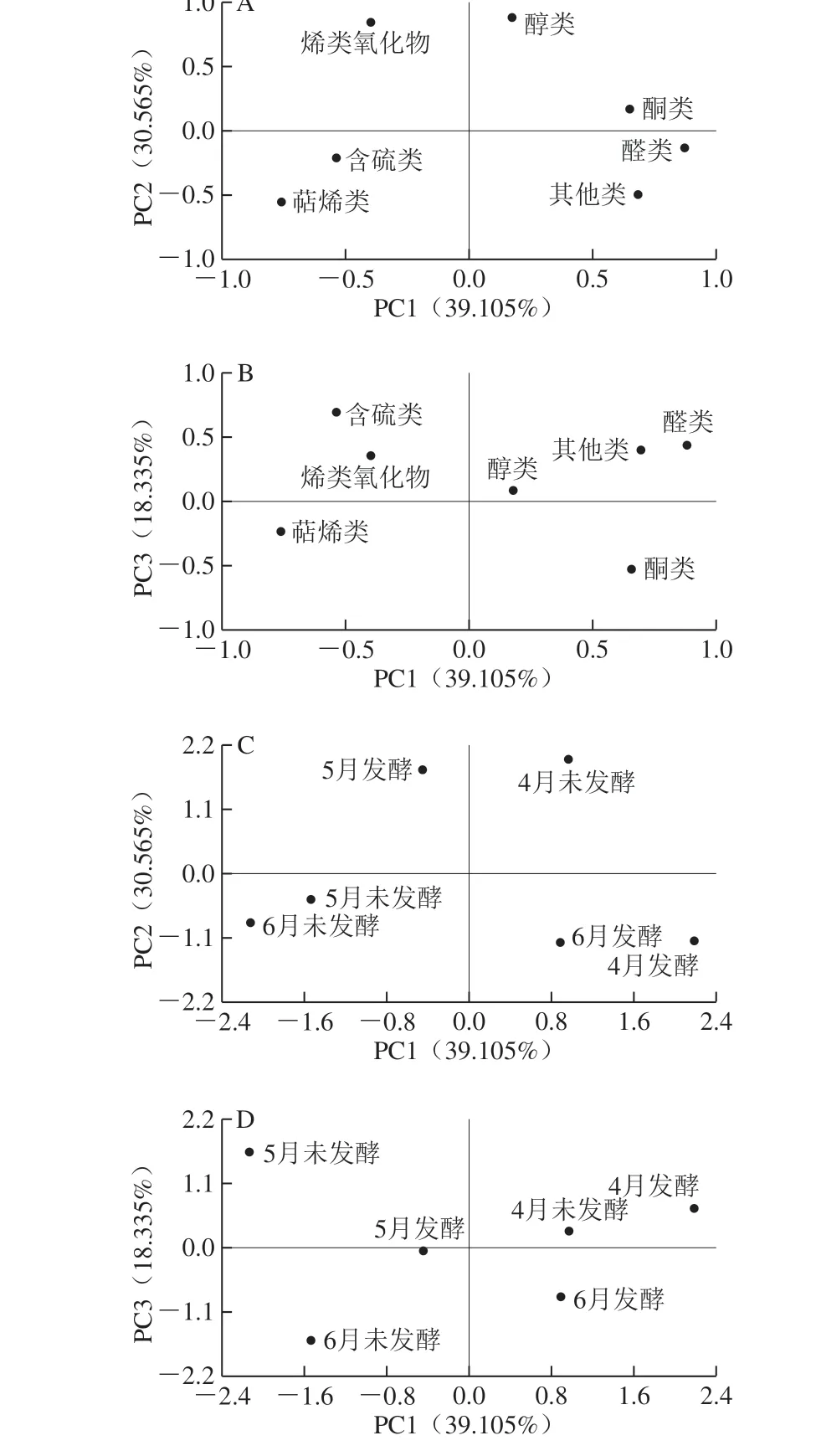
图3 不同采收期香椿茶发酵前后样品载荷图(A、B)和得分图(C、D)Fig. 3 PCA Loading plots and score plots for fermented and unfermented T. sinensis tea at different harvest periods
以不同采收期香椿茶发酵前后样品中醛类、含硫类、醇类、酮类、萜烯类、烯类氧化物和其他类7 类挥发性物质的相对含量为指标,用SPSS进行PCA,得到各PC的特征值、方差贡献率、累计方差贡献率。提取特征值大于1的PC,结果如表7所示。由表7可知,分析得到3 个PC,且这3 个PC的累计方差贡献率达到88.01%,表示能够解释不同采收期香椿茶发酵前后香气大部分的成分信息,因此,选择这3 个PC进行风味品质分析。
如图3A、B所示,醛类作为不同采收期香椿茶发酵前后样品的主要挥发性物质与PC1高度正相关(载荷系数为0.882),萜烯类与PC1呈高度负相关(载荷系数为-0.756);PC2中载荷最高的正相关挥发性物质为醇类和烯类氧化物(载荷系数>0.8);PC3中载荷最高的正相关为含硫类物质,但载荷系数仅为0.691。上述结果说明醛类、萜烯类、醇类以及烯类氧化物是不同采收期香椿茶发酵前后样品中含量发生显著变化的挥发性物质。
如图3C、D所示,PC1得分最高的为4月发酵组,影响它的主要挥发性成分为醛类,它可能决定了4月发酵样品的风味特征;PC2得分较高的为4月未发酵组和5月发酵组,PC2可以将它们与其他4 种样品完全区分开,因此醇类和烯类氧化物可能决定了两者的风味特征;PC3得分最高的为5月未发酵组。4月未发酵、6月发酵、6月未发酵样品在图3C、D中均分布于第1象限、第4象限、第3象限;4月发酵、5月未发酵、5月发酵样品在图3C、D中分布在不同的象限,表明不同采收期香椿茶发酵前后样品在2 个图中位于不同的象限,PCA可以对其进行有效区分。
3 结 论
本研究采用4月、5月、6月的香椿嫩芽制备香椿发酵茶,对比分析了不同采收期香椿茶发酵前后6 个样品的主要活性成分、抗氧化活性、降糖活性及挥发性成分的变化规律,根据此研究结果为香椿发酵茶采收期的确定和发酵前后品质的变化提供判定依据,为香椿发酵茶的开发、质量控制及后期产品加工提供参考。
6 个样品的主要活性成分、抗氧化活性和降糖活性有显著性差异。随着采收期的延长,香椿茶发酵前后样品中总黄酮、多糖、茶多酚和茶色素的含量逐渐增加,皂苷、游离氨基酸和咖啡碱含量呈波动变化趋势;DPPH自由基清除能力和α-葡萄糖苷酶活性抑制能力逐渐减弱。不同采收期香椿茶样品经发酵处理后,总黄酮、多糖、皂苷、茶多酚和游离氨基酸含量逐渐减少,咖啡碱和茶色素含量逐渐增加;DPPH自由基清除能力逐渐减弱,α-葡萄糖苷酶活性抑制能力逐渐增强。通过相关性分析,6 个样品中主要抗氧化和降糖活性物质均为总黄酮。
利用顶空固相微萃取GC-MS检测6 个样品,结果发现6 个样品中共检测鉴别出7 类90 种挥发性成分,其中4月、5月、6月香椿茶发酵前后分别检出42 种和49 种、47 种和52 种、50 种和51 种,萜烯类物质数量(20~26 种)和相对含量(77.46%~84.79%)明显高于其余种类。通过PCA,不同采收期香椿茶发酵前后6 个样品中含量发生显著变化的挥发性物质是醛类、萜烯类、醇类以及烯类氧化物,得分较高的是4月和5月香椿茶发酵前后的4 个样品,表明PCA能较好地反映不同样品的差异性。
综上所述,采用5月香椿嫩芽制作的香椿发酵茶品质较好。

