成熟度对诺丽果酵素品质的影响
赵文珂,肖春琴,张 贤,崔 春,*
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.海南赤酵生物科技有限公司,海南 海口 570100)
诺丽果是海巴戟天的果实,属呼吸跃变型水果[1]。果实呈手榴弹状,表面上有凹凸不平的麻点,成熟过程颜色从青色变成黄色直至接近白色,果肉丰富多汁,较为苦涩。成熟的诺丽果实具有一种独特的强烈腐臭味道[2],果肉呈凝胶状。诺丽果含有至少200 种植物化学物质和100 种挥发性化合物[3],具有多种生理活性,营养价值极高[4]。研究证实诺丽果具有抗氧化[5-6]、防癌抗肿瘤[7-9]、消炎抑菌[10]、降血糖和保护肝脏[11]、抗胃溃疡和食道炎[12]、调节五羟色胺和多巴胺[13]、抑制血管增生[14]、抑制脂蛋白酶[15]等多种生理功能。
目前市面上很多和诺丽果有关的产品都是沿用就地发酵这种传统处理方法,即将成熟的诺丽果置于室温下进行密闭发酵,利用诺丽果果实内原生菌进行发酵而得到酵素。诺丽果果内菌主要包含细菌、酵母菌和霉菌,其中细菌占比最高,霉菌数量最少[16]。诺丽果经过发酵后得到的诺丽果酵素含有丰富的VC、VB1、VB2、VB3和VB12等[17],而且发酵后的酵素能有效增加有益微生物体(酶、酵母和菌类等)的数量和质量,从而增强有效成份的生物活性。因此,发酵后的诺丽果酵素比不发酵的诺丽果功效更强[18]。
对诺丽果发酵的研究均是以成熟的黄色诺丽果或者乳白色诺丽果为原料,鲜见成熟度对诺丽果酵素品质影响的相关研究。诺丽果成熟过程中品质和生理活性均发生较明显变化[19],因此,本研究探究诺丽果成熟度对发酵诺丽果酵素品质的影响,以期为高品质诺丽果生产提供理论和实践指导。
1 材料与方法
1.1 材料与试剂
未成熟的诺丽鲜果(即青色诺丽果)以及成熟的诺丽鲜果(即黄色诺丽果)从海南当地现采摘寄送至实验室。
酪氨酸酶(500 IU/mg)、左旋多巴 上海麦克林生化科技有限公司;没食子酸、福林-酚、异辛烷、醋酸铜(均为分析纯)、胰脂肪酶(15~35 IU/mg)上海阿拉丁试剂公司;平板计数琼脂、马铃薯葡萄糖琼脂(均为生化试剂) 广东环凯微生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
ME204E分析天平 梅特勒-托力多仪器(上海)有限公司;SPECTRA MAX 190酶标仪 Molecular Devices公司;GL21M高速冷冻离心机 长沙湘智离心机仪器有限公司;0~80手持式折光仪 禹城市田园信科光学仪器有限公司;UV765紫外-可见分光光度计 上海佑科仪器仪表有限公司;LDZX-50KBS立式压力蒸汽灭菌器上海申安医疗器械厂;ZXJP-A1430霉菌培养箱 上海智城分析仪器制造有限公司;FJ200-SH数显高速分散均质机 上海标本模型厂。
1.3 方法
1.3.1 诺丽果酵素的制备
取新鲜的诺丽果用蒸馏水洗净表面,沥干后切成小块,置于密封发酵罐中,于室温条件下避光自然发酵,定期从发酵罐中取诺丽果浸出酵素并保存在-4 ℃冰箱,以备检测使用。
1.3.2 诺丽果发酵过程中理化指标的测定
pH值和总酸检测参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[20];可溶性固形物测定参照GB/T 12143—2008《饮料通用分析方法》[21];还原糖测定采用3,5-二硝基水杨酸法[22];总糖测定采用蒽酮-硫酸法[23];总多酚测定采用福林-酚法[24];氨基酸态氮测定采用甲醛滴定法[25]。
超氧化物歧化酶(superoxide dismutase,SOD)活力的测定改良自邻苯三酚自氧化法[26]。具体步骤如下:取4.5 mL TE缓冲液和10 μL邻苯三酚溶液混合均匀,立即在波长325 nm处测定吸光度,记为A自0,在2 min之内,每隔30 s记录一次,共记录4 个值分别为A自1、A自2、A自3、A自4,最后计算A自值。取4.5 mL TE缓冲液和10 μL诺丽果酵素,振荡均匀后加入10 μL邻苯三酚溶液,混匀后快速在325 nm波长处测定吸光度,记为A抗0,在2 min内每间隔30 s测定一次,分别记为A抗1、A抗2、A抗3、A抗4,并计算出最终的A抗值。SOD活力计算如式(1)所示:
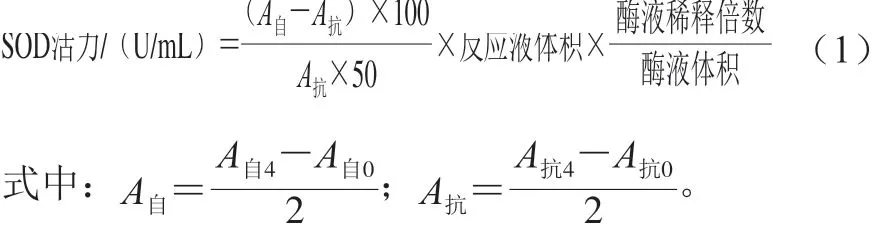
1.3.3 诺丽果发酵过程中菌落总数、霉菌和酵母菌的测定
菌落总数测定参考GB 4789.2—2016《食品微生物学检验 菌落总数测定》[27];霉菌和酵母菌测定参考GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》[28]。
1.3.4 诺丽果发酵过程中酪氨酸酶抑制率和胰脂肪酶抑制率的测定
酪氨酸酶抑制率测定采用蘑菇酪氨酸酶多巴速率氧化法[29]。反应混合物2 mL(0.01 mol/L磷酸盐缓冲液1.8 mL(pH 6.8)+诺丽果酵素0.1 mL+蘑菇酪氨酸酶0.1 mL(40 U)),37 ℃孵育10 min,加入0.15%左旋多巴反应液1 mL,2 min后立即于波长475 nm处测定吸光度。酪氨酸酶抑制率计算如式(2)所示:
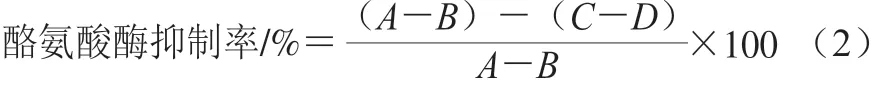
式中:A为未加诺丽果酵素的加酶混合液的吸光度;B为未加诺丽果酵素也未加酶的混合液的吸光度;C为加诺丽果酵素和酶混合液的吸光度;D为加诺丽果酵素而未加酶的混合液吸光度。
胰脂肪酶抑制率测定参考周丽丽[30]的方法。在25 mL比色管中加入2 mL乳化液以及2.5 mL 0.05 mol/L磷酸盐缓冲液(pH 7.5),40 ℃预热5 min,再加入1 mL样品以及0.5 mL 3 mg/mL的胰脂肪酶溶液,40 ℃水浴反应20 min,加入6 mL无水乙醇以及1 mL 6 mol/L HCl溶液使反应停止,再加入3 mL异辛烷在60 ℃水浴中静置分层10 min,冷却后取上层液体1 mL于离心管中,再加入4 mL异辛烷以及1 mL醋酸铜显色剂,振荡后静置,取上层清液在714 nm波长处测定吸光度。将样品替换成蒸馏水作为空白对照组,其余实验操作步骤不变。胰脂肪酶抑制率如式(3)所示:
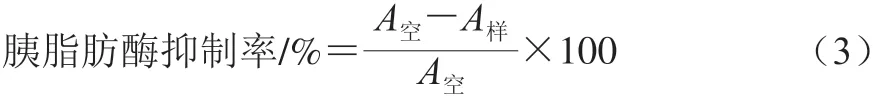
式中:A空为空白对照组的吸光度;A样为实验组的吸光度。
1.4 数据处理
所有实验均重复3 次,使用SPSS 16.0对数据进行统计学处理,所有数据以表示,并使用Origin 8.0作图。
2 结果与分析
2.1 诺丽果发酵过程中酪氨酸酶抑制率、胰脂肪酶抑制率的变化

表1 成熟度对诺丽果发酵过程中酪氨酸抑制率的影响Table 1 Effect of maturity on tyrosinase inhibition rate during fermentation of noni fruit%
酪氨酸酶是人体内存在的一种具有双重催化功能的重要生物酶,对人体的黑色素形成具有关键作用[31],因此,酪氨酸酶抑制活性可表征诺丽果酵素的美白活力。由表1可得,随着发酵时间的延长,青果和黄果酵素的酪氨酸酶抑制率均呈上升趋势。青果酵素经过8 周发酵后,酪氨酸酶抑制率可达到89.62%,远高于黄果酵素的58.65%。这表明诺丽果青果酵素具有更好的美白效果。
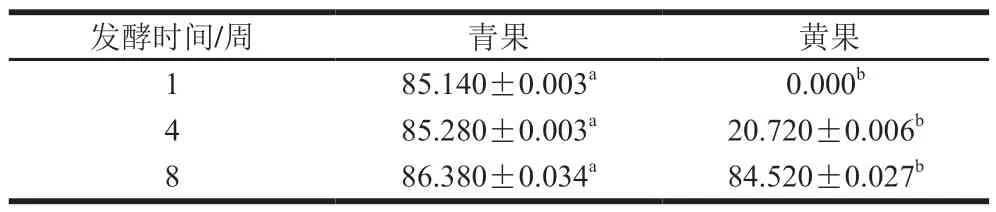
表2 成熟度对诺丽果发酵过程中胰脂肪酶抑制率的影响Table 2 Effect of maturity on the inhibition rate of pancreatic lipase during fermentation of noni fruit%
食物中的脂肪被胰脂肪酶水解为单酰甘油和游离脂肪酸后在肠道被吸收,然后在体内重新合成脂肪,是导致肥胖等诸多疾病的重要原因之一[32]。脂肪酶抑制活性可有效抑制脂肪的水解和吸收,有控制体重的作用。由表2可知,由未成熟青色诺丽果发酵得到的酵素在整个发酵过程中均具有较高的胰脂肪酶抑制作用,发酵第1、4、8周的胰脂肪酶抑制率均在85%以上;而黄果在发酵第1周没有胰脂肪酶抑制效果,但是随着发酵时间的延长,其胰脂肪酶抑制率不断提高,发酵至第8周其胰脂肪酶抑制率高达84.5%,与青果酵素相当。这表明青果酵素在整个发酵过程中均具有潜在的预防肥胖的功效,而黄果酵素在发酵后期具有良好的防止肥胖的效果。
2.2 诺丽果发酵过程中总多酚、SOD活力、还原糖和总糖的变化规律
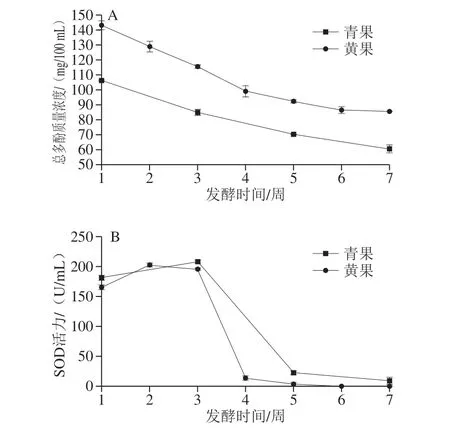
图1 成熟度对诺丽果发酵过程中总多酚(A)和SOD活力(B)的影响规律Fig. 1 Effect of maturity on total polyphenol content (A) and SOD activity (B) during fermentation of noni fruit
如图1A所示,青果和黄果发酵过程中总多酚含量随着发酵时间的延长呈现下降趋势(P<0.05),黄果发酵过程中的总多酚含量高于青果酵素(P<0.05)。由图1B可知,SOD活力随着发酵时间的延长也呈现下降趋势,在发酵后期酵素基本上检测不到SOD活力。青果和黄果SOD活力的下降无明显差异。通过总多酚以及SOD活力的变化趋势推测,长时间的发酵使得诺丽果酵素抗氧化能力下降。
如图2所示,黄果酵素的总糖与还原糖含量在发酵过程中呈现浮动趋势。总糖质量浓度在26~40 mg/mL范围内,随着发酵时间的延长有显著差异。郝玉洁等[33]在诺丽果控温37 ℃发酵过程中测得100 d内总糖质量浓度在45~50 mg/mL范围波动,本研究结果与其相符。而青果酵素的总糖和还原糖含量随着发酵时间的延长而逐渐减少(P<0.05),与下述可溶性固形物的变化趋势对应。总糖和还原糖含量的变化趋势与发酵过程中纤维素、果胶等大分子碳水化合物被酶和微生物等分解产生低分子糖类,以及微生物生长消耗糖类物质的动态变化有关,青果酵素的糖量变化与黄果酵素趋势不同,推测原因是青果发酵过程中微生物数量远超黄果酵素,所以消耗糖量的速度极快。
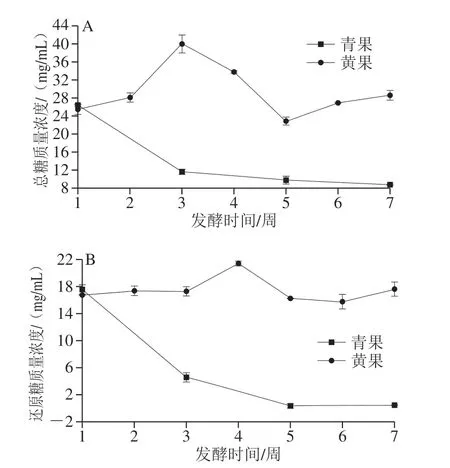
图2 成熟度对诺丽果发酵过程中总糖(A)和还原糖(B)的影响Fig. 2 Effect of maturity on total sugar (A) and reducing sugar (B)contents during noni fruit fermentation
2.3 诺丽果发酵过程中菌落总数、霉菌和酵母菌的变化
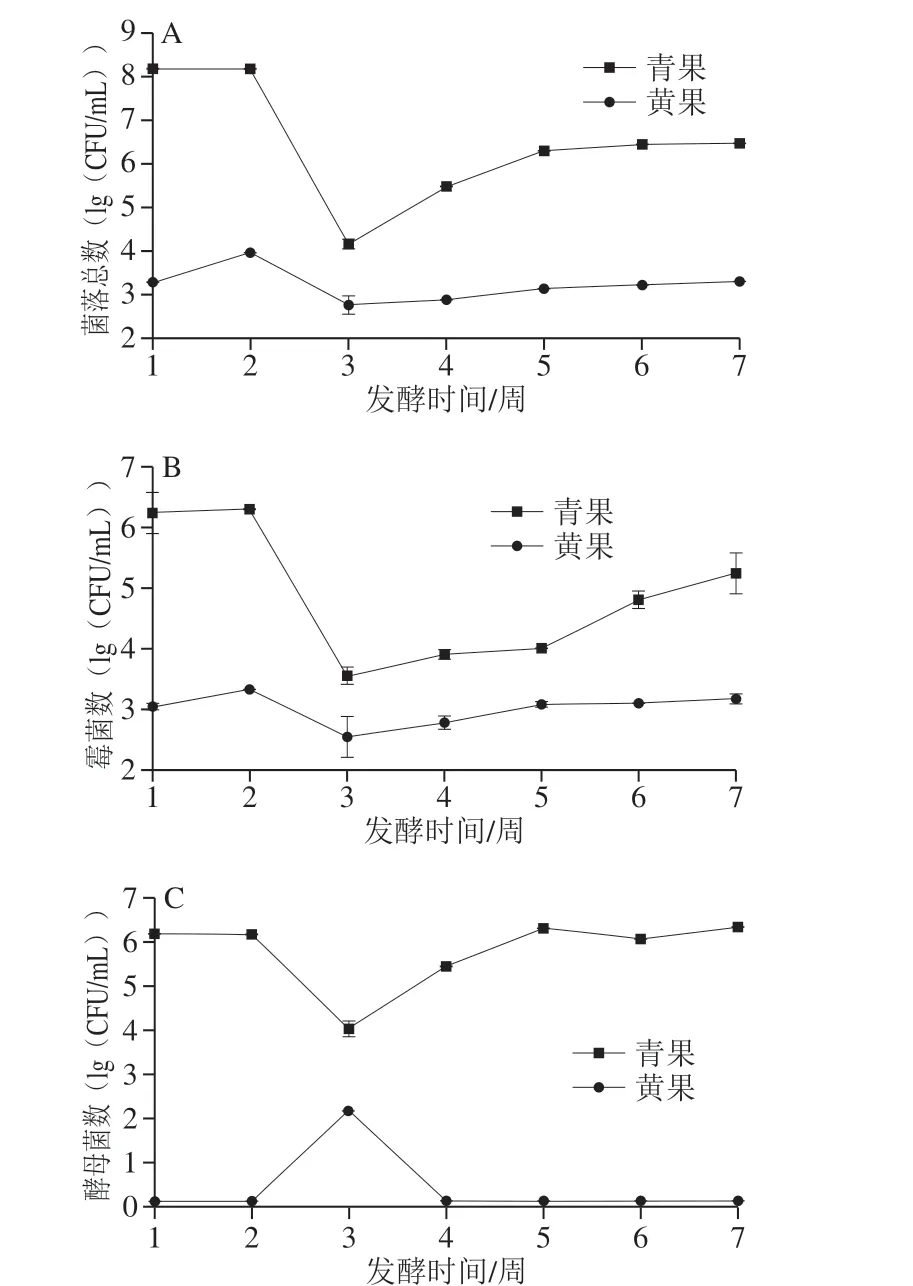
图3 成熟度对诺丽果发酵过程中菌落总数(A)和霉菌(B)、酵母菌(C)的影响规律Fig. 3 Effect of maturity on total number of colonies (A), mold count (B)and yeast count (C) during fermentation of noni fruit
由图3可知,诺丽果在发酵初期的菌落总数高于发酵后期,则诺丽果进行发酵后的菌落总数减少,说明诺丽果发酵过程中在一定程度上抑制了微生物的生长,起到了抑菌的作用。其中,在发酵至第3~4周诺丽果酵素的菌落总数呈现出低峰状态,微生物数量的减少推测原因可能是由诺丽果酵素的化学变化引起,原因有二:一是底物特征发生改变;二是诺丽果本身的抑菌性开始起作用,此时的抑菌效果最好。青果酵素的菌落总数远超过黄果酵素(P<0.05),数量级上的差距说明利用未成熟诺丽果进行发酵所得酵素对微生物的抑制作用不明显,其抑菌效果远低于利用完全成熟诺丽果酵素。青果与黄果的含糖量表现出明显不同,推测可能因为青果的菌落总数远高于黄果,导致青果酵素的总糖含量和还原糖含量低于黄果酵素,且呈急速下降趋势。
诺丽果酵素的霉菌在发酵过程中的总体变化趋势与菌落总数一致,从第2周开始,霉菌数量下降,后续发酵过程霉菌数量略有增加(P>0.05)。黄果酵素的酵母菌仅在第3周发酵液中检测到,其余发酵时间未检测到。青果酵素的霉菌和酵母菌数显著高于黄果酵素,这与菌落总数的实验结果相符。说明利用成熟诺丽果进行发酵所得的酵素抑制霉菌和酵母菌的能力远大于未成熟诺丽果酵素,Dittmar[34]于1993年得出诺丽果的成熟程度与加工方式影响其抗菌性,其成熟诺丽果的抗菌性优于未成熟诺丽果,本实验佐证其观点,推测诺丽果在成熟过程中合成了某种具有抑菌性的物质,并且在发酵过程中能够保留下来。
2.4 诺丽果发酵过程中理化指标的变化
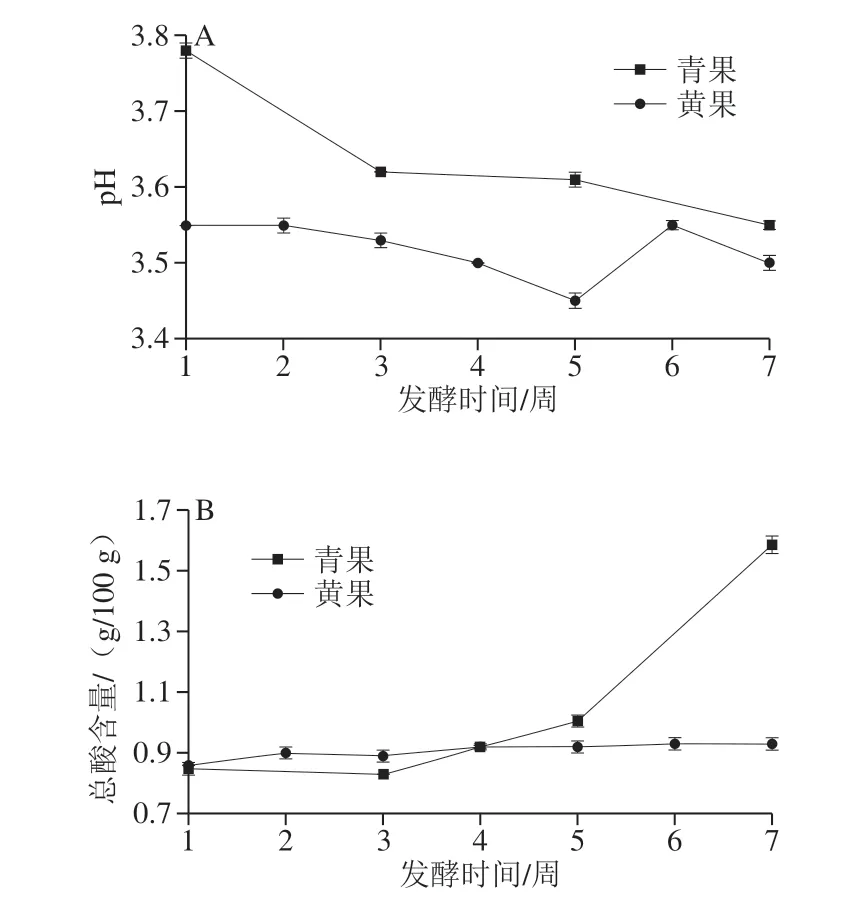
图4 成熟度对诺丽果发酵过程中pH值(A)和总酸(B)的影响Fig. 4 Effect of maturity on pH (A) and total acid content (B) during fermentation of noni fruit
工业和信息化部于2018年12月21日颁布了酵素行业标准QB/T 5323—2018《植物酵素》[35],酵素品质有了规范可循。标准规定食用植物酵素的pH≤4.5、总酸≥0.8 g/100 g。如图4A所示,青果和黄果酵素的pH值随着发酵时间的延长呈现下降趋势(P>0.05),在发酵过程中青果酵素的pH值高于黄果酵素(P<0.05),且pH值符合QB/T 5323—2018的要求,同时与郝玉洁等[33]在研究诺丽果在37 ℃控温发酵过程中pH值从3.9缓慢下降至3.6结果相符。如图4B所示,青果酵素和黄果酵素的初始总酸含量水平相当,随着发酵时间的延长,总酸含量均有所增加(P>0.05),但增长幅度不同。黄果酵素总酸含量经过发酵有微量增加,从0.86 g/100 g缓慢上升至0.93 g/100 g,青果酵素总酸含量的增长速度远高于黄果酵素,并无显著性差异,相比于发酵初期总酸含量增加了1 倍。同时两种酵素在发酵过程中的总酸符合其技术规范。其中青果酵素的pH值不断下降,总酸不断上升,推测主要是由于青果酵素中酵母菌含量较高,酵母菌代谢生成的有机酸、二氧化碳等物质积累而成。
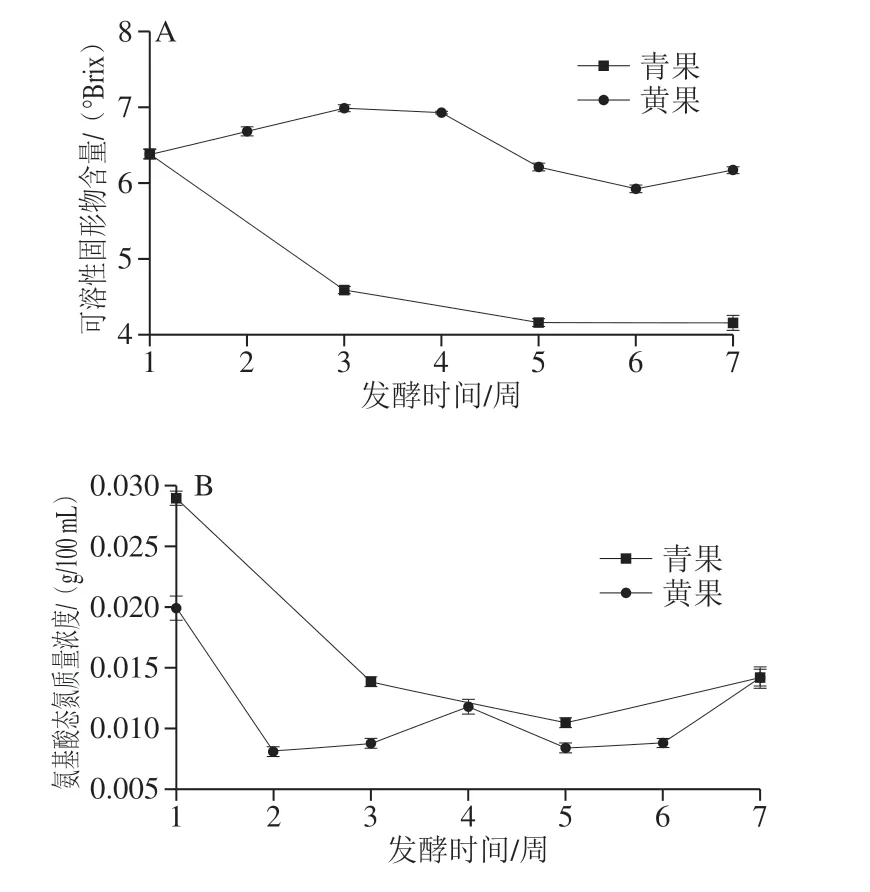
图5 成熟度对诺丽果发酵过程中可溶性固形物(A)和氨基酸态氮(B)的影响规律Fig. 5 Effect of maturity on soluble solids (A) and amino nitrogen (B)contents during fermentation of noni fruit
如图5A所示,青果在发酵过程中的可溶性固形物不断减少,从6.3 °Brix下降至4.2 °Brix(P>0.05),而黄果酵素的可溶性固形物则是呈波动性变化(P>0.05),稳定在6.0~7.0 °Brix范围内,原因可能是由于青色诺丽果硬度较大,结构致密。如图5B所示,诺丽果在发酵初期氨基酸态氮含量下降幅度较大,在后续发酵过程中含量基本保持稳定(P<0.05),推测可能是由于随着发酵的进行,氨基酸被菌体利用,导致其氨基酸态氮含量不断下降,发酵后期由于菌体生长缓慢,氨基酸消耗逐渐变小。
3 结 论
本研究利用未成熟的青色诺丽果和成熟的黄色诺丽果进行发酵,结果表明,黄果酵素的抑菌性优于青果,青果第8周发酵液的酪氨酸酶抑制率和胰脂肪酶抑制率均较高,具有潜在的美白功效和减肥功效。通过总多酚和SOD活力的测定可以得出缩短发酵时间有利于保留更好的抗氧化性。青果和黄果酵素的pH值和总酸均符合植物酵素标准,其中青果酵素的pH值高于黄果酵素,可溶性固形物含量低于黄果酵素。
——徐州市青果小作家基地简介

