具有透明质酸酶抑制活性益生菌的体外筛选及鉴定
雷文平,周 辉,陈 绮,周杏荣,吴 坤,汪家琦,刘成国,*
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.澳优乳业(中国)有限公司,湖南 长沙 410200)
近年来,过敏性疾病日益增加,诱发过敏反应的因素也持续增多,其已属于常见的多发性病症[1-2]。过敏是由于外源物质进入人体,机体的免疫系统将此类物质识别为异物,致使免疫系统紊乱,引起过敏、炎症等症状[3]。过敏反应根据其机理可分为I、II、III和IV型,绝大部分过敏疾病是与体内透明质酸酶活性相关的I型过敏反应;透明质酸酶是降解透明质酸的水解酶,是机体结缔组织细胞外基质的主要成分,与大多数由IgE介导的I型和T细胞介导的IV型过敏反应有关,因此,透明质酸酶体外抑制实验是体外快速筛选抗过敏药物的有效方法[4-5]。目前,过敏疾病主要以药物治疗为主或避免接触环境和食物中过敏原;由于药物毒副作用大,且致使过敏反应的过敏原难以确定,无法根本解决过敏症状[6]。
益生菌作为人体肠道中的有益微生物,能够预防多种疾病(包括胃肠道感染、血压或血清胆固醇升高、肿瘤和过敏等疾病)[7]。Yang Bo等[8]研究表明益生菌能够降低通过鸡卵白蛋白(ovalbumin,OVA)致敏小鼠血清中OVA-IgE和OVA-IgG1含量,减少脾脏Th2相关细胞因子的释放以及缓解腹泻症状。已有研究表明乳酸菌菌株可诱导T细胞参与的一般免疫抑制,并产生可调节T细胞,从而控制过敏性炎症[9-10]。此外,Charalambos等[11]研究发现植物乳杆菌DC 2035和2012的细胞表面特性,具备潜在的免疫调节能力,表明菌株的细胞表面特性能够作为抗过敏益生菌筛选的指标之一。因此,本研究通过体外抗逆性、黏附性、抑菌性、体外安全性4 个指标对菌株益生特性进行评价;然后以透明质酸酶体外抑制实验筛选具有高透明质酸酶抑制活性的益生菌并进行鉴定,旨在为菌种资源的综合利用和益生菌抗过敏活性的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜牛奶来自南山牧业有限公司-南山牧场;金黄色葡萄球菌(ATCC 6538)、单核细胞性李斯特菌(ATCC 19115)、大肠杆菌(CGMCC 9181)、鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)由湖南农业大学食品科技学院实验室提供。
血平板、生物胺试剂盒、MRS(Man Rogosa Sharpe)肉汤、琼脂、革兰氏染色试剂盒、牛胆盐 广东环凯微生物科技有限公司;胃蛋白酶(3 000~3 500 U/g)、牛磺胆盐 北京索莱宝科技有限公司;胰蛋白酶(≥50 000 U/g) 国药集团化学试剂有限公司;抗生素试剂盒(20 种) 杭州微生物试剂有限公司;透明质酸酶(≥300 U/g)、透明质酸钠 上海瑞永生物科技有限公司;DNA细菌提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
GZ-400-S恒温培养箱 韶关市广智科技设备有限公司;SW-CJ-2D双人单面垂直净化工作台 苏州净化有限公司;BKQ-B50II全自动高压蒸汽灭菌锅 山东博科科学仪器有限公司;HH-601超级恒温水浴锅 常州市万丰仪器制造有限公司;TG16-WS台式高速离心机湖南湘仪实验室仪器开发有限公司;HF90二氧化碳培养箱 力康生物医疗科技控股有限公司。
1.3 方法
1.3.1 乳酸菌的分离及菌悬液的制备
乳酸菌的分离:将从湖南山区高海拔牧场(南山牧场,平均海拔>1 760 m)所采集的牛奶样品以10 倍系列梯度进行稀释,并涂布于MRS固体(含0.5 g/100 mL CaCO3)平板上,于37 ℃培养48 h。选取具有乳酸菌典型菌落形态、溶钙圈和革兰氏染色呈现阳性的菌株进行划线纯化,并编号保存。
菌悬液的制备:将分离保藏的菌株用MRS液体培养基于37 ℃培养24 h,活化2 代,在4 ℃、9 800×g条件下离心3 min;并用无菌生理盐水洗涤2 次,重悬,使菌悬液OD600nm值为0.8。
1.3.2 耐酸和耐胆盐实验
将菌悬液以3%接种量分别接种于pH 2和含3.0 g/L牛胆盐的MRS液体培养基中,37 ℃培养12 h,观测菌液是否浑浊,选出培养基均浑浊的菌株[12]。
1.3.3 模拟胃肠液实验
分别向4.5 mL的无菌模拟胃液和肠液中加入0.5 mL的菌悬液,混合均匀,于37 ℃孵育3 h,并采用平板计数法分别计算0 h和3 h的活菌数。其中人工胃液和肠液参照文献[13]进行配制,并以LGG作为对照。菌株存活率计算如式(1)所示:

1.3.4 胆盐水解酶活性和抗菌活性
胆盐水解酶活性:将牛津杯放置于含有3 g/L牛磺胆盐的MRS固体培养基上,并加入200 μL的菌悬液,于37 ℃培养72 h,观察是否具有透明圈产生,根据圈透明度大小及透明度判定其胆盐水解酶活性;并以植物乳杆菌WCFS1为阳性对照菌株。
抗菌活性采用牛津杯法[14]进行测定,以大肠杆菌和单核细胞性李斯特菌为指示菌株。
1.3.5 菌株表面特性
1.3.5.1 自聚集
将1 mL菌悬液用旋涡混合仪涡旋10 s,并在37 ℃孵育5 h,轻取200 μL上层悬液,测定600 nm波长处的吸光度,以LGG为对照菌株。其自聚集计算如式(2)所示:
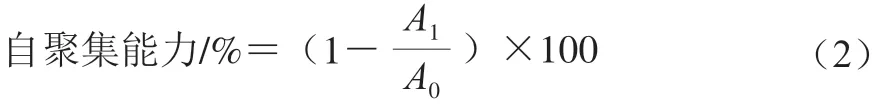
式中:A1为处理5 h的吸光度;A0为初始菌悬液的吸光度。
1.3.5.2 共聚集
分别以单核细胞性李斯特菌和大肠杆菌对分离菌株的共聚集能力进行评价;将等体积的筛选菌株和致病菌菌悬液混合,涡旋混合仪振荡10 s,在37 ℃孵育5 h后,轻取200 μL上层悬液,测定600 nm波长处的吸光度(A混),以LGG为对照菌株。其共聚集能力计算如式(3)所示:
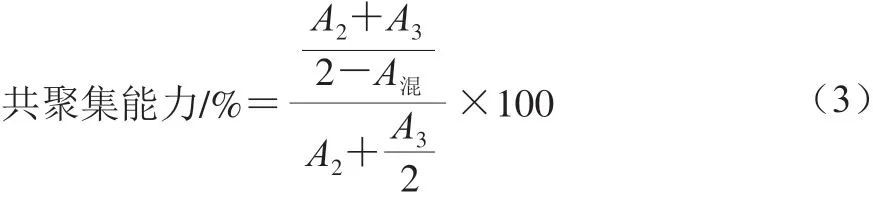
式中:A2和A3分别为受试菌与致病菌菌悬液单独处理5 h的吸光度。
1.3.5.3 疏水性
参照文献[15]的方法进行测定,其中有机试剂为十六烷和乙酸乙酯。
1.3.6 Caco-2细胞黏附
细胞培养:将液氮保存的Caco-2细胞快速解冻,转入培养瓶中,加入含10%胎牛血清的伯克改良伊格尔(Dulbecco's modified eagle medium,DMEM)高糖培养基,并于5% CO2、37 ℃培养箱中培养。每2 d换液,当细胞的融合度达到80%~90%时传代培养,3 次传代进行实验。
黏附实验[16]:向6 孔细胞培养板中转入1 mL传代培养3 次的Caco-2细胞悬液(5×104cells/mL),并于5% CO2、37 ℃培养箱中培养,直至细胞长至单层。将培养基吸出,用无菌磷酸盐缓冲液洗2 次,加入菌悬液于二氧化碳培养箱中孵育2 h;然后除去培养板各孔的悬液,无菌磷酸盐缓冲液洗3 次以除去未黏附的菌体,细胞刮获取细胞,采用血球计数板测定每孔的Caco-2细胞数和平板计数法计算黏附细菌数。黏附能力计算如式(4)所示:
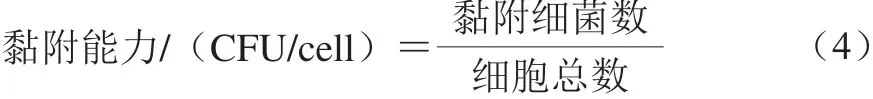
1.3.7 安全性评价
溶血性:将受试菌株菌悬液点种于血琼脂平板上,并在37 ℃孵育48 h,然后观察菌株的溶血现象。
抗生素敏感性和产生物胺:使用含有20 种抗生素的药物敏感性片剂试剂盒确定分离株的抗生素敏感性;通过赖氨酸脱羧酶试剂盒测试菌株产生生物胺的潜力。
1.3.8 透明质酸酶体外抑制分析
参照Elson-Morgan法[17]稍作修改,向试管中加入0.1 mL 2.5 mmol/L的CaCl2和0.5 mL 600 U/mL的透明质酸酶,37 ℃处理20 min;加菌悬液0.5 mL,37 ℃处理20 min;加入0.5 mL 0.5 mg/mL的透明质酸钠溶液,37 ℃处理30 min;常温静置5 min,将入0.5 mL乙酰丙酮溶液(1.4 mL乙酰丙酮溶于20 mL 1.0 mol/L的Na2CO3溶液,现用现配)和0.1 mL 0.4 mol/L NaOH溶液,沸水浴15 min,立即冰浴5 min;加入1 mL埃尔利希试剂(称取0.8 g的对二甲氨基苯甲醛溶于15 mL的浓盐酸和15 mL无水乙醇中,现用现配),常温显色20 min,于530 nm波长处测定其吸光度,以LGG为对照菌株。抑制率计算如式(5)所示:
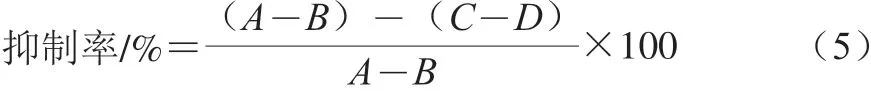
式中:A为对照组吸光度(醋酸缓冲液取代菌悬液);B为空白组吸光度(醋酸缓冲液取代酶溶液和菌悬液);C为实验组吸光度;D为试样空白组吸光度(醋酸缓冲液取代酶溶液)。
1.3.9 16S rDNA菌株鉴定
将过夜培养的受试菌株用TIANmp细菌DNA提取试剂盒提取总DNA。聚合酶链式反应(polymerase chain reaction,PCR)体系为:2 μL Taq缓冲液,0.4 μL Taq酶,0.5 μL上引物(27f/1512r),2 μL样品DNA,1.6 μL dNTPs和13 μL双蒸馏水。PCR产物由华大基因进行测序。然后使用BLAST算法在GenBank数据库中对序列进行匹配,并利用MEGA 5软件绘制系统发育树。
1.4 数据统计
采用Excel 2010软件进行数据统计分析,以SPSS Statistics 21进行方差分析(ANOVA)和最小显著差异多重比较,P<0.05,差异显著;使用Origin 2018软件作图。
2 结果与分析
2.1 菌株分离及耐酸耐胆盐结果
通过MRS培养基分离和革兰氏染色,从3 个牛奶样品中分离出50 株革兰氏阳性菌株,其中菌株L02、L08、L10、L11和L15在酸和高胆盐环境中表现出良好耐受性,将该5 株菌进行下一步研究。部分菌株菌落图和镜检图见图1。
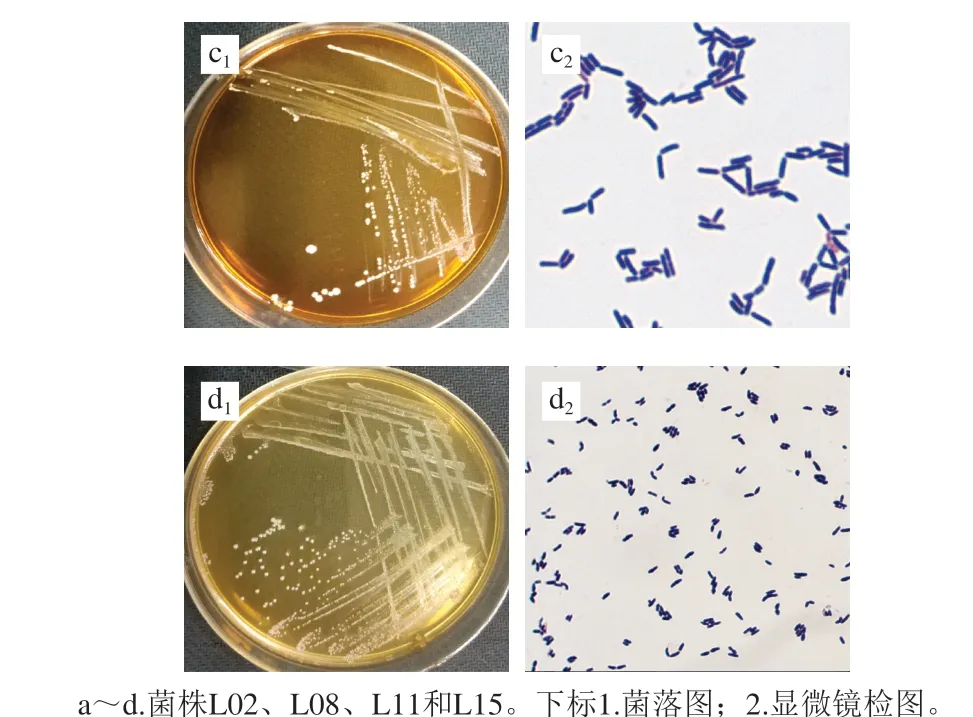
图1 菌株菌落图和显微镜检图Fig. 1 Colony morphology and micrographs of isolates
2.2 菌株对模拟胃肠液的耐受性结果
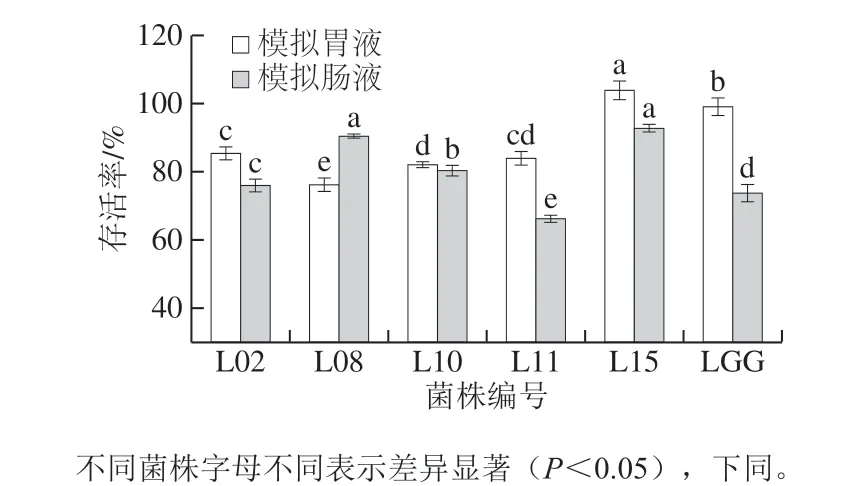
图2 分离菌株对模拟胃肠液的耐受性Fig. 2 Resistance of isolates to simulated gastrointestinal fluids
益生菌在经受模拟胃肠液后能够存活足够数量的能力是菌株进入人体定植必要条件[18]。由图2可知,所有菌株在模拟胃肠液中表现出较高存活率,均大于60%,其中菌株L15在模拟胃液和肠液中的存活率最高分别为(103.884±2.722)%和(92.785±1.122)%,显著高于其他菌株(P<0.05);与对照菌株LGG相比,菌株L02和L10也具有较好耐受性。同时,研究表明由于菌株或物种的特异性,不同菌株对胃肠液的耐受性存在显著差异(P<0.05),并且在胃肠道中的存活浓度高于107CFU/g(粪便质量计),才能够发挥对宿主的益生效果;因此,通过体外模拟胃肠道环境筛选高存活率益生菌具有重要意义[19]。
2.3 菌株胆盐水解酶活性和抗菌活性
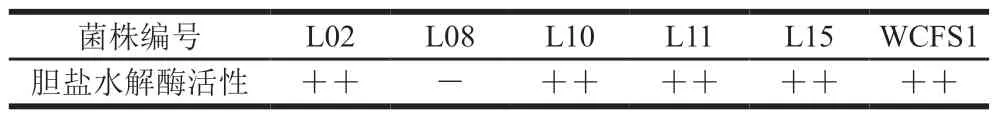
表1 菌株胆盐水解酶活性Table 1 Bile salt hydrolase activity of isolates
由表1可知,所有菌株具有胆盐水解酶活性,且与对照菌株WCFS1相比,具有相近的活性,而菌株L08并未表现出胆盐水解酶活性;虽然胆盐水解酶活性与益生菌耐受肠道胆盐有一定相关性,但有研究表明并不是菌株耐受胆盐的唯一指标,需要研究其耐受机制[20];同时,也有研究表明胆盐水解活性与益生菌的胆固醇清除有关[21];因此,可作为筛选具有降胆固醇潜力的益生菌参照指标。
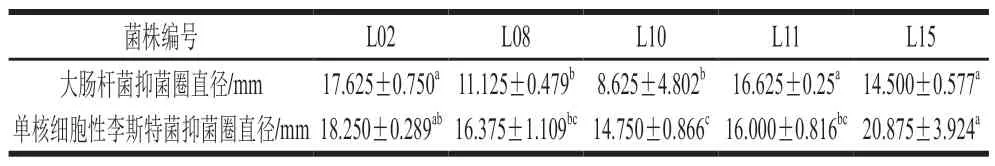
表2 分离菌株抗菌活性Table 2 Antibacterial activities of isolates
益生菌抗菌活性是预防宿主被病原菌感染的基础。由表2可知,所有菌株对大肠杆菌和单核细胞性李斯特菌均有抑制作用,表明所筛选菌株可能能够抑制大部分革兰氏阳性和阴性病原菌;其中菌株L02、L08和L15对2 株致病菌表现出较强抑菌活性,其抑菌圈直径均大于11.000 mm。虽然所有菌株具有抑菌活性,但菌株的抗菌能力主要是由于自产有机酸、细菌素和过氧化氢等物质,具体抗菌物质的性质仍然未知。因此,有必要进一步研究其具体组成[22]。
2.4 菌株表面特性
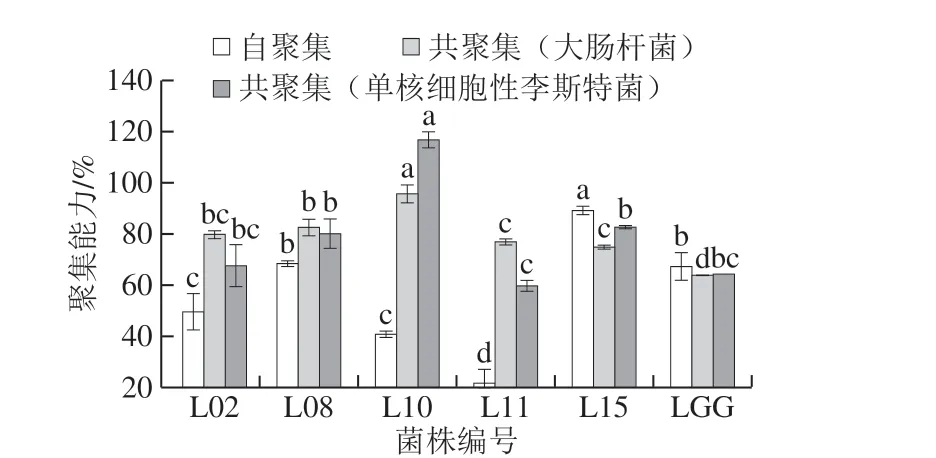
图3 分离菌株的聚集能力Fig. 3 Aggregation abilities of isolates
从图3 可以看出,由于菌株表面特异性,不同菌株间的自聚集能力差异显著(P<0.05),其值在(21.521±5.472)%~(89.298±1.636)%之间,表明这些菌株在人肠道中具有潜在的黏附和定植能力。其中菌株L15具有最高自聚集能力((89.298±1.636)%),这一结果与Gómez等[23]报道一致。与对照菌株LGG相比,所有受试菌株对大肠杆菌和单核细胞性李斯特菌2 株致病菌表现出接近或高于LGG的共聚集能力,表明菌株对不同致病菌具有较强的共聚集能力,研究表明具有高共聚集能力的益生菌可以通过竞争肠上皮细胞上的结合位点来防止不同的病原体黏附[24]。因此,益生菌可能是减少病原菌定植并预防感染的候选者。
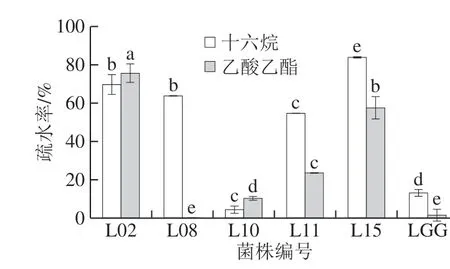
图4 分离菌株的疏水性Fig. 4 Hydrophobicity of isolates
疏水性是益生菌细胞黏附肠道上皮细胞的重要指标之一。由图4可知,通过十六烷和乙酸乙酯两种有机试剂处理,不同菌株间的疏水性差异显著(P<0.05),菌株L02和L15在两种有机试剂中的疏水性均显著(P<0.05)高于其他菌株,均高于60%;并且与LGG相比,菌株L11也具有较好疏水性。其中菌株L08仅对十六烷表现出较高疏水性,而对乙酸乙酯表现出最低疏水能力;因十六烷是菌株表面疏水性的表现,而乙酸乙酯反映菌株的表面Lewis酸碱性,表明菌株表面呈现碱性[25];相关研究指出疏水性受菌株的年龄、表面化学成分以及培养物组成的影响,所以疏水性并无标准值;但高疏水性是益生菌黏附特性的一个积极特征[26]。
2.5 菌株对Caco-2细胞黏附结果
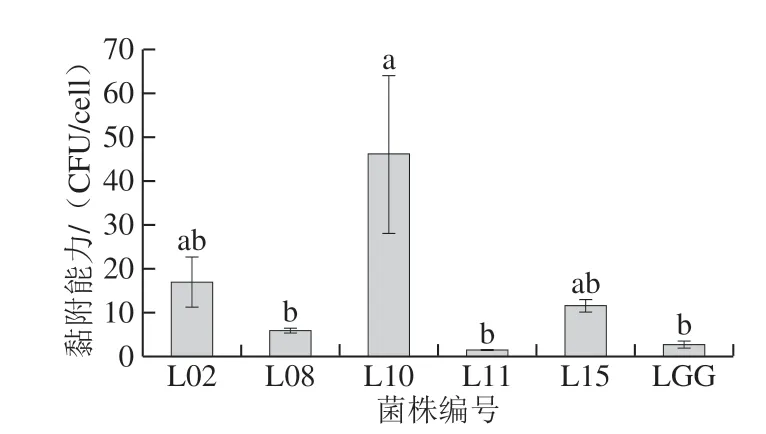
图5 分离菌株的黏附能力Fig. 5 Adhesion abilities of isolates
益生菌对肠道表面的黏附和人胃肠道的定植是其发挥益生作用的至关重要条件。由图5可知,菌株L10、L02和L15表现出良好的黏附特性,均高于对照益生菌LGG((2.660±0.751)CFU/cell);其中菌株L10具有最高黏附能力((46.001±17.962)CFU/cell);但是菌株L11表现出较低黏附力,仅为(1.416±0.101)CFU/cell,可能取决于不同表面决定因素(包括疏水、静电相互作用、空间力和表面分子)[27]。同时,不同研究结果表现出不同的细胞黏附性能,可能归因于Caco-2细胞的培养环境和用于分析的方法[28-29]。 此外,高黏附力的益生菌菌株可能在人类胃肠道中持续更长的时间;并且与非黏附微生物相比,它们具有更好的代谢和免疫调节作用。
2.6 菌株安全性评价
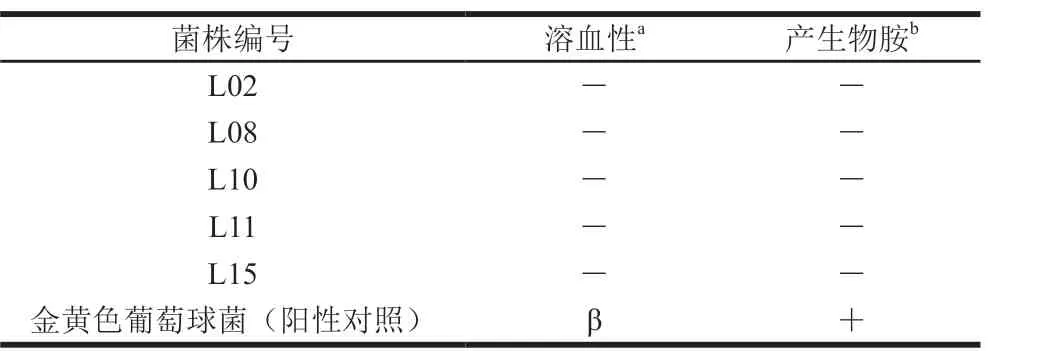
表3 菌株溶血性和产生物胺分析Table 3 Hemolytic potential and biogenic amine-producing abilities of isolates
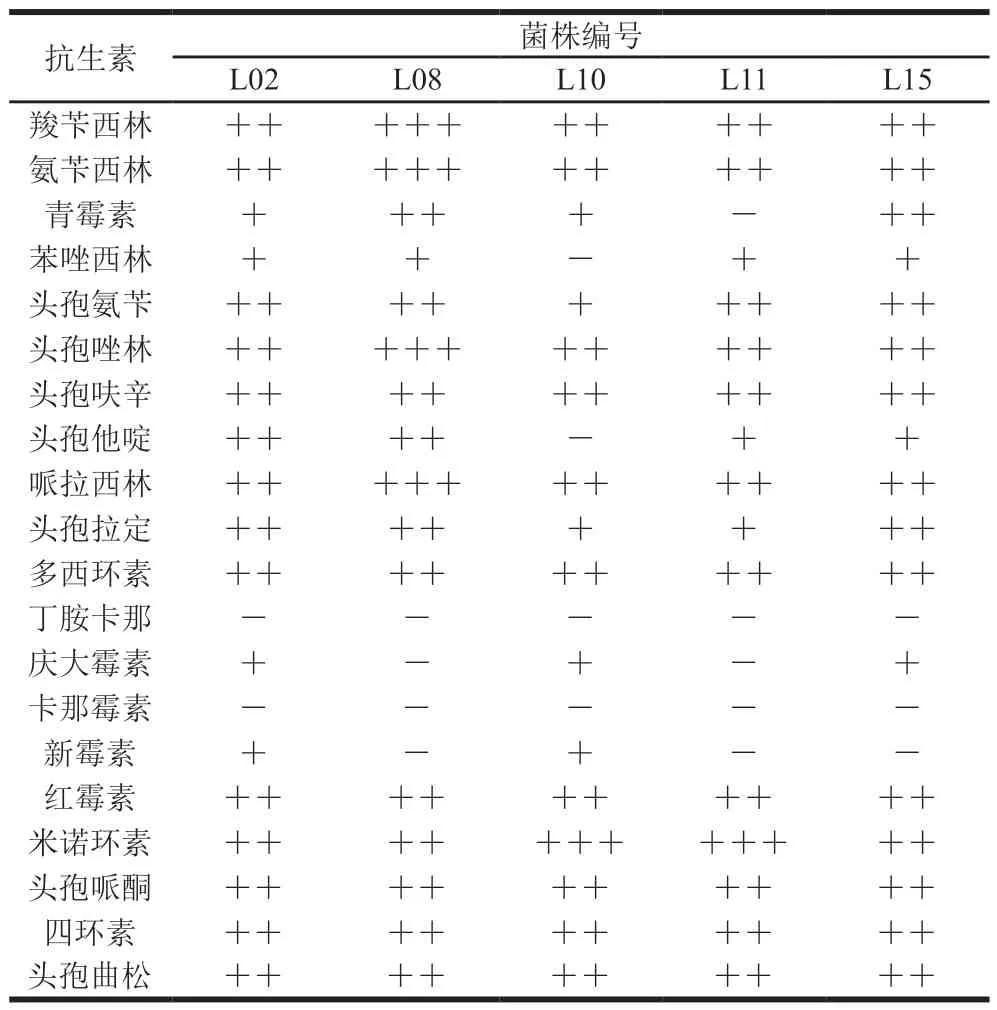
表4 菌株抗生素敏感性Table 4 Antibiotic sensitivities of isolates
为了能够保证所筛选菌株能安全地应用于食品加工,进一步从溶血性、产生物胺和抗生素敏感性等方面评价菌株的安全性。由表3可知,受试菌对并未表现出α和β溶血作用,产生物胺呈现阴性;通常益生菌中应避免在致病细菌(如链球菌和葡萄球菌等)中出现的此特征。由表4可知,菌株对20 种抗生素的敏感性存在差异性,所有菌株对卡那霉素均不敏感,且对丁胺卡那、庆大霉素、卡那霉素和新霉素敏感性较弱,可能是因为此类抗生素仅对革兰氏阴性菌株具有抑制作用;而大部分菌株对其他抗生素较敏感;本实验结果与之前相关学者报道较一致[30-32]。此外,菌株抗耐药性可以是固有或获得性的,这使得细菌耐药性可能在相关动物中发生耐药性基因的迁移[33]。因此,所筛选菌株能初步确定在使用上无致病性。
2.7 菌株透明质酸酶体外抑制分析
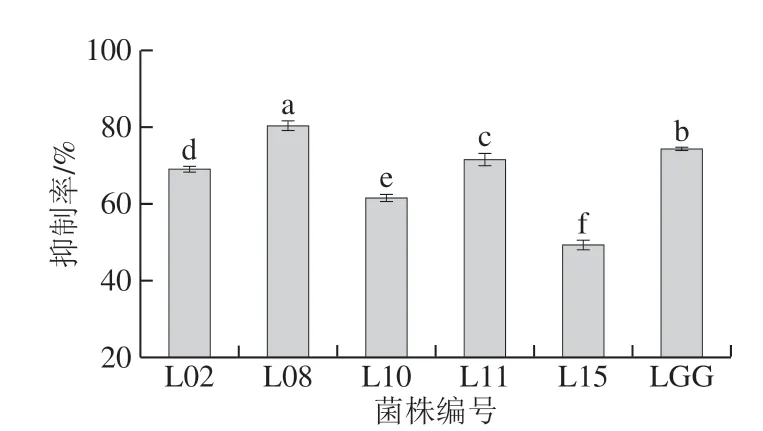
图6 分离菌株透明质酸酶抑制活性Fig. 6 Hyaluronidase inhibitory activities of isolates
研究表明透明质酸酶能明显促进细胞的迁移和增殖,也会参与到部分恶性肿瘤细胞的繁殖,其与炎症、过敏较强相关性,是体外筛选抗过敏药物的有效方法[34]。由图6可知,所筛选菌株具有较高的透明质酸酶抑制活性,且存在显著差异(P<0.05);其抑制率在(49.261±1.262)%~(80.404±1.262)%之间,菌株L08表现出最高抑制活性;并且相比阳性菌株LGG,菌株L02和L11呈现相近的抑制率,分别为(68.974±0.808)%和(71.54±1.654)%;表明所筛选菌株具有潜在抗过敏活性。这可能与细胞表面特性(如共聚集、疏水性和细胞黏附性等)有一定相关性,并且研究发现植物乳杆菌L67的糖蛋白可抑制BPA刺激的RBL-2H3细胞的脱粒和组胺的释放以及细胞中TNF-α和IL-4的表达[11,35]。因此,有必要结合益生菌表面特性进一步证明菌株的抗过敏能力。
2.8 菌株16S rDNA鉴定结果
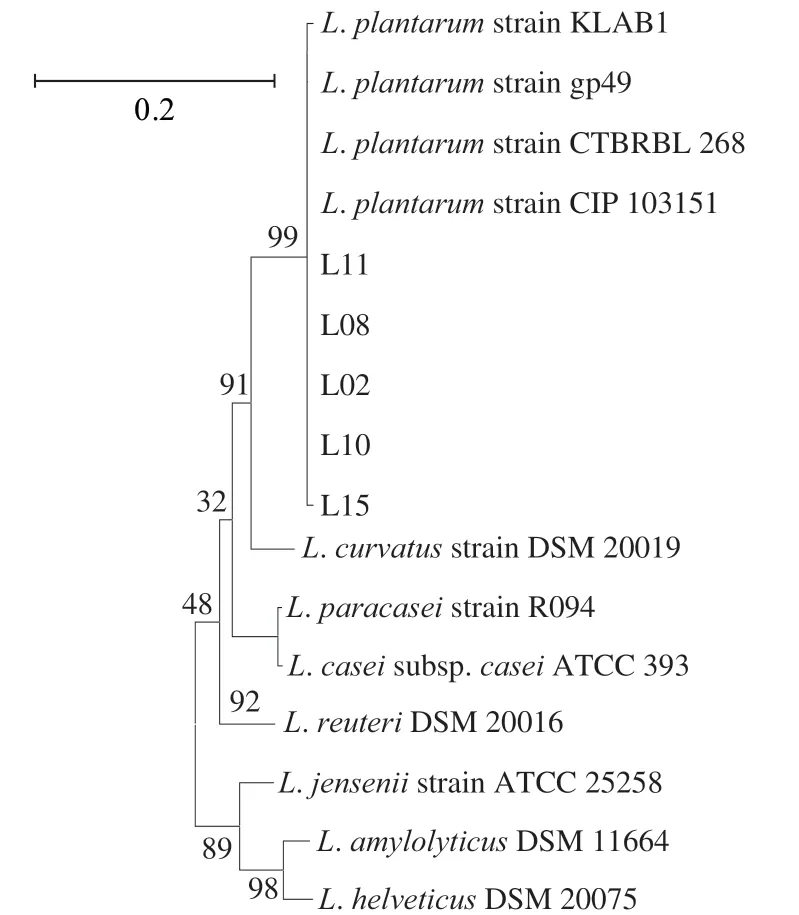
图7 菌株系统发育树Fig. 7 Phylogenetic tree of isolates
将所筛选菌株的PCR扩增产物,送至华大基因进行测序;测序结果在NCBI数据库中进行BLAST比对,所有菌株与植物乳杆菌同源性高于98%,表明上述菌株均为植物乳杆菌;并且从系统发育树可以看出(图7),所筛选菌株与植物乳杆菌在同一分支上;因此,可进一步确定筛选菌株均为植物乳杆菌。
3 结 论
本研究通过菌株益生特性体外评价和透明质酸酶体外抑制实验,快速筛选具有抗过敏潜能的益生菌。分离出的50 株菌中5 株表现出对酸和胆盐耐受;相比较对照菌株LGG,这5 株菌均具备良好的体外抗逆性和高黏附性,并初步判定为安全菌株,能有效地在人体内发挥其功能特性;同时,5 株菌株的透明质酸酶抑制活性高于40%,在抗过敏方面具有潜在功效;其中菌株L02和L15各方面均相对突出,且鉴定结果均为植物乳杆菌。由于受试样品均为菌株菌体,且相关研究表明其表面特性与菌株抗过敏活性有关,因此,菌株表面性质与治疗过敏疾病的相关性有待进一步研究。

