口腔鳞癌Survivin 表达的临床意义与PCNA 关系研究*
于肖鹏 李晓光 苏庆琪 刘 桐 李腾宇 王延秀
口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是目前临床上常见的恶性肿瘤,现阶段治疗此病的最有效方法仍然是肿瘤手术切除,现在其预后不良的原因主要是肿瘤发生淋巴结转移及局部复发[1],其转移复发的原因之一是OSCC 细胞的恶性增殖。Survivin 基因既有抑制肿瘤细胞凋亡作用,还有调节肿瘤细胞周期的有丝分裂作用,其具有的双重功能成为目前研究的热点[2]。增殖细胞核抗原(Pr oliferating Cell Nuclear Antigen,PCNA)作为DNA 聚合酶的一种辅助性蛋白,能够反应出细胞的生长增殖情况[3,4]。本研究课题通过免疫组化的实验方法,测定PCNA 和Survivin 蛋白在口腔鳞癌中的表达,研究Survivin 表达的意义,以及与PCNA 表达的相关性。
1.材料与方法
1.1 临床资料及切片制备 OSCC 标本共106例,来自2007 年1月至2017 年12月我院颌面外科病房手术切除组织,患者年龄34~78 岁,平均60.6 岁,其中女性41 例,男性65 例。根据术后病理检查结果判断颌颈部的淋巴结是否发生转移。10 例正常口腔黏膜,取自口腔黏膜外伤组织。选取的106 例患者术前均未进行化学治疗或放射治疗,临床分期按照TNM 国际统一分期方法(UICC)分组,其中Ⅰ期14 例,Ⅱ期为29 例,Ⅲ期38 例,Ⅳ期为25 例。组织病理学分级为:1 级33 例,2 级为51 例,3 级为22 例。具体肿瘤部位为:舌癌41例,牙龈癌为30 例,颊癌13 例,硬腭癌为8 例,口底癌14 例。免疫组化染色方法采用抗PCNA 和Survivin 单克隆抗体,分别对OSCC 切片染色。同时进行常规HE 染色。
1.2 免疫组织化学染色 染色试剂DAB 由Sigma 公司提供,PCNA 及Survivin 单克隆抗体由武汉博士德公司提供。按照试剂说明以SABC免疫组织化学法常规操作。阳性对照分别用已知Survivin 及PCNA 阳性的乳腺癌切片作对照,阴性对照采取第一抗体用PBS 替代作对照,用DAB显色,再用苏木精复染。
1.3 Survivin 蛋白表达的判断标准 肿瘤细胞质内含有棕褐色样颗粒即视为阳性染色(图1)。每张切片有10%以上的癌细胞表现为弱、中等着色强度[5],即判断为Survivin 表达阳性。

图1 Survivin 阳性细胞浆内含有棕色颗粒(免疫组化DAB 染色×400)
1.4 PCNA 标记指数(PCNA Label index,PLI)的计算方法 肿瘤细胞核有棕褐色染色即视为PCNA染色阳性(图2)。选取500 个肿瘤细胞计数其中PCNA 阳性细胞数量,其所占百分数则为PLI。
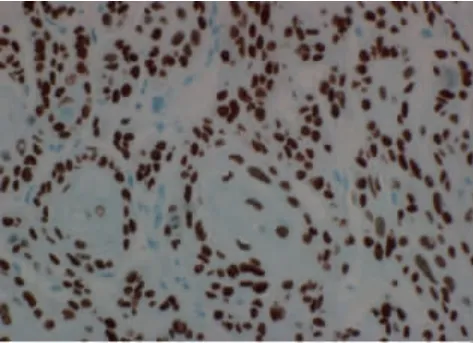
图2 PCNA 阳性细胞核内含有棕褐色颗粒(免疫组化DAB 染色×400)
1.5 统计学分析 实验数据采用SPSS17.0 统计学软件包分析,Survivin 表达与PLI 和临床因素关系的判断使用卡方检验。P<0.05 认为差异有统计学意义。
2.结果
2.1 Survivin 的表达及PLI 检测结果 74 例肿瘤组织Survivin 染色呈阳性,阳性率为69.81%。正常口腔黏膜组织中无表达,二者差异显著(X2=19.28,P<0.01)。PLI 值为16.1%~96.2%,平均值为(55.01±22.02)%,以PLI 平均值分为低56 例(16.1%~56.15%)、高50 例(56.15%~96.2%)两组进行统计分析。
2.2 肿瘤组织中Survivin 蛋白表达与病理因素关系 Survivin 的蛋白表达量与OSCC 的淋巴结转移、病理分级和TNM 分期密切相关(P<0.01),见表1。

表1 Survivin 表达与临床病理因素的关系(例数)
2.3 肿瘤组织中Survivin 表达与PCNA 的关系 Survivin 表达阳性的口腔鳞状细胞癌组,其PLI 值明显高于Survivin 表达阴性组,两者表达明显正相关(P<0.01),结果见表2、图3、图4。

表2 Survivin 表达与PCNA 的关系

图3 Survivin 表达与PLI 值高低线图

图4 Survivin 表达与PLI 值高低线图
3.讨论
在细胞的DNA 中,存在着凋亡基因及抑制凋亡基因,正常情况下,两者处于平衡协调状态,维护着细胞的生死秩序。目前发现的众多凋亡抑制因子中,Survivin 是作用最强的因子,在人类所有肿瘤组织中,几乎都发现了其表达,它可以抑制多种细胞凋亡基因诱导的肿瘤凋亡,通过抑制抗癌药物的凋亡诱导,降低药效[6],且促使恶性肿瘤细胞的生长增殖。Survivin 在细胞增殖G2/ M 期选择性表达,同时具有细胞周期的特异性,在细胞的有丝分裂期,纺锤轴的微管可以与Survivin 进行结合,而微管的运动又可以调节Survivin 的表达水平,Survivin 过度表达时,就很难与结合的微管分离,这时候就可以出现其持续的抗凋亡效果。由此认为在细胞G2/ M 期,Survivin 通过抑制凋亡诱导,促进细胞的异常生长增殖[7]。多项报道认为其可作为肿瘤预后不良的标志[8-10]。
本结果表明,其Survivin 蛋白表达阳性率是69.81%,在高分化组是48.48%,而中低分化组高达79.45%,两组之间差异显著(P<0.01),说明随着肿瘤分化程度降低,Survivin 的凋亡抑制作用更强,表达与病理分级相关。同时Survivin 表达和临床分期也相关(P<0.01),在口腔鳞癌发病的后期其表达更强。本组Survivin 表达阳性患者,其颈部淋巴结发生转移的机率大于阴性者(P<0.01),二者密切相关,同多数其他学者研究相似[11,12]。由此说明Survivin 的过高表达可以抑制细胞凋亡,促进肿瘤的无限制生长。肿瘤发生死亡的原因约85%~95%是其转移引起[13],临床研究显示口腔鳞癌晚期更易出现转移,且与肿瘤的大小相关[14]。说明检测口腔鳞癌Survivin 蛋白的表达对预后判断有明显指导作用,靶向Survivin 基因治疗,将提供口腔癌治疗的新途径。
PCNA 蛋白的表达与细胞的生长增殖周期一致[15],常作为细胞增殖生长活性的指标[4,16]。已有多项临床及动物实验研究提示,PCNA 表达与口腔癌的病理分型和颈部淋巴结转移关系密切[17,18],可以作为其预后的指标之一。本项研究表明在Survivin表达阳性者中,PLI 值明显高于阴性者,差异显著(P<0.01),两者的表达明显相关,说明Survivin蛋白一方面调控肿瘤凋亡,同时促进肿瘤增殖。目前口腔癌治疗的最有效方法仍然是手术切除,本项研究提示肿瘤切除标本若survivin 和PCNA 都阳性表达,表明预后不良,应该进行术后放疗和巩固性治疗,并且术后密切随访。手术前在进行肿物活检时,建议同时进行survivin 和PCNA 检测,阳性者应考虑进行根治性切除。

