维持性血液透析患者嗜酸性粒细胞水平与颈动脉粥样硬化的关系
尚启航, 陈华茜
(1.锦州医科大学国药东风总医院 研究生培养基地, 湖北 十堰 442000 2.湖北医药学院附属国药东风医院 肾脏内科, 湖北 十堰 442000)
嗜酸性粒细胞(EOS)是人体免疫调节细胞之一,当EOS≥0.5×109/L或EOS%≥5%时称为EOS增多。人体的EOS水平受到严格调节,仅占外周血白细胞的1%~3%,而慢性肾脏病(CKD)患者的EOS水平普遍较非CKD患者高,EOS增多在非透析依赖性慢性肾脏病(NDD-CKD)的患者中患病率为16%,在维持性血液透析(MHD)患者中的患病率高达4.7%~52%[1-5]。MHD患者由于长期微炎症状态、氧化应激、营养不良、钙磷代谢紊乱等因素,使得其发生动脉粥样硬化的风险远远高于普通人群。颈动脉超声简单易行,而颈动脉粥样硬化与全身血管粥样硬化有很好的相关性,所以临床中常用颈动脉来评估全身动脉硬化程度[6]。研究表明,EOS可以释放一些促进血管粥样硬化的炎症因子, 与发展为终末期肾病(ESRD)的风险以及CKD患者的病死率升高相关[7-8]。本研究主要探讨了MHD患者的EOS水平与颈动脉粥样硬化的关系。
1 资料与方法
1.1病例选择 选取2019年10月至2020年3月在国药东风总医院血液净化中心收治的临床资料完整的MHD患者151例。男82例,女69例,平均年龄(63.10±15.22)岁,平均透析龄为(3.32±3.09)年,基础病包括慢性肾炎性肾病32例,高血压肾病48例,糖尿病肾病42例,高尿酸肾病12例,多囊肾3例,梗阻性肾病5例,其他9例。151位患者中96(64%)例存在颈动脉硬化,其中67例为稳定斑块,29例为不稳定斑块。纳入标准:年龄>18岁;应用碳酸氢盐透析液,透析液流量为500 ml/min,透析血流量在250~300 ml/min,血管通路均为动静脉内瘘或,每周3次透析,采用普通肝素或低分子肝素抗凝,所用透析膜材料均为聚砜膜(Fresennius Medical Care AG & Co.KGaA)。排除标准:合并急慢性感染、免疫疾病、恶性肿瘤以及精神障碍;近期服用糖皮质激素、免疫抑制剂等导致EOS减少的药物。本研究已获院内医学伦理委员会批准。
1.2实验室指标检测 采集患者透析前的空腹静脉血, 采用ACL迈瑞-800全自动血细胞分析仪测定EOS、白细胞(WBC)、血红蛋白(HB)、血小板(PLT);CIL6200生化免疫一体机测定超敏C反应蛋白(hs-CRP)、白蛋白(ALB)、血清铁蛋白(SF)、全段甲状旁腺激素(iPTH)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、小而低密度脂蛋白(sdLDL)。根据EOS计数四分位数分为低、中、高3组。当hs-CRP>3.4 mg/L时, 可视为MHD患者存在微炎症状态[9]。
1.3颈动脉超声检查 使用Logic E9彩色多普勒超声测定颈动脉内中膜(IMT)。受试者呈仰卧状态,从颈动脉根部连续向上逐步观察左右颈动脉及分叉处的横轴、纵轴取舒张末期的管腔-内膜界面前缘垂直距离便是颈动脉IMT。任意一侧颈动脉IMT≥1.0 mm或有斑块形成视为硬化组,两侧颈动脉IMT<1.0 mm且无斑块形成视为对照组。超声图像为强且均匀的回声可认为是稳定斑块,超声图像为弱而不均的回声为不稳定斑块。
1.4统计学方法 使用SPSS 17.0进行数据处理,计量资料进行正态检验,若正态组间比较采用t检验,非正态数据组间比较采用非参数检验;计数资料以率表示,采用χ2检验或Fisher精确检验。相关性分析采用Spearman秩相关,采用非条件多元Logistic回归分析查找影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1实验室指标及微炎症状态 与对照组相比,硬化组EOS、TC、LDL-C、sdLDL水平高,微炎症状态检出率多,差异均具有统计学意义(P<0.05)。见表1。
2.2不同水平EOS颈动脉粥样硬化及微炎症状态检出率 EOS计数范围(0.00~3.67)×109/L, 根据EOS四分位数中的25%分位数(0.10×109/L)与75%分位数(0.28×109/L)分为低、中、高3组,3组的颈动脉硬化检出率与微炎症状态检出率差异有统计学意义(P<0.05)。见表2。
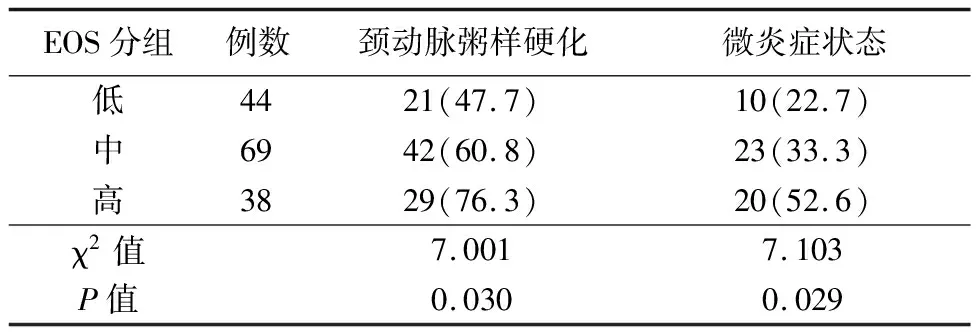
表2 不同水平EOS颈动脉粥样硬化及微炎症状态检出率[例(%)]
2.3MHD患者颈动脉粥样硬化的相关性分析 取左右两侧颈动脉IMT均值为变量,相关分析显示IMT与EOS、TC、LDL-C呈正相关。见表3。
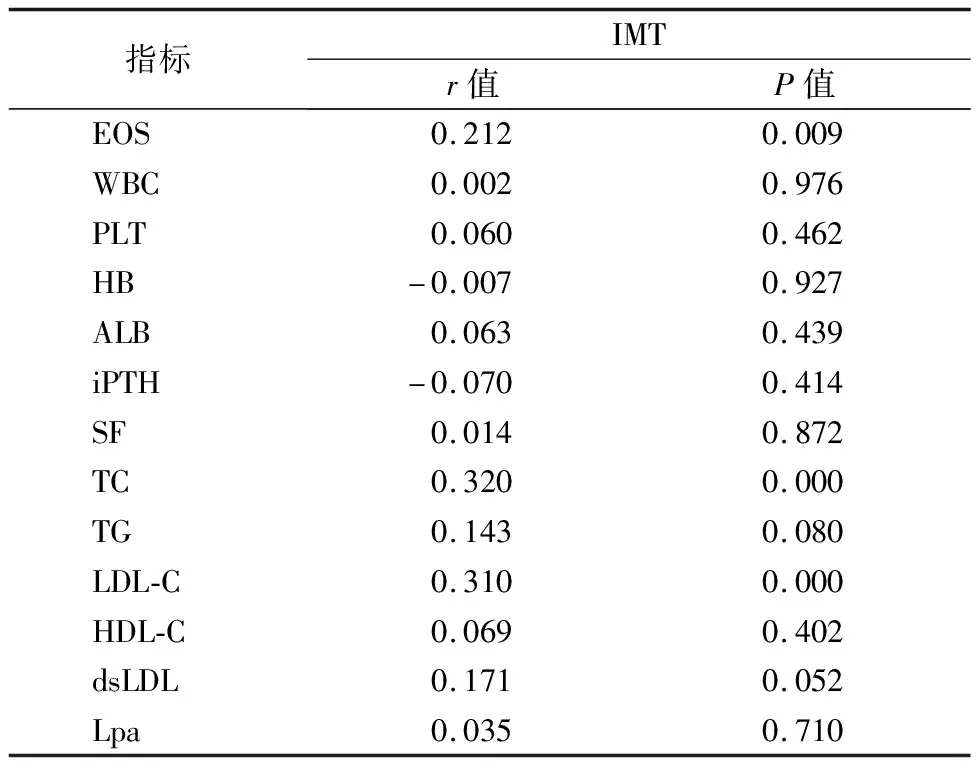
表3 MHD患者IMT与临床资料的相关性分析
2.4影响MHD患者颈动脉硬化的危险因素分析 以是否有颈动脉硬化为因变量,以EOS、TC、LDL-C为自变量进行多元Logistic回归分析,提示TC、LDL-C是影响MHD患者颈动脉硬化的独立危险因素(P<0.05)。见表4。
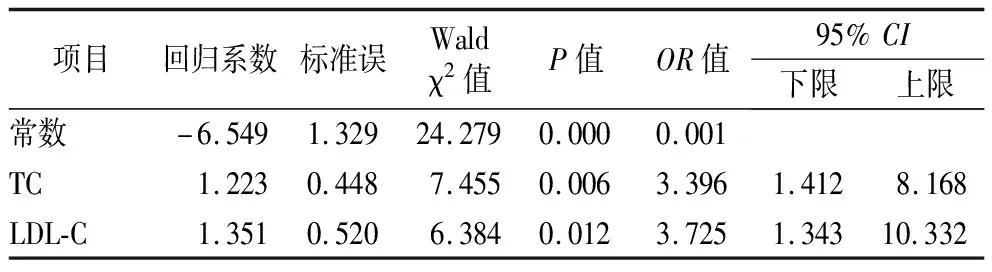
表4 影响MHD患者颈动脉硬化的危险因素分析
3 讨 论
研究发现,在CKD患者中,EOS计数与肾小球滤过率呈负相关, EOS增多大都集中在CKD4期与5期[10]。一般来说,外源性抗原均可引起超敏反应, 抗原激活Th2细胞和关键细胞因子引起的超敏反应是EOS增多的特征之一[11]。MHD患者由于血液直接接触透析器及管路这些外源性物质,引起EOS稳态和亚临床超敏反应的改变,从而增加了MHD患者的EOS水平。此外,由于EOS还有促炎和促氧化作用,所以EOS升高可能对MHD患者有害。研究表明,在透析开始后的前3个月,EOS的降低和升高均与MHD患者的全因死亡率较高有关[8]。
本研究显示,151例MHD患者,96例伴有颈动脉硬化,硬化组EOS水平高于对照组;进一步分析发现,颈动脉粥样硬化的检出率有随着EOS水平的升高而增多的趋势,颈动脉IMT与EOS呈正相关,这表明EOS对MHD患者颈动脉粥样硬化有重要意义。动脉粥样硬化的本质是一种慢性炎症过程,炎症几乎参与了动脉粥样硬化形成、发展、斑块破裂的全过程[12]。正常情况下,炎症细胞并不能黏附在动脉内膜,因为光滑的动脉内壁有完善的保护机制,当存在高血压、高血糖、吸烟、肥胖等危险因素时,促炎因子、脂蛋白等一些物质释放,使内皮功能紊乱,促进白细胞及其亚群与内皮细胞表达的黏附因子结合,并不断的摄取脂蛋白,形成泡沫细胞,参与动脉粥样硬化的形成[15]。有前瞻性研究表明,EOS与动脉粥样硬化的发病有关,其主要作用机制就是促进炎症反应。EOS主要参与过敏性炎症反应,而过敏性炎症介质在血管粥样硬化斑块形成与进展中发挥重要作用[13]。因为EOS在过敏性炎症反应中能释放大量细胞毒性物质,这些物质产生活性氧,诱导内皮细胞的损伤,同时促进成纤维细胞胶原释放和血小板活化,导致动脉硬化[14]。有研究发现,EOS在活化状态下,还能释放干扰素α与干扰素β,这两者可以通过调节巨噬细胞的功能来促进泡沫细胞的形成;另一方面,EOS刺激前列腺素D2、白三烯C4和白三烯D4等强效炎症因子生成,引起血管纤维化、钙化和收缩[15]。不仅如此,EOS还可以诱导嗜碱性粒细胞以及肥大细胞释放血管活性物质,增加了血管通透性,使低密度脂蛋白与炎症细胞更容易进入血管内膜导致血管硬化,同时,外周血EOS也在趋化因子的作用下到达内皮细胞指定位置,参与形成粥样斑块[16]。研究显示,与无血管问题的患者相比,患有血管并发症,例如伴心脏或周围血管疾病和血管通路血栓的患者的EOS更高,这表明EOS可能是患有血管疾病的标志物[17-19]。研究发现,EOS可能还与急性心肌梗死的发生有关,活化的EOS通过释放过氧化物酶产物在内皮细胞中诱导了促炎和血栓形成,并释放颗粒蛋白来激活凝血因子,加速血栓形成,而血栓形成是引起急性心肌梗死的常见机制[20]。Sakai等[21]曾对165例急性心肌梗死的患者的血栓进行病理学检测,发现有106例患者血栓内有EOS浸润,红色血栓越大,EOS浸润就越多,这表明EOS参与了血栓形成。
hs-CRP是颈动脉粥样硬化的致病因素,也是判定MHD患者存在微炎症状态的指标[9]。本研究显示,硬化组hs-CRP>3.4 mg/L的患者比例较对照组多,TC、LDL-C、dsLDL水平均高于对照组,颈动脉IMT与TC、LDL-C水平呈正相关,这表明,对于MHD患者来说,高脂血症仍然是其发生颈动脉硬化的危险因素,硬化组中微炎症状态的发生较对照组更为普遍。进一步通过EOS分组发现,伴较高水平EOS的MHD患者微炎症状态检出率更高。这表明EOS是通过加重MHD患者的炎症状态来促进颈动脉粥样硬化。潘金林等[22]研究发现WBC升高可导致颈动脉粥样硬化和股动脉硬化斑块的发生概率上升。作为外周白细胞的亚群,除了EOS,淋巴细胞及单核细胞也参与了动脉粥样硬化的发展[23]。由此可见,MHD患者的炎症状态与EOS在致颈动脉粥样硬化方面起着协同作用。一方面,WBC、CRP这些炎症指标与EOS同时参与颈动脉粥样硬化的发展;另一方面,WBC与CRP又增加了MHD患者机体EOS数量,进一步加速了颈动脉粥样硬化的进程。但Ortega等[24]在对高脂血症无肾脏疾病的患者的研究中发现,CRP与颈动脉粥样硬化无明显相关性,提示CRP在肾病患者与非肾病患者患者中的作用存在差异,需要进一步研究证实。
尽管EOS升高与MHD患者颈动脉粥样硬化有关,但并不意味其越低越好。Kang等[8]研究发现,EOS可能在维持免疫能力方面起保护作用,而较低的EOS可能提示MHD患者存在亚临床感染或免疫功能不佳。最近有研究证实EOS也能在维持血管健康方面发挥作用,主要机制为EOS在静止状态下能通过脉管周围脂肪组织上的一氧化氮来维持脉管系统的抗收缩特性,而在缺乏EOS的情况下丧失了这种特性[25]。
综上所述,EOS与MHD患者颈动脉硬化的发生以及微炎症状态的维持相关。对EOS偏高的MHD患者进行颈动脉超声检查能及时发现颈动脉粥样硬化。及时识别并处理因亚临床超敏反应导致的EOS升高,并通过药物干预控制血脂、改善营养状态、控制微炎症状态,均有助于延缓颈动脉硬化进展,改善MHD患者的预后。本研究为单中心回顾性研究,样本量较少,结果有所局限。EOS检查在MHD患者中是常规检查,需要进一步进行多中心,前瞻性研究,来分析EOS是否为颈动脉硬化的独立危险因素。

