解密病毒
邹欢

[摘 要]文章根据病毒的发现和研究史,总结归纳出无囊膜病毒和囊膜病毒的结构与特点,最后重点解读新冠病毒的研究过程和结构特点。
[关键词]无囊膜病毒;囊膜病毒;新冠病毒
[中图分类号] G633.91 [文献标识码] A [文章编号] 1674-6058(2021)26-0095-02
人类的发展史,是一部和各种瘟疫斗争的生存史。从引发鼠疫、霍乱、结核病、伤寒等瘟疫的细菌,到引发天花、流感、麻疹、艾滋病等大流行病的病毒,人类在一步步地研究瘟疫的真相,揪出瘟疫背后的真凶。回顾过去短短20年,全球便经历了SARS、MERS、非洲猪瘟、埃博拉、寨卡病毒、新冠病毒等多种新型囊膜病毒所引发的疫情。这些病毒的出现,不仅给全球人类健康带来巨大危险,给全球经济造成巨大损失,还在一定程度上改变人们的生活方式。这些经历,让我们对大自然始终保持敬畏,也对囊膜病毒本身产生了极大的好奇。
无囊膜病毒与囊膜病毒的区别是什么?囊膜病毒的组装有哪些类型?囊膜病毒的结构是什么样的?2020年诺贝尔生理学或医学奖颁给了三位与丙肝病毒的发现有关的科学家。这次疫情,也将全球目光再一次聚焦到冠状病毒所属的囊膜病毒上,作为一名高中生物教师,有必要把握生物科技前沿,为新授课乃至高三复习提供教学素材和命题思路。
一、无囊膜病毒
无囊膜病毒(Nonenveloped virus)没有囊膜,直接由蛋白质外壳包裹核酸。这类病毒的范畴比较广,从动物病毒、噬菌体到水生病毒等都有。对人类健康及经济生产威胁较大的有同属微小病毒科的脊髓灰质炎病毒、肠道病毒及口蹄疫病毒等。
在結构上,大多数无囊膜病毒就像一个模子刻出来的一样。呈正二十面体组装的病毒是它们的代表[1]。这些直径为100 nm左右的超大分子复合物(如图1),由于高度的对称性、结构的全同性及尺寸恰好在电子显微镜的透射范围内等,是冷冻电镜(cryo-Electron Tomography,cryo-ET)方法开发历程中的三大标准生物样品之一。
目前使用冷冻电镜解析常规尺寸的正二十面体病毒的方法非常成熟:由于其表面拷贝数非常高的衣壳蛋白以严格的对称性分布,无须大量数据便可通过三维图像重构获得近原子分辨率。这个经典应用也为探索更复杂的病原体(包括大量非球形或非对称性的病毒体)提供了坚实的基础。
二、囊膜病毒
囊膜病毒多是动物病毒,它们可以说是现代人类面临的最具威胁性的病原体。囊膜病毒的大家庭里,既有“历史悠久”的,如天花、流感、乙肝、丙肝、麻疹、艾滋病、登革病毒、狂犬病毒等,也有近些年的“新起之秀”,如新冠病毒、拉沙热病毒、埃博拉病毒、寨卡病毒、裂谷热病毒等。这些病毒里,除了寨卡病毒和登革病毒具有较为严格的正二十面体对称,其余的结构都千篇一律。
这种随机性结构与囊膜病毒的组装和生命周期特点息息相关。它们由脂双层包裹,借助外镶的刺突状糖蛋白与受体结合并进入细胞。接着,利用Ⅰ、Ⅱ或Ⅲ型膜融合蛋白介导膜融合、解胞并释放核酸,绑架细胞的生命活动实现自我复制,最后组装成新的病毒并从细胞出芽。可见,囊膜病毒通过蛋白介导膜融合,通过膜融合去组装并释放核酸,通过出芽“掳走” 细胞膜以成为新病毒的囊膜。
除了上述的刺突蛋白及脂双层,囊膜病毒一般还有基质蛋白(负责病毒组装)、核蛋白(负责收纳组织核酸),负链RNA病毒的结构蛋白里还有聚合酶。此外,不少囊膜病毒还有通道蛋白,例如新冠病毒、流感病毒等。
由于脂双层参与病毒组装,这类病毒几乎千毒千面,没有两个完全一样的病毒。看清囊膜病毒的全病毒分子结构,其蛋白的分布及构象转变,甚至是宿主体内的病毒半组装结构,对我们理解囊膜病毒如何攻下细胞这座城堡至关重要。由于囊膜病毒的结构多样,很难通过传统结构生物学方法来解析,因此全病毒结构及其在生命周期中重要状态的高分辨结构,一直是结构生物学的挑战。使用冷冻电镜断层成像方法拍摄样品的三维图像,并结合子断层图像平均法(STA)对病毒上的蛋白子断层图像进行对齐平均运算,再通过投射回三维空间的手段,为解析囊膜病毒全病毒结构及细胞内的病毒结构带来可能。
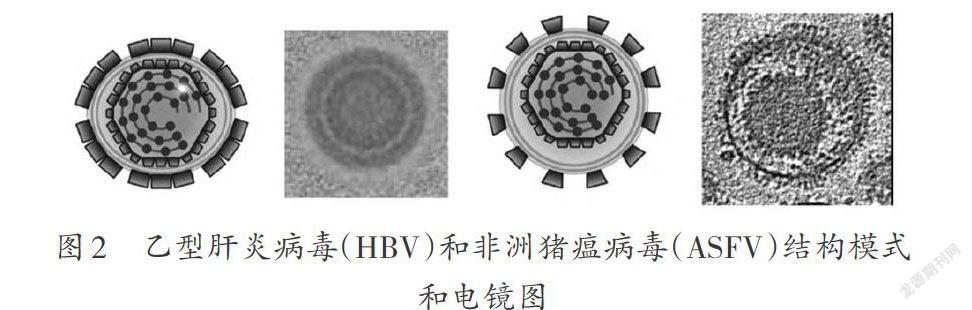
具有二十面体外壳和脂双层膜的一类病毒结构,是最早被解析出来的。引起发病率和死亡率很高的登革出血热和登革休克综合征的登革热病毒(DENV,黄病毒科),于2002年被美国普渡大学 Richard J Kuhn 等人确定了24 Å分辨率的结构[2]。另一类病毒的外囊膜包被着一层或多层二十面体对称蛋白或核衣壳:包括乙型肝炎病毒HBV[3]、疱疹病毒科(如HSV-1),以及2019年饶子和团队解析的非洲猪瘟病毒ASFV[4](如图 2)。
三、新冠病毒
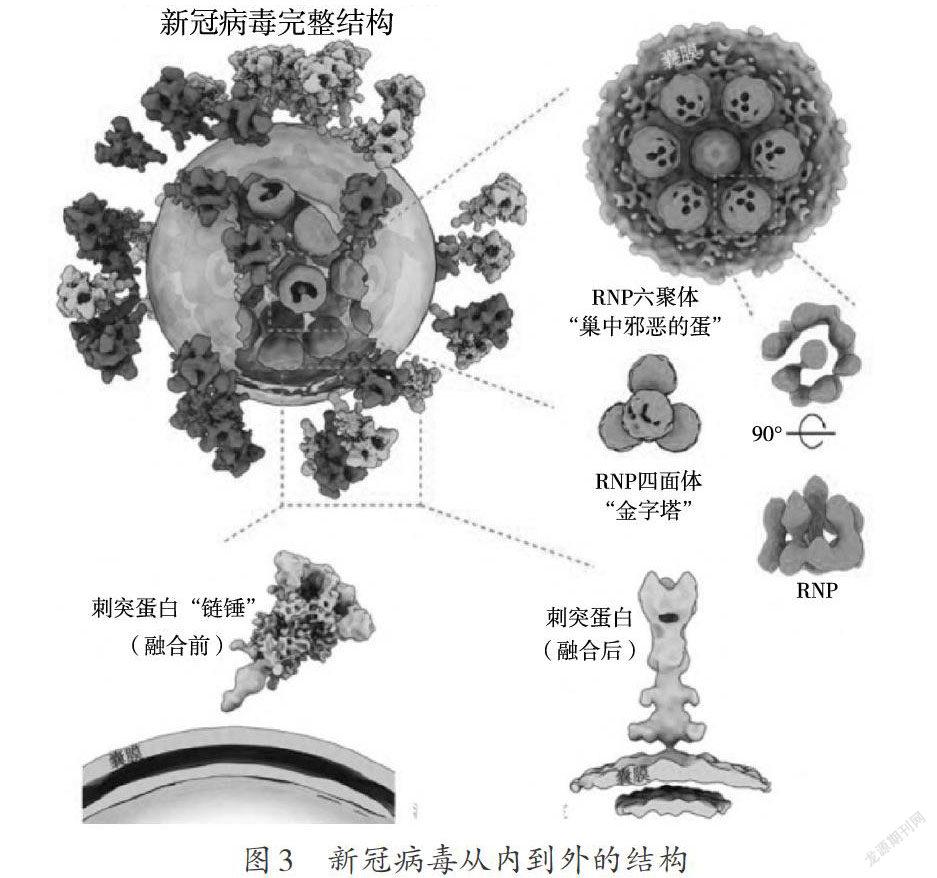
今年肆虐全球的新冠病毒,最先由清华大学团队使用 cryo-ET,将浙江大学李兰娟团队提供的灭活病毒解析至最高7.8Å分辨率,并重构出一颗有代表性的新冠病毒全病毒分子结构 [5]。研究结果不仅展示了病毒表面刺突蛋白(spike)的结构、分布及其糖基化组分,还挺进 “深核”,解析出病毒腔内的核糖核蛋白(RNP)的结构与排列规律,为其超长基因组在病毒体内的分布提供了高分辨率信息,绘制了独一无二的新冠病毒全身 “通缉照”(如图3)。
冠状病毒本身非常有特点,拥有多个囊膜病毒之最:已知最大的糖蛋白(三聚体分子量超过600 kD),RNA病毒中最长的RNA(30 kb)。新冠病毒糖蛋白拷贝数稀少(约30个);在囊膜表面拥有极大的自由,可绕茎部旋转甚至可在囊膜上游走;非常脆弱,部分亚基甚至整根糖蛋白会发生脱落。通过对来自天然S蛋白的N-聚糖组成进行质谱分析,发现虽然天然聚糖较为复杂,但整体而言与重组糖蛋白聚糖的加工状态高度相似。
冠状病毒RNA直线长度可达病毒自身直径的100倍。把这根核酸“长绳”完整有序地缠绕进仅有约80 nm直径的腔体内的重任主要落在核蛋白上。它需要像线轴一样收纳RNA,将其有序缠绕,并组装成称为核糖核蛋白复合物(RNP)的高级结构。清华大学团队对病毒内近20 000颗RNP进行了挑选和分析,得到了病毒腔内13Å分辨率的RNP结构密度图,并开创性地展示了RNP在病毒腔内的组装机制。成像显示:该复合物像串珠一样将RNA组织在一起,并在病毒体内呈现六聚 “鸟巢” 形和正四面体 “金字塔” 形两种局部排列,有序地收纳了RNA这根“长绳”,还增加了病毒在复杂环境中经受物理挑战的能力。这可能是世界范围内首次 “看清” 正义单链RNA病毒的内部结构(如图3)。
囊膜病毒在人类发展史上造成过多次大流行灾难,是对现代人类健康最具威胁的病原体。研究囊膜病毒的天然结构,对于我们真正了解病毒,发现它们的弱点至关重要。而因为脂双层参与组装,囊膜病毒柔性极大,形态不定,完整病毒的结构解析为结构生物学带来巨大的挑战。冷冻电镜断层成像是揭示囊膜病毒全貌图的最佳方案,虽然目前分辨率还停留在1~2纳米,但该方法的开发突飞猛进,常规获得近原子分辨率仅是时间问题。对囊膜病毒的研究,正从体外结构的传统方向,大步迈向从细胞中直接观测病毒生命活动的原位结构方向。
[ 参 考 文 献 ]
[1] ZHANG X,JIN L,FANG Q,et al. A cryo-EM structure of a nonenveloped virus reveals a priming mechanism for cell entry[J]. Cell,2010(2):472-482.
[2] KUHN R J,ZHANG W,ROSSMANN M G,et al. Structure of dengue virus:implications for flavivirus organization,maturation,and fusion[J].Cell,2002(5):717-725.
[3] DRYDEN K A,WIELAND S F,WHITTENBAUER C,et al. Native hepatitis B virions and capsids visualized by electron cryomicroscopy[J].Molecular cell,2006(6):843-850.
[4] WANG N,ZHAO D M,WANG J L,et al.Architecture of African swine fever virus and implications for viral assembly[J]. Science,2019(6465):640-644.
[5] Yao H P,SONG Y T,CHEN Y,et al.Molecular architecture of the SARS-CoV-2 virus[J].Cell,2020(3):730-738.
(責任编辑 黄春香)

