柴枳夏及汤对胆汁反流性胃炎大鼠血清及血浆中胃动素、血管活性肠肽、生长抑素表达的影响
冀渤海,梁靓靓
(中国医科大学附属盛京医院中医科,辽宁 沈阳 110004)
胆汁反流性胃炎(Bile reflux gastritis,BRG),是一种由多种原因引起的胃部黏膜损伤性疾病,常表现为频繁异常的十二指肠胃反流(Duodenogastric reflux,DGR)[1]。DGR是机体进行自我调节的一种正常生理反应,幽门括约肌的功能和胃十二指肠动力在很大程度上影响DGR的发生和反流量的多少[2]。如果幽门括约肌本身存在缺陷,或者受到各种刺激时,会导致其出现功能异常,表现为幽门关闭不全。如果此时胃十二指肠动力也出现异常,具体表现为逆向蠕动增加和胃窦清除能力下降时,便会出现DGR频繁异常的现象。从十二指肠反流回胃的物质过多并与胃黏膜接触时间过长,则会对胃黏膜造成损伤。慢性十二指肠胃反流会持续损伤胃黏膜,最终导致胃黏膜出现各种炎症、糜烂,甚至恶化为胃溃疡[3-4]。
在对BRG的临床治疗中,西医方法较多但效果并不显著,而且治疗后的病人常呈现较高的复发率。关于BRG,中医的观点认为其内在原因是脾胃虚弱,其重要发病机制则是胆气上逆[5]。中医对BRG的治疗侧重于健脾养胃以及疏肝利胆。作为吾师拟定的经验方,柴枳夏及汤在治疗胆汁反流性胃炎中效果明显,BRG患者胃痛胃胀、烧心反酸的症状有明显好转,而且能够缓解口苦、嗳气的情况。为了对柴枳夏及汤的治疗效果进行深入验证,探究该方在治疗BRG时的医学原理,本文构建了BRG大鼠模型,对柴枳夏及汤对大鼠胃肠动力的作用进行研究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:Wistar大鼠(SPF级)均为辽宁长生生物技术有限公司繁殖,共50只,均为雄性,体重180~220 g,大鼠的实验动物生产许可证号:SYXK(辽)2017-0004。大鼠购买后饲养于SPF动物房中,动物房温度设置为(25±2)℃,温度、湿度恒定不变,光周期设置为12 h光照/12 h黑暗,大鼠进食饮水不予干预。
1.1.2 药物及主要试剂:柴枳夏及汤配方,柴胡(批号:18013491)、半夏(批号:18015383)各12 g,炒枳实(批号:18010061)、陈皮(批号:18016601)、鸡内金(批号:18023491)各15 g,白芍(批号:18018131)20 g,白及(批号:18012961)、香附(批号:18008831)、干姜(批号:18011161)、炒白术(批号:18014021)各10 g,黄连(批号:18022162)、炙甘草(批号:18004461)各6 g,以上中药均为配方颗粒剂,北京康人堂药业有限公司生产,于中国医科大学附属盛京医院药房购买;达喜片(铝碳酸镁片,批号:JS09864);枸橼酸莫沙必利分散片(快力片,国药准字H19990317);牛黄胆酸钠、葡聚糖蓝2000(北京索莱宝生物科技有限公司);卵磷脂、胰蛋白酶(上海源叶生物科技有限公司);大鼠胃动素、血管活性肠肽、生长抑素 ELISA试剂盒(上海酶联生物科技有限公司)。
1.1.3 主要仪器:台式低温高速离心机(FRESCO 21型,Thermo Scientific Forma);多功能酶标仪(Synergy H1/H1MFDG型,BioTek);超声匀浆机(VCX 130 型,SONICS & MATERIALS INC,USA);电热恒温培养箱(DNP-9162型,上海精宏);电子天平(BSA223S型,Sartorius)以及TUS-200型恒温金属浴(上海蓝豹试验设备公司);TS-100型水平摇床(海门市其林贝尔公司);HJ-3型磁力搅拌器(上海龙跃仪器设备有限公司);E100型生物显微镜(Nikon公司);NW30VF型纯水机(上海康雷分析仪器有限公司)。
1.2 实验方法
1.2.1 试剂配制:反流液配制方法:取蒸馏水100 ml,将卵磷脂250 mg、胰蛋白酶1.5 g和牛胆酸钠2.5 g溶于其中,不断搅拌至充分溶解,将反流液灌胃于大鼠。大鼠用柴枳夏及汤配制方法:根据人与大鼠体表面积法换算,按成人柴枳夏及汤用量的6.3倍和12.6倍分别配制柴枳夏及汤低剂量药液和高剂量药液,按照生药量12.77、25.54 g/kg分别灌胃不同处理组大鼠。西药液配制方法:按照大鼠用药量达喜片0.27 g/kg,枸橼酸莫沙比利分散片0.00125 g/kg灌胃给予西药组大鼠。以上溶液即配即用,溶剂均为蒸馏水。
1.2.2 模型制备:各组大鼠每5天称重1次。模型组、柴枳夏及汤低、高剂量组及西药组按照10 ml/kg用量,将反流液灌于大鼠胃中,制造BRG大鼠模型,每天灌胃1次,连续灌胃49 d。空白组以蒸馏水灌胃。
1.2.3 实验分组、给药及取材:按照大鼠的个体重量,通过随机数字表法将50只大鼠随机分为西药组、柴枳夏及汤低剂量组、柴枳夏及汤高剂量组以及空白组和模型组五个组。在BRG大鼠模型建立后第8天开始,分别给西药组和柴枳夏及汤低剂量组及高剂量组大鼠用药,每天造模6 h后进行药液灌胃,给药至第49天。最后一次用药完毕后,继续饲养24 h,期间禁止大鼠进食,不禁止饮水。24 h后,按3 ml/kg用药量向大鼠腹腔中注射10%水合氯醛使大鼠麻醉,之后开腹并采集腹主动脉血液,收集血清及血浆,10 ml注射器腹主动脉取血每只6 ml,其中3 ml放入抗凝管,室温放置待血液凝固,凝固20 min后,离心机3500 r/min离心20 min,吸取100 μl上清液,分装至离心管中后于超低温冰箱保存备用,使用时冰浴融化并在2~8 ℃环境中放置。将大鼠全胃摘下,PBS磷酸盐缓冲液漂洗鼠胃后用滤纸将血液吸干,之后沿胃大弯侧用解剖剪将鼠胃剪开,肉眼观察胃黏膜。
1.2.4 实验观察
1.2.4.1 造模情况观察:①一般状态观察:观察空白组及模型组大鼠皮肤毛发、进食状态、兴奋程度、睡眠状态、大便状态和激怒反应等一般状态的变化。体毛光滑浓密为优,干枯打结无光泽为差;能正常饮食水且每日食量均一为优,饮食水困难且每日饥饱不一为差;见人或听到响动兴奋为优,反应迟钝为差;睡眠正常为优,易惊醒为差;排正常成型便为优,排便稀糊为差;情绪稳定为优,易激惹为差。用符号表示一般行为状态的优劣程度,“--”代表程度最差,“-”表示程度较差,“+”表示程度较好,“”表示程度最好。②体重比较:比较空白组及模型组大鼠造模前后体重的变化。③肉眼观察胃黏膜组织:取材后,肉眼观察空白组及模型组大鼠胃黏膜表面颜色、光滑程度、有无充血糜烂及有无胆汁和黏液附着。
1.2.4.2 胃肠动力指标观察:①胃排空率:选取全胃,用剪刀沿着胃大弯剪开,将其中内容物取出,并将内容物溶到4 ml蒸馏水中,后置于离心机中离心10 min,离心机转速设置为3000 r/min,将离心后的上清液取出,置于酶标仪上测定620 nm处的吸光度值。取另一只装有4 ml蒸馏水的试管,加入0.4 ml相同浓度的葡聚糖蓝2000溶液,同样在3000 r/min下离心10 min,吸取上清液测量620 nm处的吸光度值,该试管为试验的标准管。胃排空率的计算公式为:(1-胃内残留色素吸光度值/标准管色素吸光度值)×100%。②小肠推进率:在完成实验后,快速将幽门括约肌到结肠末端的全肠放置到用生理盐水浸泡湿润的锡箔纸上,轻轻将其剥离开来,在不使用任何外力的情况下将其平铺于锡箔纸上,然后快速测量小肠幽门括约肌处到葡聚糖蓝2000推进前端的距离,此外,还要测量幽门括约肌处至结肠末端的全肠距离。小肠推进率的计算公式为:肠内推进距离(cm)/全肠长度(cm)×100%。
1.2.4.3 大鼠血清及血浆中胃动素(MTL)含量的测定:根据试验所使用试剂盒的说明书来测定大鼠血清和血浆中的MTL含量,采用ELISA方法进行。简要步骤:①标准品加样:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μl;②加样:分别设空白孔和待测样品孔。在酶标包被板上待测样品孔中加入40 μl样品稀释液,然后加入10 μl待测样品;③加酶:除空白孔外每孔加入酶标试剂100 μl;④温育:利用封板模将酶标包被板封板后,放置到37 ℃恒温培养箱中培育1 h;⑤配液:将20倍的浓缩洗涤液稀释至1倍浓度后备用,稀释时加入的溶剂为蒸馏水;⑥洗涤:将封板模揭去,倒掉液体并甩干,将洗涤液加满至每个孔中,静置反应30 s后倒掉,如此重复5次后拍干;⑦显色:每孔中先后加入50 μl显色剂A和50 μl显色剂B,之后轻轻晃动混匀,置于37 ℃恒温培养箱中,避光条件下显色15 min;⑧终止:每孔中加入50 μl显色终止剂;⑨测定:用空白孔将仪器调零,按照次序分别测定孔中的OD450nm值。
1.2.4.4 大鼠血清及血浆中血管活性肠肽(VIP)含量的测定:根据试剂盒的说明来测定大鼠血清和血浆中VIP的含量,采用的是ELISA方法。具体步骤同上。
1.2.4.5 大鼠血清及血浆中生长抑素(SS)含量的测定:根据试剂盒的说明来测定大鼠血清和血浆中SS的含量,采用的是ELISA方法。测定方法同上。

2 结 果
2.1 造模情况
2.1.1 一般情况观察:实验过程中,空白组大鼠体毛光滑浓密,正常饮食水,体重增长较快,反应灵敏,睡眠正常,排正常成型便,情绪稳定。模型组大鼠逐渐出现体毛干枯无光泽,食量减少,消瘦,反应迟钝,易惊醒,排稀糊便,甚至便中含红黄色黏液,易激惹。与空白组比较,造模后模型组一般情况明显变差。
2.1.2 体重比较:见表1。空白组大鼠体重增长较快,造模后模型组大鼠体重增长速度明显缓慢,两组比较差异有统计学意义(P<0.05)。

表1 空白组与模型组体重变化情况(g)
2.1.3 肉眼观察胃黏膜组织:空白组大鼠的胃黏膜表面未发生充血和糜烂状况,呈现光滑状态,颜色呈现淡红色;模型组大鼠的胃黏膜出现了明显充血,在胃窦部可看到点状或片状糜烂,在胃壁上粘有黄绿色胆汁,同时也有很多泡沫样黄色黏液,这种情况在胃窦部的发生更为严重。以上结果综合说明了造模的成功性。
2.2 柴枳夏及汤对胆汁反流性胃炎大鼠胃排空及肠推进的影响 见表2。计算模型组和空白组大鼠的胃排空率及小肠推进率后发现,模型组的数据结果均明显低于空白组(P<0.01);柴枳夏及汤低剂量组大鼠的胃排空率及小肠推进率亦降低(P<0.05);柴枳夏及汤高剂量组及西药组大鼠的胃排空率较空白组有所升高,但差异无统计学意义(P>0.05);柴枳夏及汤高剂量组及西药组大鼠的小肠推进率与空白组比较差异无统计学意义(P>0.05)。与模型组比较,柴枳夏及汤低剂量组的胃排空率及小肠推进率有所升高,但差异无统计学意义(P>0.05);柴枳夏及汤高剂量组和西药组的胃排空率升高显著(P<0.01);柴枳夏及汤高剂量组和西药组的小肠推进率较模型组有所提升,差异有统计学意义(P<0.05)。
三组用药组比较,柴枳夏及汤高剂量组及西药组大鼠的胃排空率较柴枳夏及汤低剂量组升高,差异均有统计学意义(P<0.05);柴枳夏及汤高剂量组及西药组的小肠推进率较柴枳夏及汤低剂量组亦有所提升,与其相比,柴枳夏及汤高剂量组差异有统计学意义(P<0.05),西药组差异无统计学意义(P>0.05);柴枳夏及汤高剂量组大鼠的胃排空率和小肠推进率均优于西药组,但差异无统计学意义(P>0.05)。
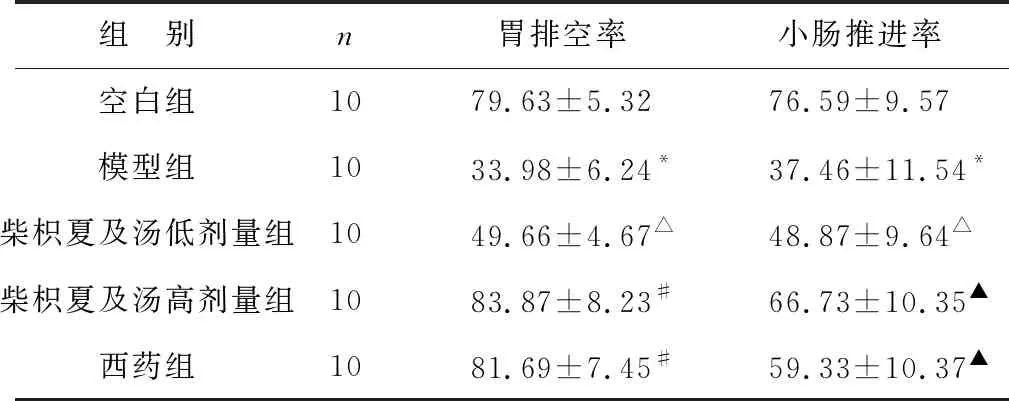
表2 各组大鼠胃排空率、小肠推进率比较(%)
2.3 柴枳夏及汤对胆汁反流性胃炎大鼠胃动素(MTL)的影响 见表3。根据模型组、空白组大鼠的血清及血浆中胃动素含量的测定结果可知,前者模型组的测定结果要明显低于后者空白组,二者之间差异有统计学意义(P<0.01);柴枳夏及汤低剂量组的大鼠血清及血浆胃动素含量有所降低(P<0.05);柴枳夏及汤高剂量组与西药组大鼠血清及血浆胃动素含量较空白组差异无统计学意义(P>0.05)。
与模型组比较,柴枳夏及汤低剂量组大鼠血清及血浆胃动素含量有所升高(P<0.05);柴枳夏及汤高剂量组与西药组大鼠血清及血浆胃动素含量升高显著(P<0.01)。
三组用药组比较,柴枳夏及汤高剂量组与西药组大鼠血清及血浆中胃动素含量均高于柴枳夏及汤低剂量组,差异有统计学意义(P<0.05);柴枳夏及汤高剂量组与西药组比较,柴枳夏及汤高剂量组大鼠血清及血浆中胃动素含量更高,其中血清差异比较无统计学意义(P>0.05),血浆差异比较有统计学意义(P<0.05)。
2.4 柴枳夏及汤对胆汁反流性胃炎大鼠血管活性肠肽(VIP)的影响 见表4。计算出模型组和空白组大鼠的血清及血浆中VIP含量后发现,前者模型组的含量比后者空白组高,且差异具有统计学意义(P<0.01);柴枳夏及汤低剂量组的大鼠血清及血浆VIP含量较空白组有所升高(P<0.05);柴枳夏及汤高剂量组与西药组大鼠血清及血浆VIP含量较空白组有统计学差异(P<0.05)。
与模型组比较,柴枳夏及汤低剂量组大鼠血清及血浆VIP含量有所降低,但变化不明显(P>0.05);柴枳夏及汤高剂量组与西药组大鼠血清及血浆VIP含量较模型组显著降低(P<0.01)。
三组用药组比较,柴枳夏及汤高剂量组与西药组大鼠血清及血浆中VIP含量均低于柴枳夏及汤低剂量组,差异有统计学意义(P<0.05);柴枳夏及汤高剂量组与西药组比较,柴枳夏及汤高剂量组大鼠血清及血浆中VIP含量更低,差异无统计学意义(P>0.05)。
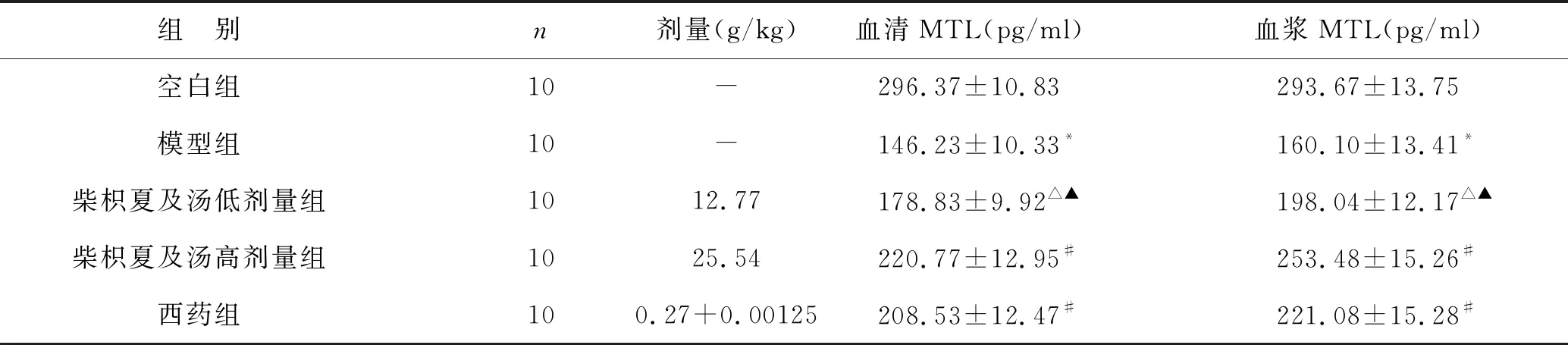
表3 各组大鼠胃动素(MTL)含量比较
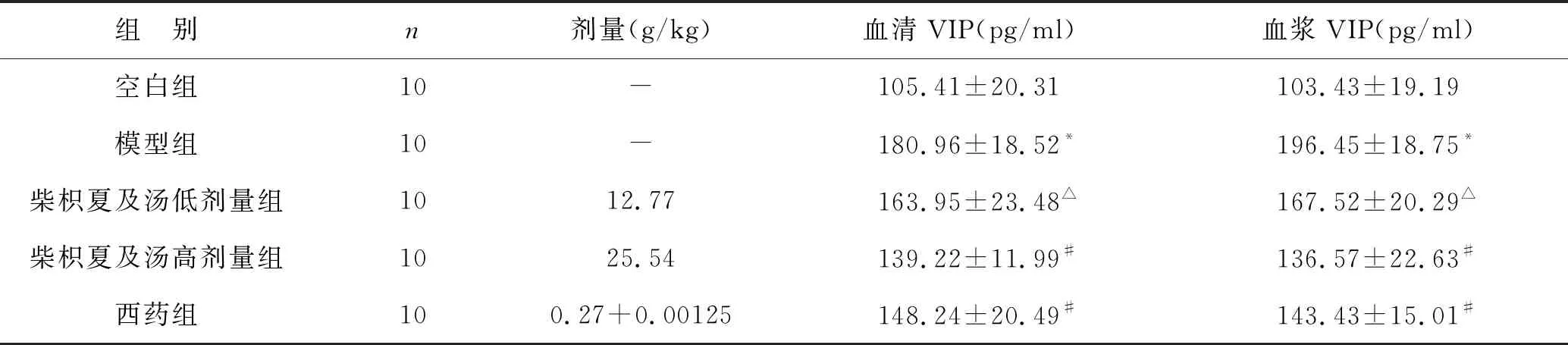
表5 各组大鼠血管活性肠肽(VIP)含量比较
2.5 柴枳夏及汤对胆汁反流性胃炎大鼠生长抑素(SS)的影响 见表5。与空白组比较,模型组大鼠血清及血浆SS含量均显著升高,差异明显(P<0.01);柴枳夏及汤低剂量组大鼠血清及血浆SS含量较空白组有所升高(P<0.05);柴枳夏及汤高剂量组大鼠血清及血浆SS含量较空白组无明显改变(P>0.05);西药组大鼠血浆SS含量与空白组比较有统计学差异(P<0.05)。与模型组比较,柴枳夏及汤低剂量组大鼠血清及血浆SS含量有所降低,但差异无统计学意义(P>0.05);柴枳夏及汤高剂量组大鼠血清及血浆SS含量较模型组显著降低(P<0.01);西药组大鼠血清及血浆SS含量有所降低(P<0.05)。三组用药组比较,柴枳夏及汤高剂量组与西药组大鼠血清及血浆中SS含量均低于柴枳夏及汤低剂量组,与其相比,柴枳夏及汤高剂量组差异有统计学意义(P<0.05),西药组差异无统计学意义(P>0.05);柴枳夏及汤高剂量组与西药组比较,柴枳夏及汤高剂量组大鼠血清及血浆中SS含量更低,其中血清的差异无统计学意义(P>0.05),血浆的差异有统计学意义(P<0.05)。
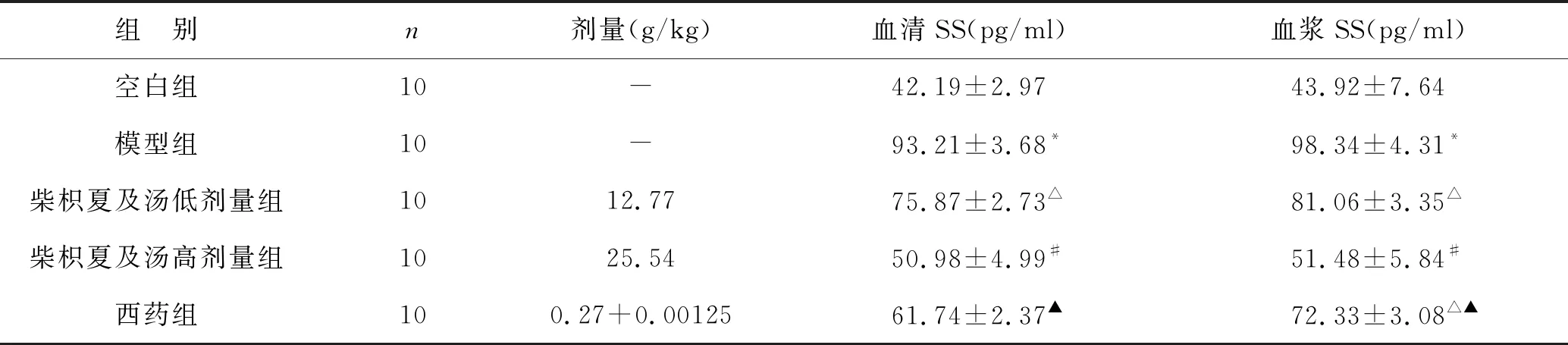
表5 各组大鼠生长抑素(SS)含量比较
3 讨 论
在消化系统发生的疾病类型中,胆汁反流性胃炎是较为常见的一种,当十二指肠内容物反流到胃部时,如果不能及时得到有效的清除,会造成胃黏膜的损伤,并产生炎性反应[6]。增加胆汁反流发生的可能性因素较多,主要是胃十二指肠运动功能异常,包括十二指肠逆行蠕动增加、幽门功能下降、胃窦清除能力降低等,这些因素一方面引起十二指肠胃反流,另一方面使胃排空发生延迟,增加胆汁与胃黏膜的接触时间,加重胃黏膜损伤[7-9]。
胃肠道的运动有助于消化系统行使其生理功能,并且是消化道生理功能重要的组成部分,在医学临床病例中,因胃肠道运动方面的功能受阻所发生的疾病很多,胆汁反流性胃炎就在其中,其主要病理生理基础为胃排空延迟及肠蠕动减缓[10],表现为胃排空率和小肠推进率的下降,增强胃肠动力有助于治疗胆汁反流性胃炎。
机体在调节胃肠动力的过程中,胃肠激素是一种有效的方式。对十二指肠胃反流起促进作用的有生长抑素、血管活性肠肽、促胰液素、神经紧张素等,起抑制作用的主要有胃泌素、胃动素、蛙皮素和P物质[11]。胃动素、血管活性肠肽和生长抑素都是机体中发挥关键作用的胃肠道激素,它们主要在胃肠组织中起作用,通过各部分的相互影响和协同作用来行使功能,即胃肠道的运动和分泌功能[12]。因此,我们通过检测胆汁反流性胃炎大鼠血清与血浆中MTL、VIP和SS的含量,观察柴枳夏及汤对胃肠激素的调节作用。
MTL是胃肠黏膜中分泌的多肽物质,在启动胃肠收缩运动中起到关键作用,是一种脑肠肽。MTL对平滑肌的肌电活动和胃肠道的自主运动具有兴奋作用,有助于增强胃肠道的张力和收缩力,有效加快胃肠运动,促进胃排空的进行,人们称之为“清道夫”[13]。VIP是肠神经系统中的一类肽能神经递质,具有抑制作用,会使食管下括约肌松弛,而食管下括约肌的压力越低,血浆中的VIP含量越高,二者呈负相关关系,VIP神经元的数量增加或者功能增强后,会使食管下括约肌在行使其运动功能时受到阻碍[14]。SS主要存在于胃肠道黏膜的D细胞中,且含量很高,其中胃体和胃窦部的含量最高,在肠中,位置越靠下,SS的含量越低,SS对于胃肠激素的释放具有一定的抑制作用,可抑制胃泌素、胃动素、胰高血糖素等的释放,同时也抑制胃酸、胃蛋白酶、唾液淀粉酶等的分泌。
在中医学中,胆汁反流性胃炎属于“呕胆”“吐酸”“痞证”“嘈杂”“胃脘痛”的范畴。在近现代医学专家对胆汁反流性胃炎的认知中,基本与古代医家相同,大部分都认为是“本虚标实”之证,所以应该通过康健脾胃来根治“本”、通过疏肝导滞来治其“标”。
柴枳夏及汤一方中的柴胡具有疏肝主升的功能,能够条达肝气并疏郁结,枳实具有理脾主降、下气破结的功效,两味药一升一降可使一身气机畅通,共为该方中的君药;半夏能够降逆止呕,同时散结除痞,黄连性苦寒能够泄热开痞,干姜性辛温能够温中散寒,三味药一同使用,则寒热平调、辛开苦降,共同作为本方的臣药;白芍具有柔肝止痛的功效,能够养血敛阴,可以使柴胡升散但没有耗伤阴血之弊端,香附、陈皮在疏肝解郁的同时也可理气健脾,可共同用为本方佐药;白及有消肿生肌之功效,鸡内金则能消食化积,白术能够健脾益气,炙甘草能够缓急和中,并能实现各味药的调和,这四味共同作为本方的使药。诸药共同使用,既能治标,又能治本,治以疏肝降逆,同时理气和胃,疏导肝气,下降胃气,升降乃复,最终实现胆汁的正常排泄,当气机调畅之后,所有病症便会痊愈。
在前期实验中,已经证实所用造模方法可行并能获得理想的BRG大鼠模型[15],故本实验继续沿用。前期实验证实柴枳夏及汤对BRG大鼠胃黏膜具有保护作用且临床疗效甚佳[15],故本实验继续利用动物模型探讨该方在胃肠动力方面的作用。经研究发现,柴枳夏及汤能够提高胆汁反流性胃炎大鼠MTL含量,能够降低其VIP及SS含量,同时提升胃排空率及小肠推进率,且柴枳夏及汤高剂量组比低剂量组在提升胃动力、加速胃排空、提高小肠推进率、降低SS和VIP含量、提高MTL含量等方面效果更为显著,即疗效与剂量成正比。此外,柴枳夏及汤高剂量组大鼠血浆中的MTL含量高于西药组,SS含量低于西药组,说明高剂量的柴枳夏及汤在血浆中对于MTL和SS含量的调节效果优于西药。
根据以上结果来看,在增强胃肠动力方面,柴枳夏及汤的作用效果显著,作用机制可能与影响MTL、VIP及SS的水平有关。

