冠心病斑块易损性及预后与血小板/淋巴细胞比值及中性粒细胞/淋巴细胞比值相关性研究
杨凯祥,牛玉军
(锦州医科大学附属第一医院放射科,辽宁 锦州 121000)
冠心病(Coronary artery heart disease,CHD)作为一种炎症性进行性疾病,其主要病理改变是血管的硬化[1]。软斑块以纤维帽薄、脂核大、巨噬细胞浸润和心血管形成为特征,与炎症密切相关[2]。有研究发现,作为一种间接的炎性标志物及血管风险生化指标,血小板/淋巴细胞比值(Platelet lymphocyte ratio,PLR)和中性粒细胞/淋巴细胞比值(Neutrophil lymphocyte ratio,NLR)与慢性炎症密切相关[3]。后者增大提示心脏血管管壁硬化加重[4]。本实验分析CHD患者PLR、NLR变化对冠状动脉斑块易损性的影响及评估预后,为发现新的治疗思路提供依据。
1 资料与方法
1.1 一般资料 分析2018年9月至2020年1月本院心内科住院的CHD患者96例,为CHD组。其中男51例,女45例;年龄35~77岁,平均(57.52±10.01)岁。病例纳入标准:①符合《内科学》中CHD的诊断标准,并根据临床症状、实验室检查和心电图结果综合评定确诊;②行冠脉CTA检查显示,血管截面影像判断至少1支冠脉管腔狭窄程度>50%[5](即存在至少一支病变管腔达到中度及以上狭窄);③年龄<80岁;④无精神病病史;⑤未行支架植入术。排除标准:①近期感染;②有免疫系统疾病;③既往肿瘤病史或脑卒中病史;④妊娠期或哺乳期女性;⑤造影剂过敏者;⑥长期慢性炎症及存在脏器功能低下者。对照组选择46例本院同期行冠脉CTA检查结果显示无斑块形成者,收集CTA检查前血生化数据。其中男23例,女23例;年龄25~79岁,平均(56.23±12.44)岁。两组研究对象的基本资料(包括性别构成比、BMI及年龄等)比较,差异无统计学意义(P>0.05)。本实验研究经医院医学伦理委员会批准,且所有病例患者本人和(或)近亲属均签订同意书。
1.2 研究方法
1.2.1 冠脉CTA检查及处理方法:检查前训练患者呼吸,稳定心率,必要时使用镇静药物控制心率平稳。运用东芝Aquilin ONE 640层CT机(日本)行冠脉CTA检查,管电压120 kV,管电流260 mA,重建层厚0.25 mm,应用容积非螺旋扫描,肘前静脉推注造影剂40~60 ml(碘普罗胺,速度4.5~5.5 ml/s),选择最佳R-R时段重建图像,重建层面厚度为0.25 mm,上传工作站,进行后处理二维与三维图像,包括容积再现(Volume rendering,VR),最大密度投影(Maximum intensity projection,MIP)及曲面成像(Curved planner reformation,CPR)等,分析后处理图像并按斑块性质分为稳定组40例、易损组56例。斑块性质判断标准[6]:根据美国通用电气公司斑块分析软件评估斑块性质,将CT值<60 HU的斑块评定为软斑块组,无钙化影;CT值为60~120 HU的斑块为混合斑块组(软斑块与钙化斑块同时存在),斑块中混有钙化影;CT值>120 HU的斑块为钙化斑块组,主要有高密度成分组成。将纯钙化斑块纳入稳定斑块组,其余纳入不稳定斑块组(易损斑块组)。见图1。

A:LAD近段软斑块;B:RCA近段混合斑块;C:LAD近段及中段钙化斑块
1.2.2 生化指标检测:CHD患者入院后及同期对照组体检时进行血细胞检测,记录白细胞(WBC)、血小板(PLT)、淋巴细胞(LYM)、中性粒细胞(NE)、嗜酸性粒细胞(EO)。计算PLR及NLR公式:PLR=PLT/LYM,NLR=NE/LYM。
1.2.3 CHD组斑块多因素分析:因变量选择为斑块易损(易损=0,稳定=1),将两个实验组组间显示有意义的变量纳入多因素Logistic回归方程。随访6个月,比较PLR及NLR对不良心血管事件(Major Adverse Cardiac Events,MACE)的影响。MACE包括:复发心绞痛、急性心肌梗死、严重心率失常、心力衰竭、冠心病死亡等。

2 结 果
2.1 两组一般资料及生化指标比较 与对照组相比,易损、稳定组PLT、NE、LYM、EO、PLR、NLR增高,LYM相对减低,结果对比有统计学差异(均P<0.05);相比稳定斑块组,易损组PLR和NLR明显升高,差异均有统计学意义(均P<0.05)。见表1。
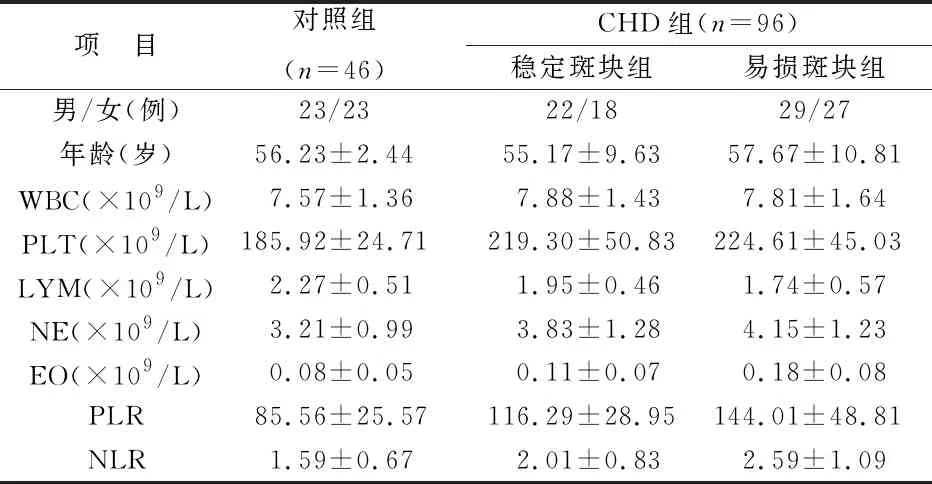
表1 两组一般资料及生化指标比较
2.2 冠状动脉斑块性质易损性预测 选取单因素Logistic分析中有统计学差异数据纳入逐步多因素回归方程。多因素预测显示:PLR、NLR均是CHD患者斑块易损性的独立危险因素(P<0.05)。见表2。

表2 冠状动脉斑块性质易损性预测 多因素Logistic回归分析结果
2.3 预测因素的ROC曲线 对PLR、NLR进行ROC曲线分析,PLR最佳cut-off值为131.5(AUC=0.802,95% CI:0.707~0.897),敏感度为71.4%,特异度为82.1;NLR最佳cut-off值为2.1(AUC=0.786,95% CI:0.687~0.885),敏感度为66.7%,特异度为80.7%;联合预测(AUC=0.838,95% CI:0.750~0.925),敏感度为78.6%,特异度为82.1%。见图2。
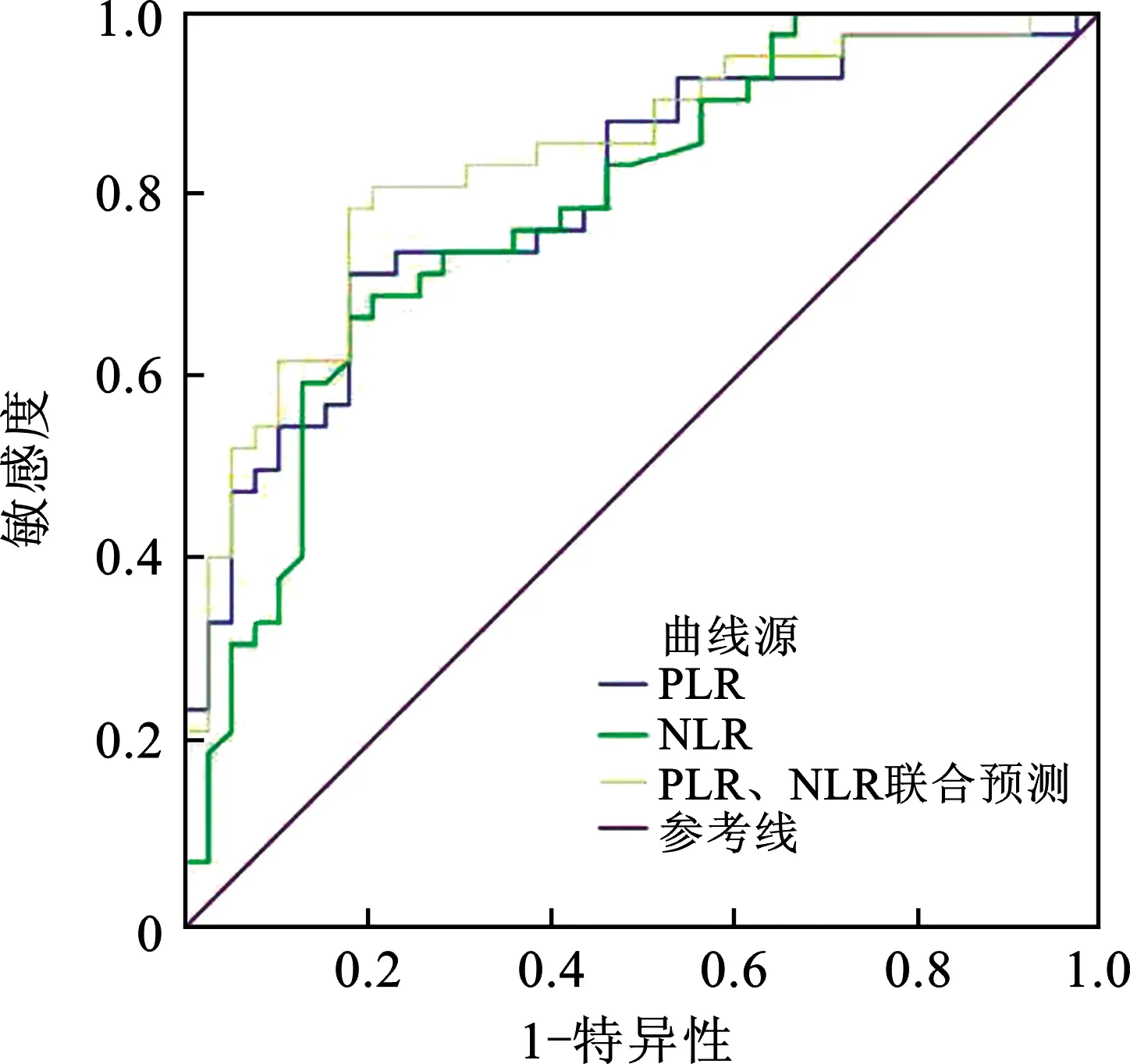
图2 各独立危险因素预测的ROC曲线
2.4 不同PLR及NLR值患者的预后比较 以PLR最佳cut-off值133.1为临界值分为低PLR组(<131.5)、高PLR组(>131.5),以NLR最佳cut-off值2.1分为低PLR组(<2.1)、高NLR组(>2.1)。随访6个月期间,MACE高PLR组发生20例(20/43,46%)、高NLR组发生22例(22/44),占50%,分别显著高于低PLR组8例(8/53, 15.1%)及低NLR组6例(6/52,11.5%),差异有统计学意义(P<0.05)。
3 讨 论
文献提示,动脉粥样硬化斑块破裂致内皮下基质暴露,从而引发血小板聚集和血栓逐渐形成,是心血管疾病死亡的常见原因[7],斑块易损是疾病演变的关键因素[8],易损斑块脂质体积占比大于40%,极易出现斑块破裂及脱落而引发血栓[9]。血小板在心血管疾病的发病中起重要作用[10],为降低斑块厚度,临床常用抗凝或抗血小板药物抑制斑块形成[11-12],但总体有效率不理想。
冠脉CTA后处理图像多层面、全方位的展示心脏血管的管腔内外情况,能够对CHD患者的病变血管作出直观的判断,通过图像测量工具能区分斑块性质,同时能对狭窄的官腔进行初步分析。机体炎症状态下,血小板增殖加快,中性粒细胞激活,而淋巴细胞持续凋亡[13-14],本实验结果显示CHD组PLT、NE、LYM与对照组存在明显差异,易损斑块组较稳定组,PLT、NE、LYM差异不明显,但前者PLR及NLR升高明显,说明PLR及NLR较PLT、NE、LYM反映CHD患者斑块易损性更敏感,采用比值作为研究指标避免了单个项目检测造成的偏倚。
近年来有研究显示,血小板通过介导免疫细胞调节淋巴细胞功能、释放促炎症介质,血小板和中性粒细胞通过P-选择素、巨噬细胞I抗原等粘附分子及细胞内的信号转导,机械地促进血管炎症和动脉血栓形成[15],本实验数据显示,与对照组比较,CHD组PLT与NE增高,说明PLT与NE升高与冠脉病变有关,实验结果为临床治疗寻求新的诊疗思路提供线索。Logistic回归分析显示,PLR、NLR是CHD患者冠脉斑块易损性的独立危险因素,此结果与朱志远等[16]研究结果相一致,本实验证实联合预测效能要高于两个因素的单独预测。随访结果显示MACE发生的比例,高PLR组及高NLR组分别显著高于低PLR组及低NLR组,数据结果有统计学差异,实验结果提示PLR、NLR升高可能预示预后较差。有研究发现,冠状动脉斑块中存在过表达的强效嗜酸性粒细胞趋化剂激活因子CCL11[17],实验结果显示CHD组EO与对照组存在一定差异,多因素分析提示EO不是影响CHD患者斑块易损性的独立危险因素,说明EO对动脉斑块易损性的影响作用有限。
总之,PLR及NLR均是衡量CHD患者冠脉斑块不稳定的重要参考指标,是影响斑块易损性的独立危险因素,且均对患者预后有深远影响,对临床决策具有一定的提示作用,并对临床治疗寻找新的治疗靶点提供思路。本研究下一步将扩大样本及延长随访时间,并深入探究CHD患者血运重建前后PLR、NLR对预后的影响,并深入探索PLR联合NLR对CHD患者预后的影响。

