企业如何建立和实施医疗器械唯一标识的探讨
王宝童,马美娟


摘 要:医疗器械唯一标识(UDI)是医疗器械的唯一身份标识,规范其应用对医疗器械的全生命周期监管具有重要意义。目前,我国的心脏起搏器、髋关节假体、整形用注射填充物等九大类64个品种被列入国家药监局实施医疗器械唯一标识的产品目录。随着国家药监局不断建立UDI各种制度,强化源头赋码,实现从源头生产、运输、经营、临床使用等各环节全链条医疗器械标识和追溯,不仅有助于提高企业医疗器械可追溯水平,保证产品质量可控以及提高信息化管理等各方面水平,形成运营监管大数据,实现对医疗器械可追溯性,推动智慧城市发展,对推动我国医疗器械行业的快速发展具有重要意义。
关键词:建立和实施;医疗器械唯一标识;UDI
中图分类号:R197.39 文献标识碼:A 文章编号:1674-1064(2021)12-0-03
DOI:10.12310/j.issn.1674-1064.2021.12.025
为深入贯彻落实我国有关医疗器械安全“四个最严”的要求,要加强对医疗器械全生命周期监管,逐步建立医疗器械唯一标识系统,实现唯一标识各环节中的应用,形成从源头生产到最终临床使用全链条联动,全面推行医疗器械唯一标识体系建设,提高我国各级医疗器械监督管理效率,切实保障公众用械安全,推动形成医疗器械监管治理新格局奠定基础。
《医疗器械监督管理条例》明确提出,国家根据医疗器械产品类别,分步实施医疗器械唯一标识制度[1]。2021年,《国家药监局 国家卫生健康委 国家医保局关于做好第二批实施医疗器械唯一标识工作的公告》发布,明确规定在首批9大类69个医疗器械品种实施唯一标识的基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围[2],这就要求医疗器械生产企业尽快建立和实施医疗器械唯一标识码。
通过大量调研发现,医疗器械生产企业在自主实施医疗器械唯一标识(UDI)过程中,流程冗余、过程复杂、人工干预过多、信息化与自动化程序低、人力成本及时间成本高昂、操作复杂且易出错,导致医疗器械唯一标识在企业内部实施过程缓慢[3]。
1 编码原则
依据《医疗器械唯一标识系统规则》,医疗器械注册人/备案人应当按照医疗器械唯一标识的编制标准,创建、维护医疗器械唯一标识,并在产品上市前将产品标识和相关数据上传至医疗器械唯一标识数据库,并且对数据的真实性、准确性、完整性负责[4]。
医疗器械唯一标识系统是国家药监局为了对医疗器械生产、经营和使用等各环节进行精准、快速、准确识别,并追溯,实现医疗器械全生命周期管理,提升监管机构监管效能,同时又能提高医疗器械生产企业管理水平,保证医疗器械安全、有效、可追溯而建立的标识体系。完整的医疗器械唯一标识系统(UDI系统)不仅包括医疗器械唯一标识(UDI),还包含唯一标识数据载体和唯一标识数据库。
1.1 医疗器械唯一标识码(UDI)组成
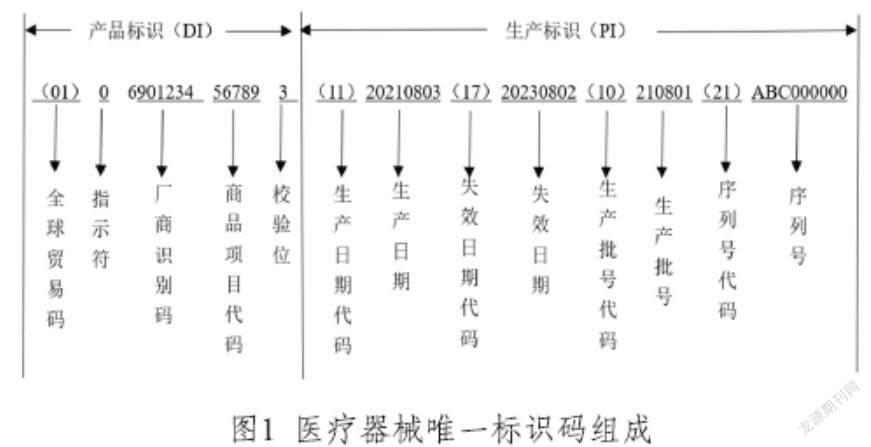
医疗器械唯一标识码是医疗器械的“身份证”,由产品标识(DI)和生产标识(PI)组成,其中,(DI)为静态信息,表示医疗器械注册人/备案人、医疗器械规格型号、包装的标识,包括企业编码和产品ID。其中,企业编码由备案人申请,由符合我国医疗器械编码规则和标准的发码机构发出,是具备唯一性的编码;产品ID是一段包含具体产品名称、包装等级、规格型号的编码。由企业编码和产品ID组合而成的DI具备全球唯一性。(PI)为动态信息,表示与生产过程相关的信息。目前,PI编码暂不需要上传到药监局数据库,各使用单位可采用扫描设备直接获取产品相关生产信息。为了规范使用,UDI编码需要遵从唯一性、稳定性、可扩展性三个基本原则。
以GS1为例,结合本企业实施详细情况举例,如图1所示。医疗器械唯一标识码的组成依次为:全球贸易码(2位)+指示符(1位)+厂商识别码(7~10位)+商品项目代码(5位)+校验位(1位)+生产日期代码(2位)+生产日期(8位)+失效日期代码(2位)+失效日期(8位)+生产批号代码(2位)+生产批号(6位)+序列号代码(2位)+序列号(9位)。
1.2 序列号编码原则
序列号由制造商分配,企业可以根据自身需要进行调整,最长为20位。图1的序列号ABC000000中,A代表最小销售单元,用第一、第二位阿拉伯数字表示,01~99;B代表盒,用第三、四位阿拉伯数字表示,01~99;C代表箱,用最后两位阿拉伯数字表示,01~99。举例来说,序列号ABC030201表示第一箱第二盒里面的第三个产品。
2 发码机构选择
目前,国内受到认可的发码机构有三家,分别是中国物品编码中心、中关村工信二维码技术研究院、阿里健康科技(中国)有限公司,各发码机构在编码标准、服务平台、数据载体等方面存在一些区别,各发码机构对比分析如表1所示。企业可根据产品自身特点选择合适的发码机构,有助于企业在赋码和流通的过程中产品问题量降到最低,从而减少解决这些问题所需的人力、物力和财力资源。
3 数据载体选择
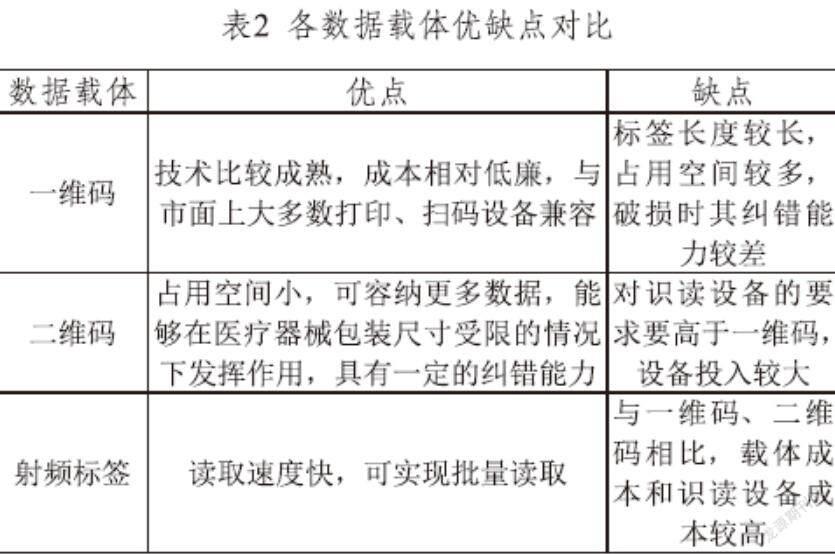
医疗器械唯一标识数据载体指存储或者传输医疗器械唯一标识的数据媒介。唯一标识数据载体作为存储和传输UDI的数据媒介。现有的数据载体类型有一维码、二维码和射频标签(RFID)等,各有优缺点,如表2所示。企业可根据产品基本特性、服务价值、主要应用场景等因素选择合适的数据载体。需要注意的是,数据载体应位于标签、外包装或医疗器械本体上,企业在选择数据载体的同时也应考虑标签的设计。
4 建立和实施医疗器械唯一标识步骤
医疗器械生产企业在完成发码机构选择、数据载体确认后,根据各发码机构不同,实施流程有所区别。以GS1公共平台,基于国家药监局UDI法规,协助医疗器械企业完成UDI申报及产品赋码,UDI申报实施流程具体如下:
申请条码证书:企业应首先向发码机构申请产品条码证书,即产品标识(DI)部分,与发码机构沟通是否可以实现医疗器械唯一标识码的要求,建议条码发码机构作为医疗器械唯一标识码发码机构,沟通起来比较方便。
选择合适发码机构:企业应按照《医疗器械唯一标识系统规则》和相关标准,结合实际情况选择合适发码机构。目前,国家药监局认可的发码机构有中国物品编码中心、中关村工信二维码技术研究院、阿里健康科技(中国)有限公司三家,企业可自行选择。
系统注册:确定砝码机构后,企业应先登录国家药监局网上办事页面,选择法人登录,进行注册登录,首次登录的注册人、备案人要进行用户注册和系统绑定,具体操作详见系统操作说明。
系统信息维护:企业完成用户注册及基本信息核验后进入唯一标识信息管理系统,进行基本信息维护,填写企业产品基本信息。
创建产品标识:企业和砝码机构沟通确认,由发码机构赋予企业产品标识(DI),企业根据自己产品名称、规格和型号等信息创建产品标识(PI)。
确定生产标识:在创建好产品标识后,企业确定生产标识组成及载体,包括原则合适的标签设计,以及标签采用何种方式实现。
系统标识提报:企业根据创建的产品标识和确定的生产标识与机构再沟通确认后,在医疗器械唯一标识码系统中提报产品标识。
机构审核:企业在医疗器械唯一标识系统提报产品标识的同时,告知医疗器械唯一标识发码机构,发码机构审核无误后,产品标识进入国家医疗器械唯一标识码数据库。
选择数据载体:企业根据医疗器械发码机构制定的标准结合自身情况,在满足法律法规的前提下选择适合的数据载体,对医疗器械产品上赋予医疗器械唯一标识数据载体,选择一维码、二维码、射频标签等载体。
赋予数据载体:企业根据医疗器械唯一标识的要求,确定数据载体及具体实现的要求。
编制编码规则:企业根据《医疗器械唯一标识系统规则》结合企业实际情况,制定医疗器械唯一标识码相关文件,批准后执行。
赋码:企业依据《医疗器械唯一标识系统规则》,根据发码机构赋予的产品标识,结合当批产品的生产信息,制定本批次医疗器械唯一标识码,并赋码。
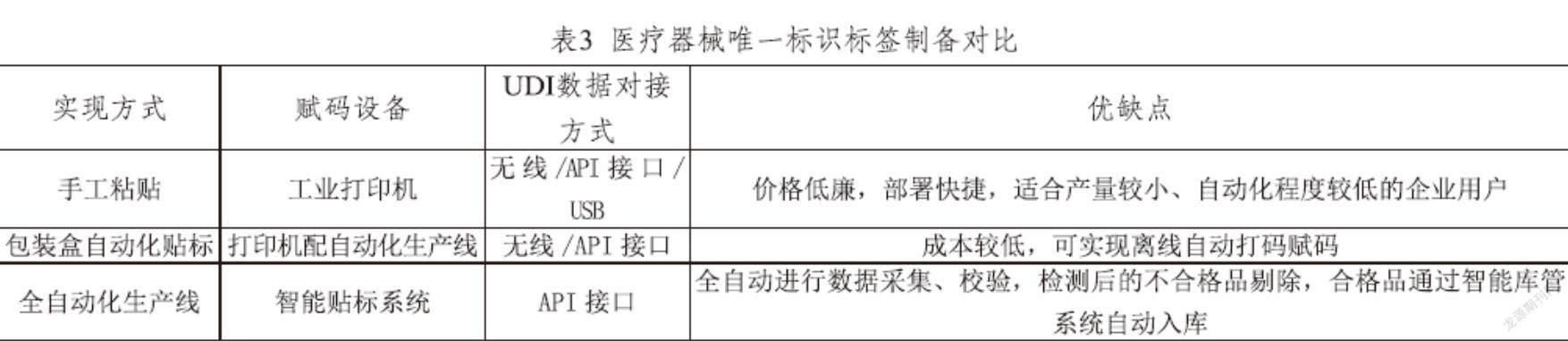
标识唯一标识:企业在每个产品包装上标识医疗器械唯一标识,并由内部监管部门进行监督管理,确保正确实施。医疗器械唯一标识数据载体应满足自动识别和数据采集技术以及人工识读的要求自动识别和数据采集技术包括一维码、二维码、RFID电子标签等形式。数据载体应位于标签、外包装或医疗器械本体上,且粘贴牢固、清晰可见。各种标签制备对比如表3所示。
唯一标识码录入:企业在完成每批产品标识后,对每个包装上的医疗器械唯一标识码进行扫描录入。
唯一标识上传数据库:企业在产品出库时应进行扫描,将医疗器械产品标识和相关生产信息全部上传至医疗器械唯一标识数据库。
数据发布:企业上传至国家局医疗器械唯一标识数据库的医疗器械唯一标识,将会完成数据发布。
数据共享:上传至医疗器械唯一标识库的数据即可完成共享。
数据更新、维护:当企业生产的医疗器械产品标识、生产标识等信息发生变化时,企业应及时在国家局系统更新数据库,企业应指定专人定期维护医疗器械唯一标识系统。
申报流程如图2所示。
5 结语
综上所述,在实施医疗器械唯一标识码的过程中,应结合企业实际情况,结合产品的风险程度,在满足法规要求的前提下选择合适的发码机构,选用合格的载体,实现医疗器械全产业链的追溯。随着我国大力推进UDI实施,可以预见在不久的将来,在各方共同努力下,将推动唯一标识试点的“三医联动”模式,建立健全唯一标识法规标准体系,进一步推动我国医疗器械产业的快速、健康发展。
参考文献
[1] 国务院第739号令《医疗器械监督管理条例》,2021.
[2] 国家药监局关于发布医疗器械唯一标识系统规则的公告(2019年第66号)[R].北京:国家药品监督管理局,2019.
[3] 国家药品监督管理局.YY/T 1630—2018醫疗器械唯一标识基本要求[S].北京:中国标准出版社,2018:14.
[4] 李君,刘政江.建立医疗器械唯一标识(UDI)编码规则的实践与思考[J].中国医药导刊,2019,21(9):529-532.

