血清IL-34水平评估非病毒性肝细胞癌患者预后的临床价值
张瑜兰 乔正梅
近年来,非乙型肝炎病毒、非丙型肝炎病毒相关的非病毒性肝细胞癌(hepatocellular carcinoma,HCC)的患病率明显增加。非病毒性HCC主要与酒精性肝病、自身免疫性肝炎和非酒精性脂肪性肝炎有关。近年发现了如甲胎蛋白[1]、AKR1B10[2]、lncRNA ELMO1-AS1[3]等在内的多种与HCC诊断及预后相关的生物标志物,但对于与非病毒性HCC患者预后因素研究较少。研究发现,IL-34与肝纤维化的慢性丙型肝炎患者预后不良有关[7],并可能参与HCC的发病机制,对判断HCC的预后有一定的价值[4]。本研究探讨血清IL-34水平对非病毒性肝细胞癌患者预后的影响,现将结果报道如下。
资料与方法
一、一般资料
本文为回顾性研究,选取2013年3月至2014年3月在我院住院的100例非病毒性肝细胞癌患者(非病毒性HCC组)和 100名健康体检者(对照组)。纳入标准:患者经组织学、影像学及临床参数诊断为肝细胞癌,诊断标准符合中国抗癌协会肝癌专业委员会2011年修订的《原发性肝癌诊断标准》[5];血清乙型肝炎表面抗原及乙型肝炎病毒DNA阴性、抗丙型肝炎抗体及丙型肝炎病毒RNA阴性的原发性HCC;入院前未接受任何有创治疗;年龄>18岁。排除标准:肝细胞癌复发再治疗者;胆管癌及混合型肝细胞癌者;器官移植者;伴心、肺、肾功能严重损伤者;其他恶性肿瘤;精神疾病或合并感染者;临床及随访资料不完整者。100例非病毒性HCC患者中,男性73例,女性27例,年龄50~79岁,平均年龄(67.3±13.6)岁;酒精性肝病40例,自身免疫性肝炎12例,非酒精性脂肪性肝炎8例,原发性胆汁性胆管炎5例,隐源性肝病35例。100名健康体检者中男性64例,女性36例,年龄49~80岁,平均年龄(66.5±10.5)岁。以门诊、电话等形式对患者进行随访。随访时间从诊断到患者死亡或研究结束,随访终止时间为2019年3月31日。本研究经医院伦理委员会审核批准。
二、研究方法
(一)收集临床资料
收集研究对象临床资料,包括年龄、性别、体质指数(body mass index,BMI)、病史、白细胞计数(white blood cells,WBC)、血小板计数(platelets,PLT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、丙氨酸氨基转移酶(aspartate and alanine transaminase,ALT)、碱性磷酸酶(alkaline phospatase,ALP)、甲胎蛋白(alpha-fetoprotein,AFP)、Child-Pugh评分、病理诊断及分级等信息。
(二)观察指标
研究对象入院时空腹采集4 mL静脉血,转速3 000 r/min,4 ℃离心10 min后收集血清,-80 ℃保存备用。采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA,美国R&D Systems,Minneapolis公司试剂盒)检测研究对象血清IL-34水平。操作严格按照产品说明书进行。所有检测均由经过技术培训及质量考核的同一个操作者完成。
三、统计学分析
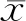
结 果
一、两组一般资料及血清IL-34水平比较
非病毒性HCC组与对照组是否患有糖尿病、WBC、PLT、ALT、AST、总胆红素、直接胆红素、白蛋白、肌酐、AFP均具有显著性差异(P<0.05),见表1。非病毒性HCC组血清IL-34水平显著高于对照组(t=22.122,P<0.001)。
二、IL-34与非病毒性HCC患者临床参数相关性分析
Spearman分析IL-34与非病毒性HCC患者临床参数相关性,结果发现:PLT、ALT、AST、ALP、总胆红素、AFP、Child-Pugh分级、肿瘤大小、肿瘤分期与IL-34呈正相关,见表2。
三、患者血清IL-34对非病毒性HCC预后的预测价值
ROC分析血清IL-34对非病毒性HCC预后的预测价值,如图1所示。血清IL-34对非病毒性HCCAUC=0.889,截断值 8.87 pg/mL,P<0.001,95%CI0.820~0.958,敏感性82.98%,特异性92.45%。
四、血清IL-34水平对非病毒性HCC患者生存率的影响
随访期间, 非病毒性HCC组49例(49.0%)死亡。Kaplan-Meier生存曲线比较高IL-34(≥8.87 pg/mL,n=41)和低IL-34(<8.87 pg/mL,n=59)生存情况,高IL-34组和低IL-34组中位数生存期分别为43.3月和>60个月,两组生存率具有统计学差异(χ2=14.360,P=0.002)。
五、非病毒性HCC患者预后影响因素
Cox比例风险回归模型分析影响非病毒性HCC预后因素发现,AFP、肿瘤大小、肿瘤分期、IL-34是非病毒性HCC预后危险因素,见表3。
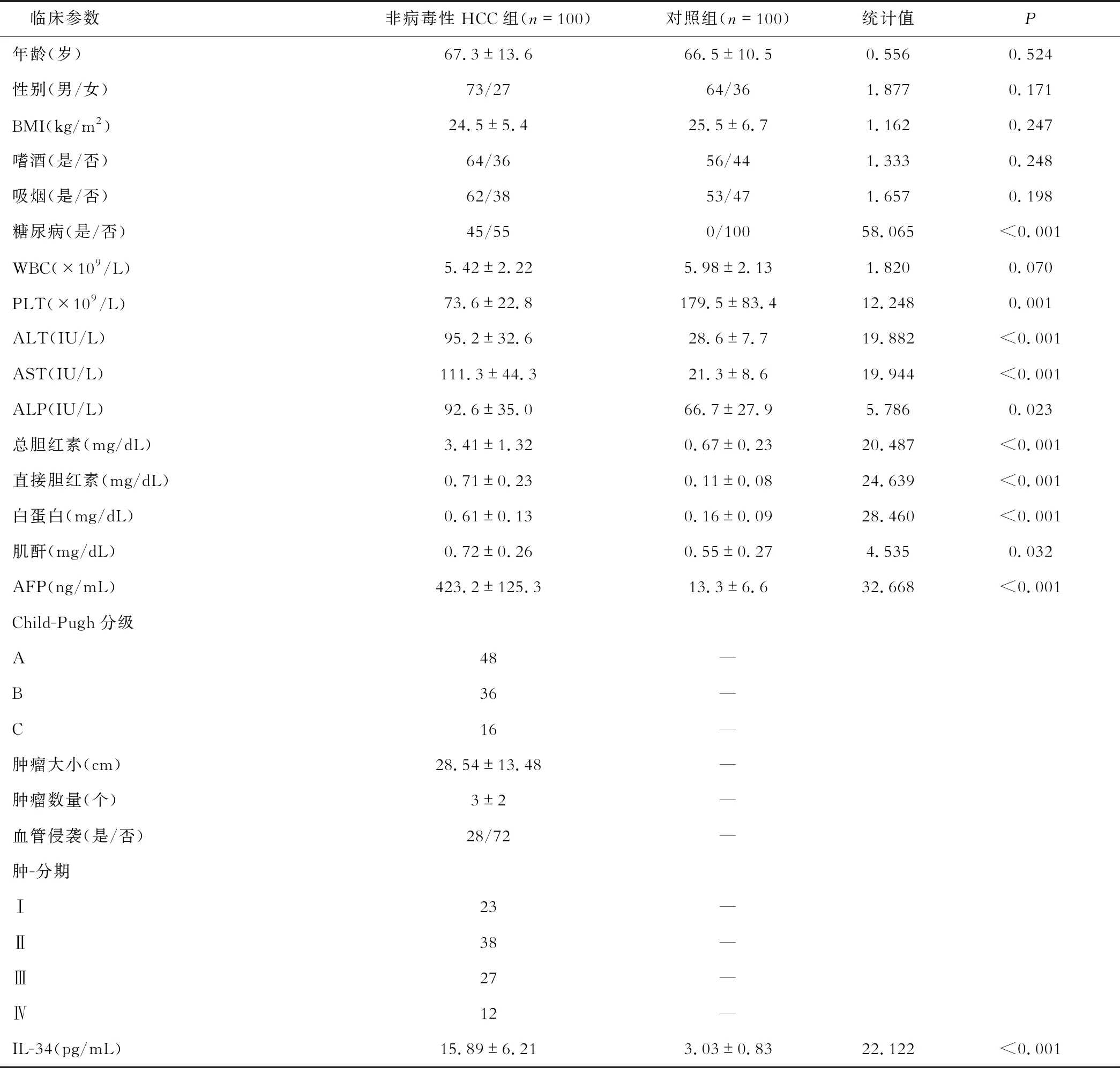
表1 两组临床参数比较
讨 论
研究结果说明IL-34可能与肝脏疾病的发生发展密切相关[6]。本研究发现非病毒性HCC患者血清IL-34水平显著高于健康对照者,这提示机体IL-34水平可能与非病毒性肝癌也具有密切关系。研究表明高纤维化慢性丙型肝炎患者血清M-CSF和 IL-34 水平高于相应低纤维化阶段患者及健康对照者[7],慢性乙型肝炎患者不同肝纤维化阶段血清IL-34水平与健康对照组比也具有显著统计学差异[8]。这进一步证实IL-34与肝纤维化、HCC密切相关。本研究发现IL-34与非病毒性HCC患者多个临床参数呈正相关。Wang等[8]也发现在慢性乙型肝炎感染的肝纤维化患者中,血清IL-34水平与ALT、AST、总胆红素、间接胆红素、γ-谷氨酰转肽酶、碱性磷酸酶、PLT具有相关性,与本文结果较相似,说明IL-34作为一种参与诱导促纤维化巨噬细胞活化的细胞因子,可以作为评估肝脏疾病患者肝脏炎症、肝纤维化、肝癌的候选指标。
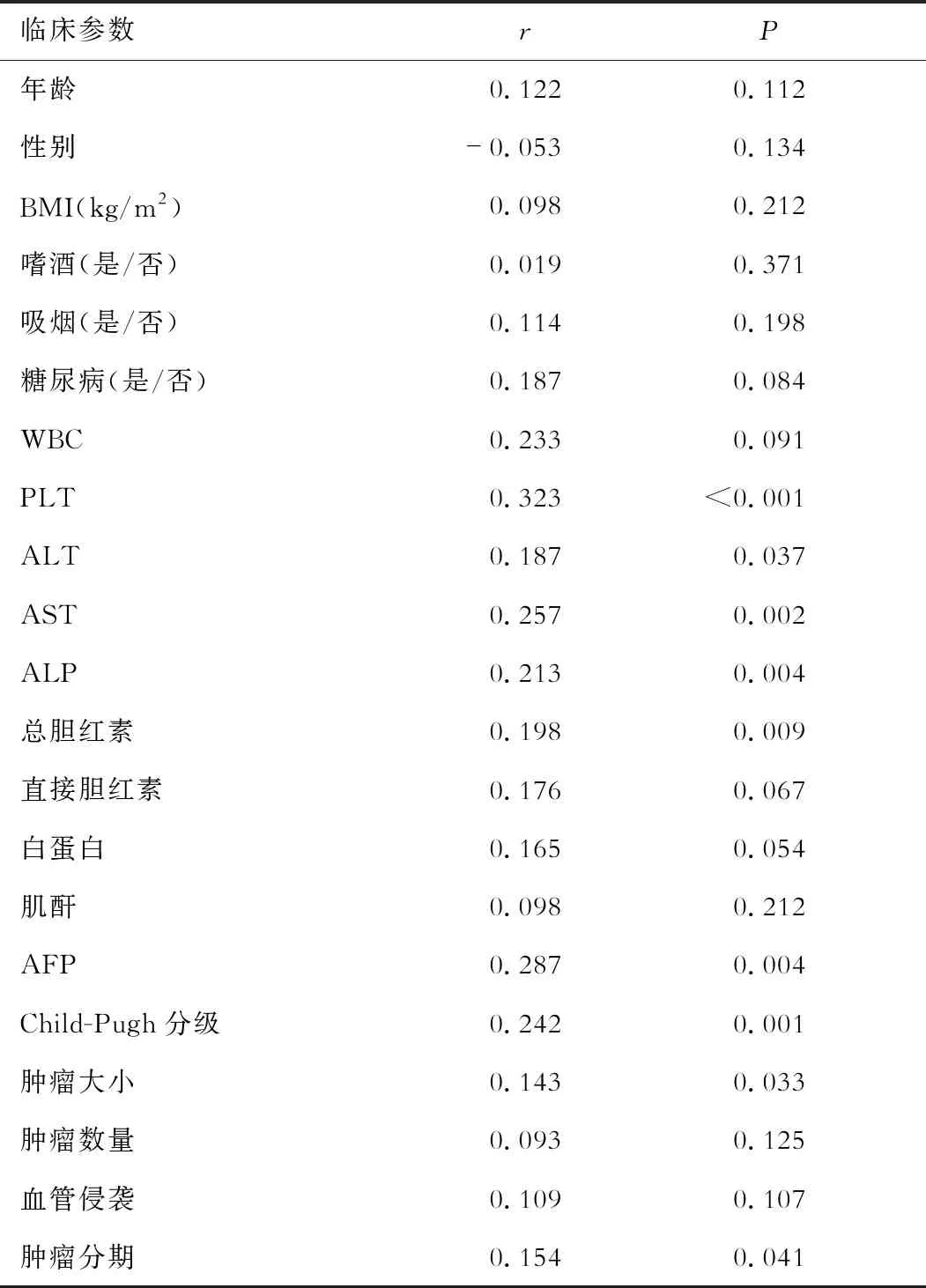
表2 非病毒性HCC组血清IL-34水平与临床参数相关性分析
图1 ROC分析血清IL-34对非病毒性HCC预后的预测价值
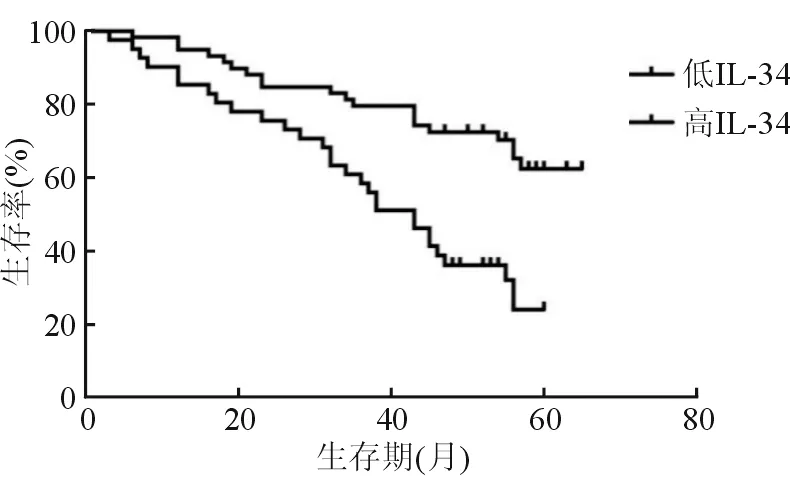
图2 不同血清IL-34水平非病毒性HCC患者Kaplan-Meier生存曲线
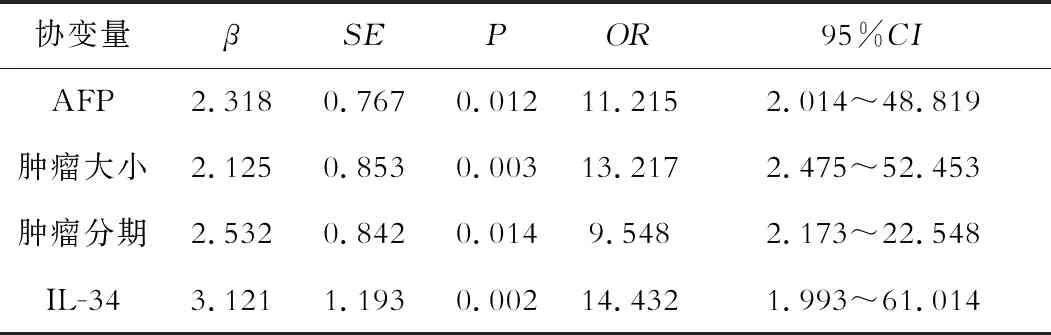
表3 Cox比例风险回归模型分析影响非病毒性 HCC预后相关风险因素
本研究发现,非病毒性HCC患者高血清IL-34水平生存率低于低IL-34水平组,并与非病毒性HCC患者预后不良有关。何晓荣等[4]研究肝癌患者癌组织IL-34表达水平时也发现癌组织IL-34高表达组患者生存时间明显短于IL-34低表达组。肝癌患者血清及癌组织IL-34表达水平与患者生存时间结果一致,这提示IL-34可能参与了肝癌的发生发展过程。Preisser等[7]报道,在病毒性肝炎患者中,受损的肝细胞分泌IL-34,其诱导单核细胞募集并分化为促纤维化巨噬细胞,以及促进肝星形细胞分泌I型胶原蛋白,因此IL-34可能通过肝脏失代偿与预后不良有关。Zhou等发现HCC中miR-28-5p表达下调,miR-28-5p下调与肿瘤转移,复发和不良生存相关。而IL-34是miR-28-5p的标靶,miR-28-5p下调对HCC生长和转移的影响依赖于IL-34介导的肿瘤相关巨噬细胞(tumor associated macrophage,TAM)浸润。miR-28-5p-IL-34信号通路诱导的TAMs通过转化生长因子β1抑制miR-28-5p在HCC细胞上的表达,从而产生miR-28-5p-IL-34-巨噬细胞-正反馈循环。HCC中miR-28-5p表达低,IL-34水平高,TAM数量高的患者预后不良,总生存期短,复发时间短。因此,miR-28-5p-IL-34-巨噬细胞反馈环调节HCC转移,并可作为新的预后因素以及HCC的治疗靶点[9]。此外,本研究发现除了IL-34,AFP、肿瘤大小、肿瘤分期也是与非病毒性HCC患者预后相关的独立风险因素。
本研究的局限性:(1)本研究为单中心回顾性分析,纳入的非病毒相关HCC的患者数量较少,影响结果的精确性。有必要进行大规模多中心前瞻性研究,进一步探讨IL-34作为判断非病毒性HCC预后生物标志物的作用。(2)本研究未将IL-34的预测作用与其他已发现的候选生物标志物进行比较,IL-34是否能与其他生物标志物共同预测非病毒性HCC也有待进一步研究。(3)IL-34在HCC发生、发展过程中的具体作用机制有待进一步探讨。

