双层博弈视角下的中国药品专利链接制度移植与创新
赵乃瑄 杨壬淦
摘 要:鼓励新药研发、降低药品价格是提升民众健康获得感的关键环节和重要话题。文章通过 “双层博弈”理论分析原研药企和实力不均药企之间的博弈竞局,发现药品专利链接制度是化解博弈困境的一个重要策略,明确指出现有运行机制存在的问题以及建立中国药品专利链接制度的可行性。在借鉴美国药品专利链接制度成功经验的基础上,提出中国药品专利链接制度应包括的要素;同时,从完善相关法律法规、改进仿制药简化申请制度和Bolar例外等角度,在适用规则移植、操作规程移植、移植中的创新方面提供可参考的建议,为政府部门决策提供理论支撑。
关键词:博弈;药品;专利链接;移植;创新
中图分类号:D 923.42 文献标志码:A 文章编号:2096⁃9783(2021)06⁃0065⁃09
引 言
药品关乎社会公众生命安全。激励新药研发和降低药品价格是提高大众健康水平的核心问题。众所周知,药品研发周期长、投入大、成功率却非常低,因此,保护药品创新成果,提升新药开发积极性和药品收益,对于促进制药产业可持续发展非常重要。在中国,药品专利并非从一开始就纳入专利保护范畴的,1984年《中华人民共和国专利法》(以下简称《专利法》)实施之初,药品专利并未在列;之后《专利法》修订,把药品专利纳入其中,加入了专利保护的行列之中。
中国一直以来都是仿制药大国,并且国内仿制药规模仍将持续保持较高占比。本土药企自主研发能力偏弱,保障社会公众健康所需药品八成以上需要依赖仿制药,有研究表明,外企原研药占中国药品市场份额超过三分之一,销售额超过千亿元[1]。如果中国首仿药能及时替代已经过了专利保护期的外企原研药,那么国内医保资金和患者费用每年至少可节省超过300亿元。当前,中国制药产业仍然处在技术引进、消化吸收、迭代创新的阶段,诸如癌症、传染病等许多领域还没有有效的治疗手段,需要尽快开发新药投放市场,填补空白。
近年来,中国政府持续推动药品专利保护,探索建立中国药品专利链接制度。2017年10月,中共中央办公厅、国务院办公厅发布《关于深化审评审批制度改革,鼓励药品医疗器械创新的意见》,明确提出“探索建立药品审评审批与药品专利链接制度”;2020年3月29日,最高人民法院办公厅发布的《2020年度司法解释立项计划》中,制定了《关于检验药品联系性纠纷法律适用问题的规定》。政府一系列文件的出台,旨在引导、促进、加速制药产业创新发展。中国制药产业正值发展改革之际,制药产业进一步发展的关键在于创新,药品专利链接制度不但鼓励、保护创新,更激励竞争,可以充分调动中国制药企业自主创新的积极性,对中国制药产业实现由仿制为主向原研创新和仿制创新并举转变至关重要。但是,具体落实到如何有效平衡原研药企、仿制药企、社会公众的利益,促进社会公众充分获取新药,尚须制度上的严谨设计与法规上的重塑。
一、药品专利链接制度的基本理解
药品专利链接制度源自美国。1984年,美国出台Hatch⁃Waxman法案,在该法案中,确立了药品专利链接制度。其内涵包括四个方面:一是将仿制药的上市审批与原研药的专利状态进行链接;二是将药品注册管理机构与专利审查批准机构进行链接;三是在原研药企、仿制药企、社会公众等不同利益主体之间谋求平衡;四是若仿制药对原研药存在专利侵权行为,那么仿制药的上市申请将不会获得批准。总体来说,将药品上市审批制度、药品专利授权确权和侵权制度,以及政府相关部门的职能进行有机衔接和协同的制度就是药品专利链接制度[2]。之所以会设立这样的制度,是希望原研药企等主体能够相互协同,保障各方的利益都能够顺利地实现,推动药品能够在社会公众之间得到较好的流通和使用,进而造福更多的民众。
二、原研药企和仿制药企以及仿制药企间的博弈竞局
中国明确鼓励药企进行原始技术创新,并通过授予原研药专利权、独占权来促进新药研发和推广应用。本质上,原研药具有一定垄断性的,它更多代表私人利益。但仿制药的出现却是反垄断的,某种程度上,它更多代表社会整体利益,由于其具有價格低廉的优势,可以在更加广泛的患者群体中使用,客观上推动药品的社会共享。也正是如此,二者形成了较大的矛盾,形成了两种不同权利之间的博弈,这一博弈的本质还进一步关系社会的整体利益的实现。原研药和仿制药博弈中,实际涉及的博弈主体有三个,分别是原研药企、实力强的仿制药企、实力弱的仿制药企。通过博弈活动的开展,各方利益都纷纷发力,希望通过这一过程获得最大化的利益。原研药企希望自己的创新药品独占市场,获取丰厚利润;实力强的药企希望通过挑战专利,依靠首仿药获利;实力弱的药企则期待搭便车获利。不同的利益目标产生了三者之间的博弈竞局。
博弈论是德国哲学家和数学家莱布尼兹(Leibniz)于1710年首次提出的。博弈是指在某些环境条件下,个人、团队、组织遵从一定的规则,从其各自可以选择的行为或策略中,单次或多次、同时或陆续进行选择和实施,并接受这一过程中产生的相应结果。博弈论主要描述当事各方在这种情况下合理选择行动所产生的结果,并分析当决策者的行动相互作用时做出的决策以及这种决策的平衡问题[3⁃4]。
但是单一的博弈分析层次不足以解释药品专利链接制度的产生根源,双层博弈则提供了一个更具解释力的理论模式。哈佛大学罗伯特·普特南教授在1988年关于国际关系的研究中,首次引入了“双层博弈”的概念,用于分析国内政治和国际政治是如何发生互动和相互影响的。当然,在考虑原研药企和仿制药企,以及仿制药企之间的竞争与合作关系时,同样可以借助该理论,为合理设计相关制度、促进多方博弈共赢提供理论支持。
(一)原研药企和仿制药企的博弈
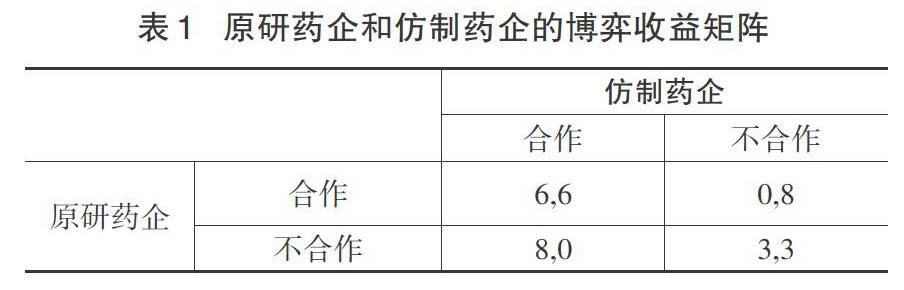
博弈论假设经济主体具有经济理性,博弈的双方总是谋求以最低的成本,实现最大化的个体利益[5]。实际上,原研药企和仿制药企要在市场竞争中反复进行博弈。在这里,采用表1博弈收益矩阵来解释原研药企与仿制药企之间的博弈过程(矩阵中的数字大小仅仅说明博弈主体选择策略的偏好,与特定的收益没有关系)。
从表1看出,(6,6)>(8,0)>(0,8)>(3,3),当原研药企和仿制药企选择了(合作,合作)策略时,产生的效益为(6,6),社会整体效益实现了最优化。当原研药企和仿制药企都选择不合作的策略时,他们各自的效益为8,这种策略对于双方而言均属于最优策略。如果他们分别独立改变策略,将会减少自身效用。纳什均衡的最优选择与个体理性相对应,任何一方都没有动机,也没有激励去改变策略。反之,则双方都可以改变自己的策略组合,并且可以在未来进行策略的随时更改,这样一来,双方之间的不合作导致双方都形成了制约之势,陷入经典的囚徒困境之中。由于原研药企和仿制药企单方面利益的最大化,并不代表社会整体利益的最优化,因此双方非合作行为的组合是一种无效的均衡状态,有必要修正(不合作,不合作)的状态,需要通过制定科学合理的策略来提升社会整体利益。
(二)仿制药企间的博弈
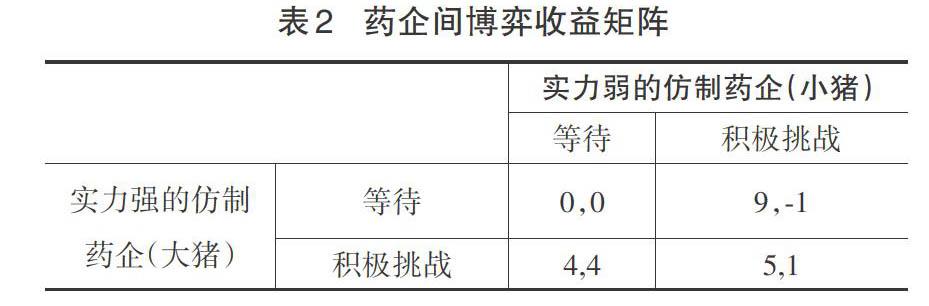
仿制药企实力有强弱之分,从博弈论视角看,实力不均的仿制药企之间存在“智猪博弈困境”。如表2所示,矩阵中的数字表示主体选择相应策略时所获收益值,前者为大猪收益,后者为小猪收益(矩阵中的数字大小仅仅说明博弈主体选择策略的偏好,与特定的收益没有关系)。
表2显示,就小猪而言,选择等待能让小猪更有利可图,收益要高,因此小猪将选择等待这个占优策略,而不是去选择积极挑战的不利策略。就大猪而言,当它选择去积极挑战的话可以得到4个收益,但若它改为选择等待的话,则什么都得不到,所以,大猪肯定会选择通过积极挑战来获利。该博弈的纳什均衡解决方案是“大猪积极挑战、小猪等待”,最终小猪选择搭便车,坐享其成。药品仿制中实力不均的企业的博弈正如同大猪和小猪的博弈。实力强的仿制药企充当了“大猪”角色,积极挑战原研药,而实力弱的仿制药企扮演了“小猪”角色,等待搭便车。这种严重的药品仿制企业“搭便车”现象,给仿制药企带来了不合理的利润,削弱了有能力的药企进行仿制的热情。为了破解仿制药企之间的这种困境,需要建立一种制度在药企仿制创新中寻求多方利益的平衡。
三、博弈竞局的化解策略
专利保护通过对原研药的肯定和激励,使得更多的新药被创造出来,推动了社会进步。而仿制药则提高了人们对新药的获取能力,实现了对药品资源的充分利用,能够为人民带来更多的健康。如果没有专利保护,药品的仿制就无从谈起。如果没有仿制药,受专利保护的原研药就不能更好地在患者群体中推广应用。可见,原研药与仿制药既对立又统一,相互制约、相互促进,社会发展的目标是要在个体利益和社会利益之间取得平衡。
原研药企创制了药品,渴望通过获得专利权独占市场,并阻止社会公众对其药品的低价使用,从而获得高额收益,这代表个体的私有利益。仿制药企希望以低成本快速仿制药品并大范围销售来获取利润,客观上实现了更多社会公众对药品的施用,某种程度上代表了社会公众的利益。双方诉求和利益不同,导致了第一层博弈关系的产生。另一方面,实力强的药企希望通过首仿药的成功占领市场,而实力弱的药企则希望通过“搭便车”来分享利益,这导致了第二层博弈关系的产生。原研药与仿制药、实力不均的药企间代表着双层利益的博弈,仿制药更多代表社会公众的利益追求,而原研药更多是对自身垄断利益的追求。
当缺乏药品链接制度时,很难均衡原研药企利益和仿制药企的利益,无法实现社会公众对药品的广泛获取,同时也很难平衡实力不均药企之间的利益,也就是说无法化解这两层博弈困境。英国经济学家科斯认为,权利之间并没有绝对清晰的界限,当一种权利受到法律的保护时,必定会有另一种权利遭受损害[6]。所以,片面强调其中任何一方均不合适。在新的环境中,需要建立一种新的制度在这种博弈竞局中找到平衡点,需要通过制度的重塑,兼顾原研药企和仿制药企、仿制药企之间的利益,一方面,必须提高药品的可支付性;另一方面,又保护专利权和独占权,使得多方在博弈中的合作与竞争呈现相互交融的关系。也就是说,需要借助一项科学合理的制度来有效配置藥品资源,使其既能促进全民健康,又能使得博弈主体在收益分配上保持相对公平。药品链接制度正是化解双层博弈困境的有效策略,具体来说,它能实现如下目标:
1.破解药品供给不足与公民健康需求的矛盾
药品专利链接制度通过鼓励仿制药企挑战专利,有利于仿制药企在模仿中突破自我,以首仿药市场独占作为专利链接制度的配套措施,对实力强的仿制药企将产生较大地激励,激励其更快加入市场竞争,进而提高社会公众药品可获得性以及可支付性,最终实现社会利益最大化。
2.平衡双层利益,实现共赢
一是保护专利权人的权利,加大对药品原始创新的支持力度,促进中国逐步拥有自主研发的核心竞争力,实现制药业转型升级;二是鼓励仿制药企进行专利挑战,引导仿制药规避无效不良专利,在药品投放市场前帮助仿制药企解决专利纠纷和侵权风险,维护仿制药生产商的利益,避免仿制药企浪费资源,促进仿制药质量水平提升,早日打破原研药长期垄断的市场;三是作为药品专利链接制度的配套措施,首仿药市场独占的措施对实力强的仿制药商会产生较大激励,可促进首仿制药尽早上市。
3.促进中国医药产业创新与发展
从药品专利链接制度来看,对于原研药的专利状态进行了具体的研究和分析,从中我们可以看出原研药的申请人和专利权人的具体情况,从而可以保护相关主体的合法权利。同时通过药品专利链接制度,还进一步对专利及专利池的相关内容进行了范围的界定,从而使得原研药专利保护的壁垒在这一过程中得到了探索,激发了相关主体的创新意识的觉醒,推动药品在这个过程中得以创新。
四、构建中国药品专利链接制度的可行性
从建立的环境来看,早在2006年,在国务院发布的《国家中长期科技发展规划纲要(2006—2020年)》中, “重大新药创制”就被列入十六大科技重大专项之一。2020年公布的《药品注册管理办法》以及2020年公布的《专利法修正案》中,进一步针对中国建立药品专利链接制度做了更为详细的规定。随着相关法律的不断完善,并且实践经验也在这一过程中不断加以积累,从而推动药品专利链接制度的建立,已然成为新时代下的必然选择,这对于我国药品市场的健康发展来说,是十分有必要的,也有利于推动我国药品市场生态的稳定。总的来说,建立中国药品专利链接制度已经具备了较好的环境基础。
从各方利益平衡来看,就创新药企来说,建立专利链接制度之后,创新药企能够及时知晓拟发起专利挑战的仿制药企及仿制药的信息以及市场中可能存在的竞争情况,可以采用诉讼等手段提前做好防控准备,从而降低潜在风险。
就仿制药企来说,由于仿制药上市之前可能的侵权问题前置化了,因此仿制药企可以避免早期研发中的资源浪费以及在生产上市后出现的仿制药侵权问题。药品专利链接系统的建立从根本上确立了一种筛选机制,杜绝了不经过挑战专利程序或挑战专利失败的仿制药私自上市,实力强的仿制药企可以借助该制度向原研药专利发起挑战,通过首仿药瓜分市场份额,从而推进实力强的药企业做大做强,逐步扭转中国仿制药生产企数量多、规模小、散乱的态势,优化仿制药产业的整体结构。
就社会公众来说,药品专利链接制度的建立,将提升社会公众对疗效好、成本低、价格低药品的获取能力。就监管执法机构来说,实践中存在两难境地:假使其不批准仿制药申请,那么他们将可能面临来自公众对其不作为的质疑,但是,他们如果审查并批准涉嫌侵权的仿制药上市,那么则可能产生针对其行政许可行为合法性问题的诉讼风险。而药品专利链接制度恰好能够规避监管执法部门的上述行政管理风险,从而使得仿制药注册过程更加透明化。
五、中国药品专利链接的现有运行机制及存在问题
根据现行《药品注册管理办法》第18、19、31条关于仿制药的临床试验、第74条关于仿制药的对照研究、《专利法修正案》(2020年10月17日)、《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》(2017年第55号)、《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》、《上市药品目录集》数据库网页的有关内容,结合当前的审批实践,目前中国现行专利链接制度包括了以下内容:①中国上市药品目录集;②仿制药简略申请;③不侵权声明(专利声明);④专利侵权纠纷对上市审批的影响(专利挑战);⑤仿制药申请上市时间的限制(Bolar例外);⑥药品专利期补偿;⑦药品数据保护。在实际操作中,主要存在以下几方面的问题:
一是相关法律制度不健全。形式上,中国从2002年就确立了涉及专利链接制度的有关内容,但更多的是形式要求,并没有真正将药品专利保护与行政保护链接起来。例如,在中国的相关制度中,“Bolar例外规则”还是个新生事物,有关配套制度未能及时跟进[7]。《专利法》第69条第 (5) 款中,仅对 “Bolar例外规则”的适用范围做了规定,但专利保护期延长制度却未能引入,该制度的缺失将导致药品专利申请人申请行政审批所耗费的时间无法弥补,实际上造成了专利保护的不公平。尽管目前大多数中国药企将研发创新的重点聚焦于仿制药基础上的再创新,更多的外国药企是医药专利保护期限延长的受益者,但中国也有不少致力于自主研发的药企,并且数量呈增长态势,本土药企更加需要延长专利保护期的激励机制,只有本土藥企真正崛起、强大起来,中国制药产业才能更加健康发展。
二是法律法规未形成统一的体系。目前,中国药品链接制度仍处于探索阶段,相关规定主要集中于《药品注册管理办法》,其中“Bolar例外规则”主要在《专利法》第69条第(5)款中有所提及,药品数据保护主要体现在《药品管理法实施条例》和《药品注册管理办法》有关条款中,这些政策和法规之间相互脱节,衔接度低,融合性较差。
三是专利药品链接制度实施效果不佳。《中国上市药品目录集》缺乏系统性,具体表现在:①标准制剂无系统性,RS与RLD功能含糊不清。标准制剂在中国还属新生事物,因此《中国上市药物清单》仅规定了RLD作为仿制药注册申请中参考药物的作用,以及RS作为人类生物等效性研究中参考药物的作用。针对某种形式的RLD和RS很可能是不同的药物、两者的功能很难区分的问题,还缺少其他指南来进一步明确哪些部分应与RLD相关,哪些部分应与RS相关。②《中国上市药品目录集》没有形成一个系统的数据库结构,数据结构无系统性,检索数据的下载保存路径还存在盲区。③《中国上市药品目录集》中登记的专利信息过于简单,数据完备性欠缺,没有建立创新药专利权信息公示机制,不能为仿制药企业规避专利纠纷提供必要的信息参考。
四是政府机构的外部链接机制欠缺。国家药品监督管理局与国家知识产权局及法院的链接度有待加强。国家药品监督管理局会参考国家知识产权局或法院关于专利诉讼的处理结果,但国家药品监督管理局不会为未决的专利诉讼做出保留审批决定的意见。除了在药品注册申请批准前,其他时间两部门之间没有任何业务上的链接。由于各部门间协作关系的欠缺,直接导致了药品注册批准侵权概率的提高。
六、中国药品专利链接制度移植
(一)美国实践的启示
美国创造性地定义了药品专利链接制度:一方面,建立了仿制药上市审批与验证过程中是否存在相应新药之间的链接关系;另一方面,建立了美国食品药品监督管理局与美国专利商标局之间的链接关系。通过30多年司法实践,美国的药品专利链接制度确保了药品监管审批与专利保护相互联系,促进了原研药和仿制药的协同发展。
1984年前,美国仿制药在处方药中的占比不足20%,Hatch⁃Waxman法案实施以后,仿制药在处方药中的比重逐年增加,至2013年,占比已提高到近80%,再经过6年的发展,2020年将增长到约90%[8]。事实上仿制药往往价格优势较为突出,他们的研究成本较低,也正是他们的存在使得民众对于药品的支出费用越来越低,从而推动了药品的普及程度的提高。《2017年美国仿制药获取和节省报告》显示,近九成的仿制药价格低于20美元。美国医疗保健系统在过去的十年间,节省了约1.7万亿美元医保费用,仅2016年就节省了超过2 500亿美元医保费用。
从美国食品和药物管理局(以下简称FDA)已接受的首仿药申请来看,美国仿制药企通常对自己要挑战哪件专利,要仿制哪种药品有非常清晰的思路。销售量的大小是其评估是否挑战某件专利的首要评判标准,而专利性的高低仅仅作为第二考量因素。因为一旦专利挑战成功,销售量的大小才是决定盈利能力强弱的最关键因素。其次才会评判专利性的高低,专利性越低,专利挑战成功的可能性就越高,反之,专利挑战的成功性就越低。中国仿制药企可以借鉴这种专利挑战策略,重点选择市场规模较大、工艺较为先进、专利性较低的药品作为仿制重点。
从FDA已受理的首仿药申请公司来看,首仿药申请量位居前两位的申请药企分别是Mylan Pharmaceuticals Inc.和Teva Pharmaceuticals USA,这2家仿制药企力争第一个向FDA递交简化新药申请,并且取得了成功。另一方面,他们以已获得的专利为基础,对其他仿制药企进行侵权诉讼,力争在仿制药市场中获得市场的垄断权。总体来看,美国大型仿制药企原先大多以生产品牌仿制药为主,但目前也在不断拓展产品链、提升价值链,以Teva为例,其PCT申请量已高达1 600多件。
从首仿药申请中Paragraph IV(以下简称PIV)专利声明来看,相当一部分首仿药是通过PIV专利成功后获批的,例如在2018 年上半年已获批的34 件首仿药品种中,有13 件经PIV 专利挑战成功后获批[9]。美国仿制药企在向FDA提出首仿申请之前都经过周密的调研,一方面将被2个以上仿制药企提出PIV专利声明的品种作为品种选择的重要参考方向。另一方面,选择橙皮书中专利有效期越远的专利进行仿制。橙皮书即《经治疗等同性评价标准的药品》,从中我们可以看出已经获得批准的药品名单,并且这些药品所涉及的专利信息也是一目了然的[10]。在橙皮书中的专利有效期越远,证明原研药的保护力度越大,独占性也就越强。对此发出PIV专利声明的意义也就越大,其品种的前景也就更被看好。国内药企在选取仿制品种时完全可以借鉴这种思路。
(二)移植路径
我们在讲到社会公共利益时,在药品领域强调的还有药品能够流通的程度。政府必须充分考虑社会公众利益。美国经验告诉我们,设置药品专利链接制度,引入竞争,多方博弈之下可实现社会福利的最大化。
1.我国药品链接制度应包含的要素
在对其他国家成功案例进行学习的基础之上,结合中国自身制药业发展水平以及相关法律制度的特点,可以初步确立中国药品专利链接制度应包括下述要素:仿制药简化申请制度及“Bolar例外”(包括不侵权声明及诉讼),药品专利期补偿、药品专利信息公开制度,首仿药体系(明确首仿药的定义、建立首仿药目录)、药品试验数据的保护、仿制药专利声明。
2.相关法律法规的移植
从相关实践出发,有必要对于专利相关法案进行修改,从而使得相关要素能够更为完整,更加符合实际需要。针对原研药企滥用诉讼期、停滞期拖延仿制药上市等不当利用专利链接制度的行为,需要设立一些配套制度来进行规范。由于建立药品专利链接制度将与《专利法》规定的“Bolar例外”条款相冲突,因此,如果引入实质性的专利链接制度,那么还需要做出类似于美国的拟制侵权制度的规定。此外,药品专利链接制度还会对知识产权保护部门与药品审批监管部门之间的职能划分产生不小的影响,如果仅以行政法规的形式规定某些内容,显然并不妥当,无法解决其中的诸多问题,需要上升到立法層次。
3.适用规则的移植
(1)改进“Bolar例外规则”
将仿制药的上市审批与原研药专利到期后的审核相链接,是仿制药简化申请制度的核心内涵。为了避免仿制药上市后出现可能的专利侵权问题,仿制药企应在申请注册前,对已上市药品的在先专利状况进行整体评估,以确保在先专利保护期届满后,仿制药能够快速上市。
在中国,“Bolar例外规则”也被称作“医药行政审批抗辩制度”。“Bolar例外规则”可以使仿制药企大大缩短申请行政审批的时间,当原研药专利保护期限届满后,仿制药就能及时顺利上市。该制度的引入增强了仿制药企对仿制行为法律后果的预期,也使司法程序破解了牵强套用其他法律条款、甚至无法可依审理类似案件的难题[10]。
相较于基于生产经营目的和行政审批目的来评判仿制药企的仿制行为,建立“客观判断标准”更加科学。具体来说,就是要合理认定仿制行为的侵权责任,对于在专利到期后出售仿制药的仿制药企来说,无论其在专利保护期内的任何时间提出注册申请,都不应被视为专利侵权;超出批准所需合理数量的仿制药则不在审批例外的豁免范围之内,应将其视为专利侵权并受到责罚。过量生产的仿制药的数量不应超过所需样本量的一定百分比,样品的总价不得超过类似药物价格的一定倍数。
(2)延长药品专利保护期
我国对于发明专利的保护时效是20年,而对于药品发明来说,其中药品的研发往往便经历了很长的时间,数十年也不鲜见。从新药研发、试验、验证到核查、审批都需要耗费大量的时间,也正是因此在药品上市之后,专利受保护的时间显然缩短了很多。药品专利期限的延长主要用于针对临床试验以及核查审批准所耗费时间的补偿。如果对专利期限没有给予足够的补偿,那么无疑将严重挫伤整个制药业对新药研发的积极性。因此对于专利链接制度而言,专利期限补偿制度是不可或缺的。药品专利保护期限的延长,不仅决定原研药维持市场垄断的时间,而且还决定了仿制药企被排除在市场之外的期限,这无疑将对仿制药企制定专利挑战策略产生重要影响。
(3)建立首仿药体系
准确界定首仿药是完善首仿药相关制度的先决条件。但是,目前中国还未从国家层面给出类似美国的明确的首仿药定义,只是从国家药品监督管理局开展药品审评的过程中,我们发现其中有首仿药品种,但遗憾的是,我们还是没有从中看到单列的首仿药品种目录,不能够为首仿药的相关实践提供指引。因此,中国可以参照美国做法,在《中国上市药品目录集》数据库中建立国内首仿药目录,方便行业和社会公众及时、准确、系统了解上市仿制药品的相关信息。此举将对鼓励仿制药发展,促进药物创新研发,完善药品具有积极意义。
4.操作规程的移植
(1)完善专利登记信息
根据国家药品监管部门的相关规定,申请人在进行信息的披露过程中,需要对于药品受专利保护的情况进行详细的说明,并且在信息已经更新之后需要对其进行及时地披露更新。另外,需要就药品专利权人完成专利信息登记工作的期限做出限定,同时要保障社会公众能准确、及时地获取这些公开信息。
(2)健全《中国上市药品目录集》
一是建立公示异议制度,原研药企在提交新药申请上市的同时,进行专利信息的申报,之后,由仿制药企或其他药企监督该信息,并采取异议或更正的方式来完善该信息。在这一过程中,国家食品药品监督管理局审评中心仅仅对其加以审核,没有进行太多的其他干预行为。二是建立信息更新制度,要及时跟踪专利的动态变化情况,以保证专利信息客观、准确。三是建立专利审查制度,要遵循对应性原则,审查专利权利要求与药品的对应性,防止原研药厂通过不相关的专利来拖延或阻碍仿制药上市,造成药品专利链接制度的滥用。四是建立《中国上市药品目录集》信息报监的激励机制,一方面让申报信息不实者承担不利后果,另一方面又要激励仿制药企对《中国上市药品目录集》中的某些错误信息提出修正意见。五是建立信息争议仲裁机制,一旦对登记信息产生异议,则需要在一定期限内完成处理程序,不宜拖沓。六是建立标准制剂的指定系统,应制定细则明确指定新RS的情形、新RS应当满足的要求,以及指定新RS的程序。
(3)推进药品试验数据保护
获取新药试验数据特别是临床试验数据,需要耗费大量的精力、人力和财力,只有对新药试验数据施行充分保护,才可能对新药创新起到激励作用。作为激励创新行之有效的举措,保护药品试验数据在中国势在必行。当然,试验数据保护制度的设计,需要尽可能兼顾仿制与创新的利益。为公众提供便宜又有效的药品,始终是保障公共健康的核心。
七、中国药品专利链接制度移植中的创新
(一)建立知识产权管理部门和药监管理部门职能链接
一是为避免原研药企设置人为障碍,登记一些与上市药品相关度低的专利,阻碍仿制药早日上市,可以由国家药品监督管理局和国家知识产权局共同审查登记专利。二是知识产权管理部门和药监管理部门共同审批专利保护期的延长申请。在收到专利保护期延长的申请后,知识产权管理部门可以函告药品监督管理部门,了解药品的效用及药品审批上市所耽搁的时间。两机构紧密合作的链接机制,可以确保专利期的延长制度不被滥用而影响仿制药的上市步伐。
(二)倡导仿制药的不侵权诉讼
1. 不侵权或不视为侵权抗辩
如果原研药企未向法院提起诉讼,仅采用向行政部门投诉、发警告信、发律师函等方式,主张仿制药企对其构成了侵权行为,并且长时间不撤回投诉或警告,从而导致仿制药企出现被动的、不安全的经营状态,那么通常情况下,仿制药企可以采取更为积极的主张,向原研药企所在地的人民法院提起确认不侵权诉讼。
2. 禁止反悔原则抗辩
为了获得专利权或维持专利的有效性,在药品专利申请或无效程序中,药品专利权人或者药品专利申请人有时候不得已会修改或放弃某些权力要求,限缩专利的保护范围,以证明该药品与现有技术之间存在配方、制作工艺等方面的差异。为避免专利申请人或者专利权人出现反悔的情况,在仿制药专利侵权诉讼中,可以使用禁止反悔原则。仿制药企可以就原研药企在专利申请时修改或放弃的部分权利要求,以及作出的某些限定性的解释,提出抗辩来表明其并未侵权。
3. 专利权无效抗辩
在处理首访药专利侵权纠纷案件之中,首先需要确认的是药品的专利是合法且有效的,唯有如此才能够确保原告的利益能够得到保全,而对于被告而言,通常需要抗辩的便是原研药专利已然失效。如果原研药专利最终确定为无效,那么该药品专利权人的排他性权利将因此丧失,仿制药企也就排除了侵权的可能性。
(三)建立专利无效司法判决程序
由于专利链接制度仅与法院的司法判决相链接,因此在改良型新药和仿制药申请人提出“专利无效或者不可实施、不侵犯专利权” 的声明情况下,即进入专利链接程序。此时,若因为专利挑战的告知引发了原研药企的诉讼,那么法院应及时受理关于专利无效的相关诉讼。目前,对于知识产权案件的审理,中国法院并不直接判决专利无效,专利无效的判决通常是由专利复审委员会复审做出的。专利复审委的专利无效宣告并不能作为药品审评审批机构批准药品申请的直接依据,而且这种无效宣告是可诉行政行为,这可能导致专利无效这种挑战类型的诉讼纠纷审理时间延长[11]。在建立专利链接制度后,应优化专利无效司法判决程序,允许法院直接进行专利无效宣告,缩短专利无效案件的审理时间,提高专利挑战型诉讼案件的审理效率,以便加快后续药品审评审批的进程。
结 语
原研药从本质的角度来看,形成了垄断之势,通过专利法的保护可以很好地维护原研药生产者的权益。相反,仿制药的出现是反垄断的,由于具有价格低廉的优势,可以在更加广泛的患者群体中使用。也正是如此,原研药与仿制药企之间的矛盾不仅存在,二者间矛盾还会在很多情况下形成越发扩大之势,这也从一个侧面展现出个体利益和社会利益之间的矛盾以及不少药企之间的矛盾。
形成资源的优化是基于制度设计的不断优化来达到的,从而推动整个社会综合效率的不断提高。药品资源的优化配置并不是对实际的资源配置提供一个简单的调整方案,而是要构造一个优化的配置機制,而药品专利链接制度正是当下须要构造的一种机制。药品专利链接制度就是在若干权利之间取得平衡。
作为知识产权保护制度的重大举措,药品专利链接制度解决了一些关键的问题,诸如如何促进医药产业健康发展以及如何平衡协调专利保护与公众健康之间的关系。在合理的制度设计之下,中国的制药产业一定能够得到快速发展,逐步从跟随仿制到自主创新,能够让中国公民能够使用上安全、有效、廉价的药品。
参考文献:
[1] 朱精兵,顾东蕾. 2014年美国首仿药数据行为剖析[J]. 中国新药杂志,2015,24(24):2775⁃2778.
[2] 张浩然. 竞争视野下中国药品专利链接制度的继受与调适[J]. 知识产权,2019(4):50⁃70.
[3] 丁彦彦. 网络著作权的利益博弈及法理分析[D]. 桂林:广西师范大学,2008.
[4] 吕阳,陈洁. 博弈视角下图书数字资源共享的版权困境及其策略研究[J]. 图书馆研究工作,2016(6):5⁃8.
[5] 周丽霞,王萍. 数字图书馆与作者的博弈生存[J]. 情报理论与实践,2011,34(3):35⁃38.
[6] 孙瑞英. 网络信息资源共享与版权保护的博弈双赢研究[J]. 情报理论与实践,2013,36(8):30⁃34.
[7] 宁立志. 我国“Bolar例外规则”的学理解构与制度重建[J]. 政法论丛,2019(2):46⁃56.
[8] 李蓓. 中美药品专利链接制度研究[J]. 科技与法律,2018(1):10⁃18.
[9] 美国专利商标局数据库 [DB/OL]. [2021⁃06⁃13]. https://portal. uspto. gov/pair/PublicPair
[10] 姚雪芳,张国成,丁锦希. 中国推行药品专利链接制度的可行性研究——基于利益相关方分析法. 中国新药杂志[J]. 2016(24):2814⁃2820.
[11] Harris T, Nicol D,Gruen,N. Pharmaceutical Patents Review Report [EB/OL](2013⁃05⁃27)[2019⁃06⁃06]. https: //www.ipaustralia. gov.au/sites/g/files/net856/f/2013⁃05⁃ 27_ ppr_final_report. pdf.
Transplantation and Innovation of China's Drug Patent Linkage System from the Perspective of Two⁃level Game
Zhao Naixuan,Yang Rengan
(School of Economics and Management, Nanjing Tech University, Nanjing 211816, China)
Abstract: Encouraging the research and development of new drugs and reducing drug prices are key elements and eternal topics for improving people's sense of health. After analyzing the game competition among original research and development drug companies, generic drug companies, and pharmaceutical companies with uneven strength based on the "two⁃level game" theory, we found that the drug patent linkage system is an important strategy to resolve the game dilemma, and clearly pointed out the feasibility of establishing Chinese drugs patent linkage system, and existing problems for existing operating mechanisms. Based on the successful experience of the US drug patent linkage system, we put forward the elements that should be included in the Chinese drug patent linkage system; and provided some suggestions for transplanting the applicable rules, operating procedures transplantation, and innovation in transplantation from the perspectives of improving relevant laws and regulations, improving the simplified application system for generic drugs and the Bolar exception. This provides related theoretical support for the decision?making of government departments in the future.
Key words: game; drug; patent linkage; transplantation; innovation

