乙型肝炎病毒促进肝细胞PD-L1蛋白表达机理
朱海珍 荀圳 邓日林 田仁云 郭萌萌 陈生稳 刘倩 郭艳霞


摘 要:为了研究乙型肝炎病毒(Hepatitis B virus,HBV)能否借助肿瘤细胞的抗免疫机制来逃逸机体免疫,利用HBV感染去肝细胞,研究受感染后的肝细胞对宿主免疫应答的变化. 通过实时荧光定量PCR的方法分析HBV感染后的肝细胞内Axin和PD-L1的转录水平,发现HBV不影响Axin和PD-L1的转录水平,采用蛋白免疫印迹技术发现HBV能下调肝细胞内Axin蛋白水平,同时上调PD-L1蛋白水平. 进一步在细胞内转染表达HBV的组成蛋白的质粒,通过蛋白免疫印迹技术发现HBV的组成蛋白HBx能下調细胞内Axin蛋白的表达. 通过数据相关性分析以及泛素化实验发现,Axin能通过增加PD-L1的E3泛素连接酶SPOP的表达,促进PD-L1泛素蛋白酶体降解. 进一步对PD-L1的泛素化方式进行探讨,发现Axin促进PD-L1的K48依赖的泛素化降解作用. 结果表明,HBV可能通过HBx下调Axin和SPOP蛋白水平,抑制PD-L1泛素化降解,进而逃逸宿主免疫应答. 本研究揭示了HBV免疫逃逸新机制,为治疗HBV奠定了新的基础,在一定程度上推动了抗HBV药物开发.
关键词:酶;PD-L1;乙型肝炎病毒;Axin;免疫逃逸;泛素化;HLCZ01细胞
中图分类号:Q71 文献标志码:A
Mechanism of Induction of PD-L1
by Hepatitis B Virus in Human Hepatocytes
ZHU Haizhen1,2,3†,XUN Zhen1,2,3,DENG Rilin1,2,3,TIAN Renyun1,2,3,
GUO Mengmeng1,2,3,CHEN Shengwen1,2,3,LIU Qian1,2,3,GUO Yanxia1,2,3
(1. College of Biology,Hunan University,Changsha 410082,China;
2. Institute of Pathogen Biology and Immunology,Hunan University,Changsha 410082,China;
3. State Key Laboratory of Chemo/Biosensing and Chemometrics,Hunan University,Changsha 410082,China)
Abstract:In order to explore whether Hepatitis B virus (HBV) can escape the body’s immunity by means of the anti-immune mechanism of tumor cells, this study used HBV to infect hepatocytes, and then explored the changes of the immune response of infected hepatocytes to the host. The transcriptional levels of Axin and PD-L1 in hepatocytes after HBV infection were analyzed by real-time fluorescence quantitative PCR, and it was found that HBV did not affect the transcriptional levels of Axin and PD-L1. Then, western blot was used to find that HBV could down-regulate Axin protein levels in hepatocytes and up-regulate PD-L1 protein levels. Further transfection of plasmid expressing HBV component protein in cells showed that HBx could down-regulate Axin protein expression in cells by western blot. Data correlation analysis and ubiquitin assay showed that Axin promoted pD-L1 ubiquitin proteasome degradation by increasing the expression of E3 ubiquitin ligase SPOP of PD-L1. Further studies on the ubiquitination of PD-L1 showed that Axin promoted the K48-dependent ubiquitination of PD-L1. Based on the above results, we believe that HBV may down-regulate Axin and SPOP protein levels through HBx, inhibit PD-L1 ubiquitination and degradation, and then escape the host immune response. This study reveals a new mechanism of HBV immune escape, lays a new foundation for the treatment of HBV, and promotes the development of anti-HBV drugs to a certain extent.
Key words:enzymes;PD-L1;Hepatitis B virus(HBV);Axin;immune evasion;ubiquitin;HLCZ01 cell line
乙型肝炎病毒(Hepatitis B virus,HBV)是一种小的嗜肝DNA病毒,是导致慢性肝病的主要原因,可导致病毒性肝炎、肝硬化和肝细胞癌(Hepatic cell carcinoma,HCC). 据统计,全世界约有2.5亿人长期感染HBV,并有发展为肝硬化甚至肝癌的风险[1]. 病毒和宿主因素都对慢性HBV感染的結果有影响,与其他病原体一样,HBV形成了逃避宿主的免疫防御策略,例如高比率的基因突变率和免疫调节蛋白的表达.
轴抑制蛋白Axin是Wnt/β-catenin信号的负调节因子,通过蛋白酶体降解途径调节β-catenin蛋白水平,进而抑制Wnt/β-catenin信号转导[2-4]. 然而,Axin在HBV感染过程中的作用尚不清楚.
PD-L1是一种免疫检查点分子,调节Ⅰ型T辅助细胞(Th1)免疫反应,介导癌症免疫逃避. 它可以在肿瘤细胞(TC)和肿瘤浸润性的免疫细胞(IC)上进行表达[5]. 近几年,抗PD-L1治疗手段在人类癌症的免疫治疗中占据了中心地位[6-8]. 然而,PD-L1在HBV感染中的作用及其机理仍有待阐明.
泛素蛋白酶体降解途径是目前已知的所有真核生物体内具有高度选择性且最为重要的蛋白质降解途径. 真核细胞内泛素化修饰后的靶蛋白能被降解或者被转移到细胞内或细胞外的特定部位. 靶蛋白的泛素化修饰需要E3泛素连接酶的参与,E3泛素连接酶通过调控调节蛋白的泛素化过程参与细胞内的多种生理过程[9]. 经研究发现,HBV感染可对细胞内多种生命活动产生影响,如影响转录因子的表达,促使Caspase剪切从而促使细胞凋亡等. 然而,HBV是否能调节细胞内一些E3连接酶的表达,进而调节泛素蛋白酶体途径尚不清楚.
本文从转录水平、翻译水平以及翻译后的修饰水平对Axin 和PD-L1的关系进行了探讨,发现Axin可能通过调节PD-L1的E3连接酶的表达,调控PD-L1的翻译后修饰;同时,还发现Axin能够逆转HBV引起的PD-L1上调现象. 本研究为HBV免疫逃逸机理提供参考和依据.
1 材料与方法
1.1 细胞系
Huh7细胞为美国耶鲁大学医学院刘晨教授实验室惠赠;BGC-823购自Boster公司;HEK293T购自美国ATCC;HLCZ01细胞系由本实验室从临床病人肝组织中分离培养得到[10].
1.2 试 剂
高糖(DMEM)培养基和DMEM/F-12 培养基(Invitrogen 公司),1×PBS(Hyclone 公司),0.25%胰蛋白酶(Invitrogen公司),细胞RNA收取Trizol 试剂(Invitrogen 公司),逆转录试剂盒(Accurate Biology公司),SYBR Green 定量试剂盒(Accurate Biology 公司),蛋白酶抑制剂片剂(Merck 公司),细胞蛋白收取RIPA 裂解液(Thermo 公司),Axin抗体(CST公司),PD-L1抗体(Proteintech公司),Flag抗体(Sigma-Aldrich公司),V5抗体(Invitrogen公司),β-actin 抗体(Sigma-Aldrich公司).
60 mm的细胞培养皿(Biologix公司),十二孔细胞培养板(Biologix公司),10 cm的细胞培养皿(Biologix公司),1.5 mL的离心管(Axygen公司),200 μL PCR八联管(Axygen公司),0.22 μm和0.45 μm的PVDF 膜(Merck Millipore公司).
1.3 仪器设备
4 ℃冰箱(中科美菱公司),-20 ℃冰箱(Haier公司),-80 ℃超低温冰箱(Thermo公司),CO2恒温细胞培养箱(Thermo公司),生物安全柜(Airtech公司),凝胶核酸成像(上海天能公司),蛋白核酸曝光成像仪器(Bio-rad公司),细胞计数仪(Beckman公司),光学显微镜(Olympus公司),细胞液氮冻存罐(Thermo公司),分析天平(上海天平仪器厂),Nanodrop2000(Thermo公司),实时荧光定量PCR仪(湖南达尔仪器有限公司),普通PCR仪(Eppendorf公司),制冷高速离心机(Eppendorf公司).
1.4 实验方法
1.4.1 HBV感染方法
用于实验感染细胞的HBV来自HepG2.2.15细胞上清(D型). 在培养HepG2.2.15细胞时,在培养基中加入终质量浓度为500 μg/mL的新霉素(G418)来维持HBV基因组的复制水平. 当HepG2.2.15细胞开始产生病毒时,用不加G418的培养基培养HepG2.2.15细胞,一边扩大培养细胞一边收集细胞上清,收集的细胞上清用0.45 μm微孔过滤器过滤,使病毒得以富集,最后测定病毒滴度. HBV按照MOI为20接种于HLCZ01细胞,病毒与细胞孵育过夜后,去除培养上清,用磷酸盐缓冲盐水(Phosphate Buffered Saline,PBS)洗涤3次,加入新鲜培养基继续培养至对应的时间点.
1.4.2 过表达质粒的构建与鉴定
为了构建Axin、PD-L1、SPOP、Cbl和HBX的过表达质粒,首先利用Primer Primer5设计PCR引物,然后从Huh7细胞中提取总RNA,利用其逆转录产物为模板来扩增Axin、PD-L1、SPOP、Cbl基因;同时从HBV感染的HLCZ01细胞内提取细胞总RNA来扩增HBX基因. 通过胶回收纯化PCR产物,最后利用TA克隆方法将扩增得到的DNA片段连入p3×Flag-CMV和pCDNA3.1a载体中,从而得到重组质粒p3×Flag-CMV-Axin、p3×Flag-CMV-PD-L1、p3×Flag-CMV-HBx、pCDNA3.1a-PD-L1、pCDNA3.1a-SPOP、pCDNA3.1a-Cbl,通过测序鉴定目的基因序列是否完全正确. PCR引物序列如表1所示.
1.4.3 Western blot实验
用含有蛋白酶抑制剂的RIPA Buffer裂解液裂解细胞,冰浴30 min,13 200 r/min离心15 min后收集蛋白. 根据试剂说明书的使用方法,用BCA(Bicinchoninic Acid)试剂法测定蛋白浓度. 取20 μg蛋白样品与2×Load Buffer等体积混合,在100 ℃金属浴中煮沸5 min之后上样,采用80 V恒压跑胶,待蛋白Mark分层后调至120 V恒压跑胶,根据Mark显示的位置,待目的蛋白到达合适位置后进行转膜. 100 V恒压转膜2 h,转膜成功后,以5%的脱脂牛奶封闭1 h,之后加入对应一抗4 ℃过夜孵育,二抗选用anti-mouse或anti-rabbit抗体室温孵育2~4 h. 将PVDF膜置于化学发光信号检测仪上,加入预先配制好的显影液曝光1~5 min,并保存蛋白印迹图片.
1.4.4 Real-time PCR 实验
使用Trizol试剂裂解细胞,采用氯仿抽提的方法提取细胞内总RNA,通过逆转录获得cDNA,用相对应的定量引物进行实时荧光定量PCR分析,探究目的基因在RNA水平的表达情况,所用方法参照试剂盒说明书操作. Real-time PCR 反应所用引物序列如表2所示.
1.4.5 统计学分析
所有实验数据均录入Excel文档中保存,对照组数据和处理组数据之间显著性差异分析采用学生双尾t值分析方法. 用*P<0.05、 **P<0.01和***P<0.001来表示显著性差异程度,其中P<0.05被认为具有统计学意义. 数据以means ± SD形式在图表中显示.
2 结果与结论
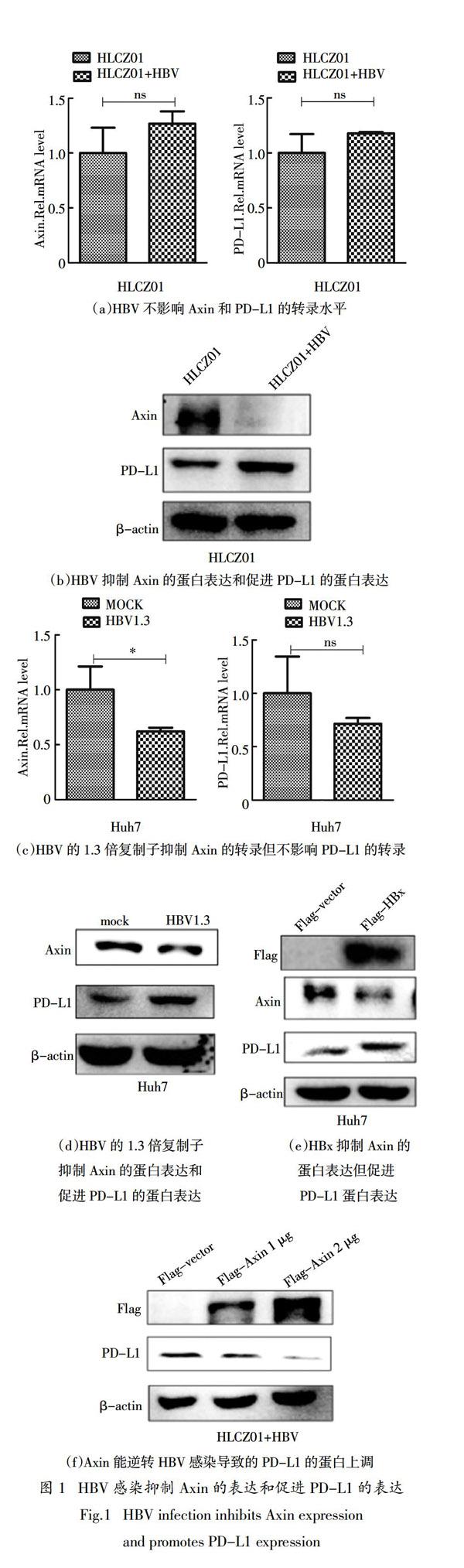
2.1 HBV感染抑制Axin的表达和促进PD-L1的
表达
Axin在WNT信号通路中起重要的调控作用[11],为了检测Axin在HBV调节抗病毒免疫过程中的作用,本文检测了HLCZ01细胞和HBV感染的HLCZ01细胞内Axin和PD-L1的表达,以探讨Axin在HBV感染过程中的潜在作用. 利用实时荧光定量(Real-time PCR)方法,以MOI为20的HBV感染HLCZ01细胞45 d,提取细胞总RNA和细胞总蛋白. 利用Real-time PCR方法,以未被HBV感染的HLCZ01细胞为对照,检测细胞内Axin和PD-L1的mRNA水平,发现HBV感染后不影响Axin和PD-L1的转录水平(图1(a)). 利用Western Blot方法,检测细胞内Axin和PD-L1的蛋白水平,发现HBV感染后抑制Axin蛋白的表达但促进PD-L1蛋白的表达(图1(b)). 为进一步验证这一实验结果,在Huh7细胞中转染表达HBV的1.3倍复制子的质粒,24 h以后提取细胞总RNA和细胞总蛋白. 利用Real-time PCR方法,检测细胞内Axin和PD-L1的mRNA水平,发现HBV的1.3倍复制子抑制Axin的转录但不影响PD-L1的转录(图1(c)). 借助Western Blot方法,发现转染了HBV的1.3倍复制子质粒的Huh7细胞内的Axin蛋白水平明显下调,而PD-L1的蛋白水平明顯上调(图1(d)). 在Huh7细胞中转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-HBx,48 h后收取细胞总蛋白,利用Western Blot方法,检测细胞内Axin和PD-L1的蛋白水平,发现转染了HBx质粒的Huh7细胞内Axin的蛋白水平下降,而PD-L1的蛋白水平升高(图1(e)). 基于上述实验结果,推测HBV导致Axin和PD-L1蛋白水平发生变化可能是通过HBx实现的. 此外,以MOI为20的HBV感染HLCZ01细胞45 d,然后转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin(1 μg或2 μg),48 h后收取细胞总蛋白,利用Western Blot方法,检测细胞内Axin过表达情况和PD-L1蛋白水平,研究发现在
HBV感染的HLCZ01细胞内过表达Axin质粒,能够逆转HBV感染引起的PD-L1蛋白水平降低现象(图1(f)). 由图1可知,在HBV感染肝细胞内,Axin蛋白水平与PDL1蛋白水平呈负相关性.
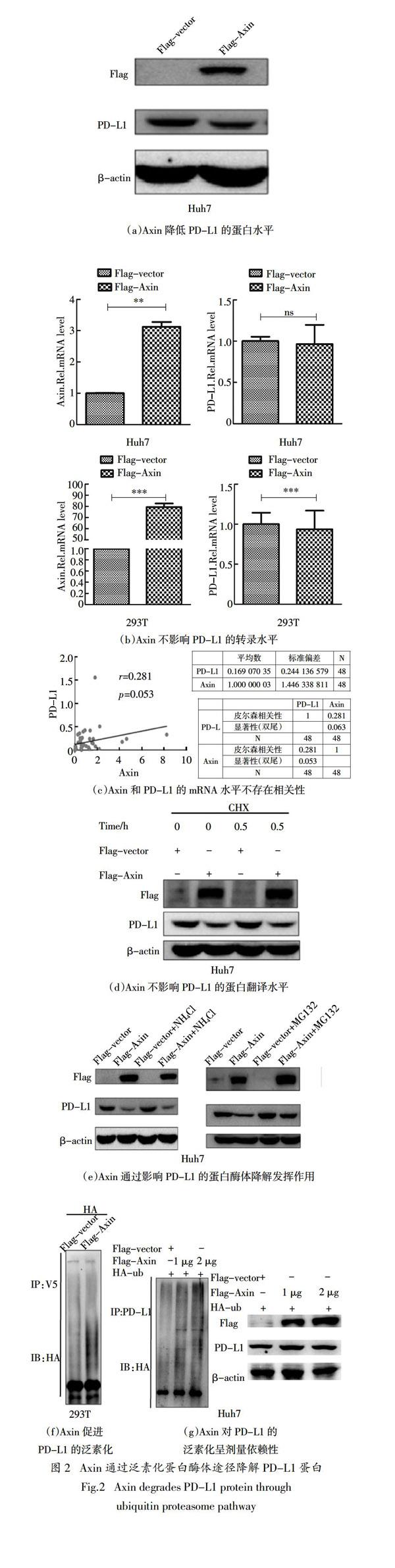
2.2 Axin通过泛素化蛋白酶体途径降解PD-L1
蛋白
为了进一步明确Axin与PD-L1之间的关系,在Huh7细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin,48 h后收取细胞总蛋白,利用Western Blot方法,检测细胞内Axin和PD-L1蛋白水平,发现Axin可降低细胞内PD-L1蛋白水平(图2(a)). 在Huh7和HEK293T细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin,48 h后收取细胞总RNA,利用Real-time PCR方法,检测细胞内Axin和PD-L1的mRNA水平,发现在Huh7和293T细胞中过表达Axin对PD-L1的转录水平并无明显影响(图2(b)). 利用从湖南省肿瘤医院收集48例肝癌病人癌旁组织样本,提取组织总RNA,利用Real-time PCR方法,检测组织内Axin和PD-L1的mRNA水平,并通过SPSS软件分析Axin与PD-L1之间的相关性,发现它们的mRNA并无相关性(图2(c)). 在Huh7细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin,48 h后加入放线菌酮素(100 μg/mL CHX终浓度),15 min和30 min后分别收取细胞总蛋白,利用Western Blot方法,检测细胞内Axin过表达情况和PD-L1蛋白水平,发现Axin对PD-L1的翻译水平没有影响(图2(d)). 最后,对其翻译后修饰水平进行探究. 在Huh7细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin,48 h后分别加溶酶体降解途径抑制剂(NH4Cl)[12]和蛋白酶降解途径抑制剂(MG132),处理6 h后收取细胞总蛋白,利用Western Blot方法,检测细胞内Axin过表达情况和PD-L1的蛋白水平,发现Axin可能通过影响PD-L1的蛋白酶体降解发挥作用(图2(e)). 另外,在HEK293T细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin和pCDNA3.1a-PD-L1,48 h后加蛋白酶降解途径抑制剂(MG132),处理6 h后收取细胞总蛋白,以V5抗体进行免疫共沉淀实验,检测细胞内PD-L1的泛素化水平,发现Axin能促进PD-L1的泛素化(图2(f)(g)). 在Huh7细胞中,转染质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin(1 μg或者2 μg)48 h后,在收取蛋白前6 h,加入蛋白酶降解途径抑制剂(MG132)培养细胞,收取的细胞总蛋白以PD-L1抗体进行免疫共沉淀实验,检测细胞内PD-L1的泛素化水平,发现Axin对PD-L1的泛素化呈剂量依赖性. 基于上述实验结果,认为Axin可能通过蛋白酶体途径降解PD-L1蛋白.
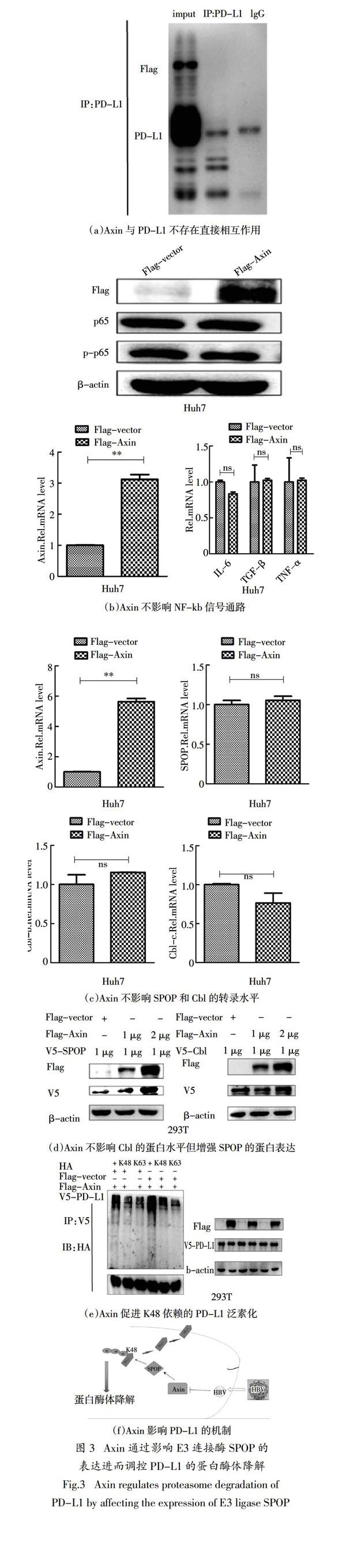
2.3 Axin通过影响E3连接酶SPOP的表达进而调
控PD-L1的蛋白酶体降解
蛋白与蛋白质之间的相互作用可能是通过直接或间接方式进行的. 为明确Axin对PD-L1蛋白的调控方式,首先,在HEK293T细胞中共转染带Flag标签的Axin和带V5标签的PD-L1,通过免疫共沉淀实验分析,发现Axin与PD-L1不存在直接相互作用(图3(a)). 间接调节PD-L1的泛素化作用可能通过两种方式,一种是调节其去泛素化酶的表达,另外一种是调节其泛素化酶的表达. NF-kb信号通路活化后,可增强PD-L1去泛素化酶的表达[13]. 将质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin转染至Huh7细胞,48 h后分别收取细胞总蛋白,利用Western Blot和实时荧光定量PCR方法,发现Axin对NF-kb信号通路的活化无作用(图3(b)). 有文献报道E3连接酶Cbl和SPOP可泛素化降解PD-L1[14-18]. 将质粒p3 × Flag-CMV-vector或p3 × Flag-CMV-Axin转染至Huh7细胞,48 h后收取细胞总RNA,利用Real-time PCR方法,检测Axin对PD-L1的E3连接酶Cbl和SPOP的mRNA水平的影响,发现Axin对这两种E3连接酶的mRNA水平并无影响(图3(c)). 另外,将质粒p3×Flag-CMV-vector或p3×Flag-CMV-Axin (1 μg或者2 μg)和pCDNA3.1a-Cbl或者pCDNA3.1a-SPOP转染至HEK293T细胞,48 h后收取细胞总蛋白,利用Western Blot方法,检测Axin对Cbl和SPOP蛋白水平的影响,发现Axin可增强SPOP的蛋白表达(图3(d)). 有文献报道PD-L1主要通过K48位和K63位进行泛素化降解[19-21],将质粒p3 × Flag-CMV-vector或p3 × Flag-CMV-Axin和pCDNA3.1a-PD-L1和野生型、K48或者K63的HA质粒转染至HEK293T细胞,以V5抗体进行免疫共沉淀实验,检测其对PD-L1蛋白泛素化的影响,发现Axin促进K48依赖的PD-L1泛素化降解(图3(e)).
综上所述,本文认为HBV可能通过其HBx下调Axin蛋白水平,降低PD-L1的E3连接酶SPOP蛋白水平,进而抑制K48依赖的PD-L1泛素化降解,导致HBV感染肝细胞内PD-L1蛋白含量增加(图3(f)).
3 讨 论
在HBV诱导的肝细胞癌中,癌组织中的Axin蛋白水平明显低于其邻近组织,但HBV下调Axin蛋白表达的机制尚不明确. 本文对HBV抑制Axin蛋白表達的机制进行了研究,发现HBx可能参与了HBV对Axin蛋白水平的下调作用. 文献[22-24]研究表明,在乙型肝炎病毒相关性肝癌组织中,CD8+T细胞功能异常且耗竭,其特征是PD-1高表达,干扰素-γ和肿瘤坏死因子分泌减少,但HBV感染诱导细胞内PD-L1表达的机制仍不清楚. 本文研究发现在HBV感染的肝细胞内,Axin蛋白表达明显下调而PD-L1蛋白表达显著增加. 通过相关细胞实验和临床数据统计表明,Axin不能调节WNT信号通路下游转录因子的表达进而影响PD-L1的转录水平. 另外,一个蛋白影响另外一个蛋白的表达,也有可能是调节它翻译后的降解水平来实现的. 通过添加相关抑制剂,发现Axin通过影响PD-L1的蛋白酶体降解途径,降低病毒感染细胞内PD-L1水平. 进一步研究发现Axin可能通过影响PD-L1的E3连接酶SPOP的表达,进而发挥其促进PD-L1泛素化降解作用,但Axin影响SPOP表达的具体机制仍有待进一步研究. 另外,本研究只选择了与PD-L1相关的两种E3连接酶进行了研究,Axin是否对作用于PD-L1的其他E3连接酶有影响还有待进一步探讨.
参考文献
[1] TRÉPO C,CHAN H L Y,LOK A.Hepatitis B virus infection[J].Lancet,2014,384(9959):2053—2063.
[2] CAVARD C,TERRIS B,GRIMBER G,et al.Overexpression of regenerating islet-derived 1 alpha and 3 alpha genes in human primary liver tumors with beta-catenin mutations[J].Oncogene,2006,25(4):599—608.
[3] CUI J,ZHOU X D,LIU Y K,et al.WNT signaling in hepatocellular carcinoma:analysis of mutation and expression of beta-catenin,T-cell factor-4 and glycogen synthase kinase 3-beta genes[J]. Journal of Gastroenterology and Hepatology,2003,18(3):280—287.
[4] GILES R H,VAN ES J H,CLEVERS H.Caught up in a WNT storm:WNT signaling in cancer[J].Biochimica et Biophysica Acta,2003,1653(1):1—24.
[5] CHEN L,HAN X.Anti-PD-1/PD-L1 therapy of human cancer:past,present,and future[J]. Journal of Clinical Investigation,2015,125(9):3384—3391.
[6] SPRANGER S,BAO R Y,GAJEWSKI T F.Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity[J].Nature,2015,523(7559):231—235.
[7] XU C X,FILLMORE C M,KOYAMA S,et al.Loss of Lkb1 and pten leads to lung squamous cell carcinoma with elevated PD-L1 expression[J].Cancer Cell,2014,25(5):590—604.
[8] CHEN D S,IRVING B A,HODI F S.Molecular pathways:next-generation immunotherapy:inhibiting programmed death-ligand 1 and programmed death-1[J].Clinical Cancer Research,2012,18(24):6580—6587.
[9] GLICKMAN M H,CIECHANOVER A.The ubiquitin-proteasome proteolytic pathway:destruction for the sake of construction[J].Physiological Reviews,2002,82(2):373—428.
[10] YANG D,ZUO C,WANG X,et al.Complete replication of hepatitis B virus and hepatitis C virus in a newly developed hepatoma cell line[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(13):1264—1273.
[11] LI J Q,QUAN H,LIU Q,et al.Alterations of axis inhibition protein 1 (AXIN1)in hepatitis B virus-related hepatocellular carcinoma and overexpression of AXIN1 induces apoptosis in hepatocellular cancer cells[J].Oncology Research,2013,20(7):281—288.
[12] BURR M L,SPARBIER C E,CHAN Y C,et al.CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity[J].Nature,2017,549(7670):101—105.
[13] LIM S O,LI C W,XIA W,et al. Deubiquitination and stabilization of PD-L1 by CSN5[J]. Cancer Cell,2016,30(6):925—939.
[14] WANG S,XU L,CHE X F,et al. E3 ubiquitin ligases Cbl-b and c-Cbl downregulate PD-L1 in EGFR wild-type non-small cell lung cancer[J].FEBS Letters,2018,592(4):621—630.
[15] QU X J,ZHANG Y,LI Y C,et al.Ubiquitin ligase Cbl-b sensitizes leukemia and gastric cancer cells to anthracyclines by activating the mitochondrial pathway and modulating AKT and ERK survival signals[J].FEBS Letters,2009,583(13):2255—2262.
[16] LI H,XU L,LI C,et al.Ubiquitin ligase Cbl-b represses IGF-I-induced epithelial mesenchymal transition via ZEB2 and microRNA-200c regulation in gastric cancer cells[J].Molecular Cancer,2014,13:136—148.
[17] GAN W J,DAI X P,LUNARDI A,et al. SPOP promotes ubiquitination and degradation of the ERG oncoprotein to suppress prostate cancer progression[J].Molecular Cell,2015,59(6):917—930.
[18] BARBIERI C E,BACA S C,LAWRENCE M S,et al.Exome sequencing identifies recurrent SPOP,FOXA1 and MED12 mutations in prostate cancer[J].Nature Genetics,2012,44(6):685—689.
[19] KOMANDER D,RAPE M.The ubiquitin code[J].Annual Review of Biochemistry,2012,81:203—229.
[20] SKAAR J R,PAGAN J K,PAGANO M. SCF ubiquitin ligase-targeted therapies[J]. Nature Reviews Drug Discovery,2014,13(12):889-903.
[21] LI C W,LIM S O,XIA W,et al.Glycosylation and stabilization of programmed death ligand-1 suppresses T-cell activity[J].Nature Communications,2016,7:12632.
[22] SHUAI Z,LEUNG M W,HE X,et al. Adaptive immunity in the liver[J]. Cellular & Molecular Immunology,2016,13(3):354—368.
[23] ROBINSON M W,HARMON C,O'FARRELLY C. Liver immunology and its role in inflammation and homeostasis[J].Cellular & Molecular Immunology,2016,13(3):267—276.
[24] WHERRY E J.T cell exhaustion[J]. Nature Immunology,2011,12(6):492—499.
收稿日期:2020-05-03
基金项目:国家自然科学基金资助项目(81730064,81571985),National Natural Science Foundation of China(81730064,81571985);國家科技重大专项 (2017ZX10202201),National Science and Technology Major Project(2017ZX10202201)
作者简介:朱海珍(1969—),男,湖北襄阳人,湖南大学教授,博士
通信联系人,E-mail:zhuhaizhen69@yahoo.com

