花鲈病毒感染后qPCR 内参基因的筛选与应用
杨宏伟 刘振兴 郝 乐 马江耀 梁志凌 马艳平 曹俊明
(1.仲恺农业工程学院,广东广州510225;2.广东省农业科学院动物卫生研究所 广东省畜禽疫病防治研究重点实验室农业农村部兽用药物与诊断技术广东科学观测实验站,广东广州510640;3.广东海洋大学,广东湛江524088)
花鲈(Lateolabrax maculatus)属鲈形目(perci⁃formes),鮨科(serranidae),花鲈属(Lateolabrax),据《2020中国渔业统计年鉴》数据,2019年我国花鲈年产量超过18.02万吨,是我国重要性经济养殖鱼类[1-2]。近年来我国花鲈养殖密度不断提高,养殖规模不断扩大,传染性疾病给花鲈养殖业造成严重经济损失[3]。本实验室前期从患病花鲈中分离、鉴定了一株虹彩病毒,主要衣壳蛋白基因(MCP)以及ATP 酶基因(ATPase)的进化分析表明,该病毒属虹彩病毒科(iri⁃doviridae),细胞肿大病毒属(Megalocytivirus),与真鲷虹彩病毒(red sea bream iridovirus,RSIV)表现出较高的同源性[4]。细胞肿大病毒属病毒的宿主范围极为广泛,造成了花鲈、真鲷(Pagrus major)[5]、斑石鲷(Opleg⁃nathus punctatus)[6]和尖吻鲈(Lates calcarifer)[7]等养殖鱼类的巨大经济损失[8-9]。
qPCR是基因定量表达研究中最常用和最有效的工具[10]。在qPCR技术中,选择合适的内参基因至关重要。而目前的研究中内参基因往往未经验证就作为稳定内参用于相关试验之中[11-12]。为减小试验误差,需要选择稳定的内参基因对试验数据进行校正和标准化处理,以获得更为准确的基因表达变化数值[13]。
RNA 聚 合 酶Ⅱ(RNA polymerase II,RNAPoLⅡ)、次黄嘌呤磷酸核糖基转移酶(hypoxanthine gua⁃nine phosphoribosyl transferase1,HPRT)、α微管蛋白(α-Tubulin,TUBA)、β肌动蛋白(β-Actin,ACTB)、18S核糖体RNA(18S ribosomal RNA,18S rRNA)、β2-微球蛋白(β-2-microglobulin,B2M)、延伸因子1α(elon⁃gation factor-1-α,EF1A)及核糖体蛋白L7(ribosomal protein L7,RPL7)作为内参基因获得广泛应用[14-16]。在抗病毒饲料研究中,qPCR 技术也成为评价饲料抗病毒效果以及揭示抗病毒机制的重要手段。例如,孙博超等[17]、孙艳等[18]开展的益生菌饲料抗白斑综合症病毒(white spot syndrome virus,WSSV)研究中,以EF-α、ACTB 作为内参基因分析了凡纳滨对虾(Lito⁃penaeus vannamei)免疫基因表达规律,进一步评价含益生菌饲料的保护作用[17-18];以GAPDH为内参基因研究了日粮中添加枯草芽孢杆菌(Bacillus subtilis)对樱桃谷肉鸭免疫相关基因的表达,阐明了益生菌饲料的保护机制[19]。目前,花鲈在不同盐度应激条件下的内参基因稳定性进行了比较研究[15],但LMIV 感染后花鲈候选内参基因的稳定性尚不清楚,影响了通过qP⁃CR方法分析花鲈免疫相关基因的表达以及病毒增殖的研究,也制约了抗病毒饲料的评价。
本研究在花鲈人工感染LMIV后选取花鲈脑、鳃、肝、脾、头肾、后肾、肌肉、中肠、胃、胸鳍、心和肾细胞共12 个组织/细胞,分别采用GeNorm、NormFinder、Best⁃Keeper软件[20-22]对RNAPoL Ⅱ、HPRT、TUBA、ACTB、18S rRNA、B2M、EF1A、RPL7内参基因表达稳定性进行分析。以筛选的内参基因为基础建立qPCR 方法,对病毒ORF92R、ORF101R、ORF407R、ORF543R基因的表达进行分析[23],进一步评估了RNAPoL Ⅱ、RPL7作为病毒感染后稳定内参基因的可靠性。
1 材料与方法
1.1 实验材料
健康花鲈(15±1)g 由广东省农业科学院动物科学研究所惠赠,在循环水养殖系统中暂养1 周,水温保持在25~30 ℃,期间采用PCR方法进行虹彩病毒检测[4]。LMIV 由本研究室分离并保存,花鲈肾细胞系(K2)由本研究室建立并保存[4]。
1.2 样品采集
随机选取12 尾花鲈分为攻毒组和对照组(6 尾/组)。攻毒组腹腔注射K2 细胞增殖的LMIV(100 TCID50/100 μl),对照组腹腔注射L-15 培养基(Gibco)。待攻毒花鲈出现体色发黑、游动异常等发病症状时(90 h),对攻毒及对照组花鲈分别取样。花鲈用50 μl/l 丁香酚(eugenol)麻醉后,分离脑、鳃、肝、脾、头肾、后肾、肌肉、中肠、胃、胸鳍和心脏组织,置于无RNA酶离心管,保存于液氮备用。LMIV感染K2细胞90 h后取样并保存于液氮。
1.3 总RNA提取及cDNA合成
按照Total RNA Kit II(OMEGA)操作说明书,提取上述12 个组织的总RNA,用1.5%琼脂糖凝胶电泳和超微量核酸检测仪确定RNA 的质量与浓度。取1 μg RNA 按照HiScript®II 1st Strand cDNA Syn⁃thesis Kit (+gDNA wiper)试剂盒(Vazyme)说明书进行cDNA合成。
1.4 引物设计及合成
RNAPoL Ⅱ、HPRT、TUBA、ACTB、RPL7、18S rRNA、B2M、EF1A 8个候选内参基因序列引用自Wang等[15],由生工生物工程股份有限公司合成,引物序列见表1。根据RSIV(GenBank:AB104413.1)序列设计引物(表2),扩增LMIV的ORF92R、ORF101R、ORF407R和ORF543R。
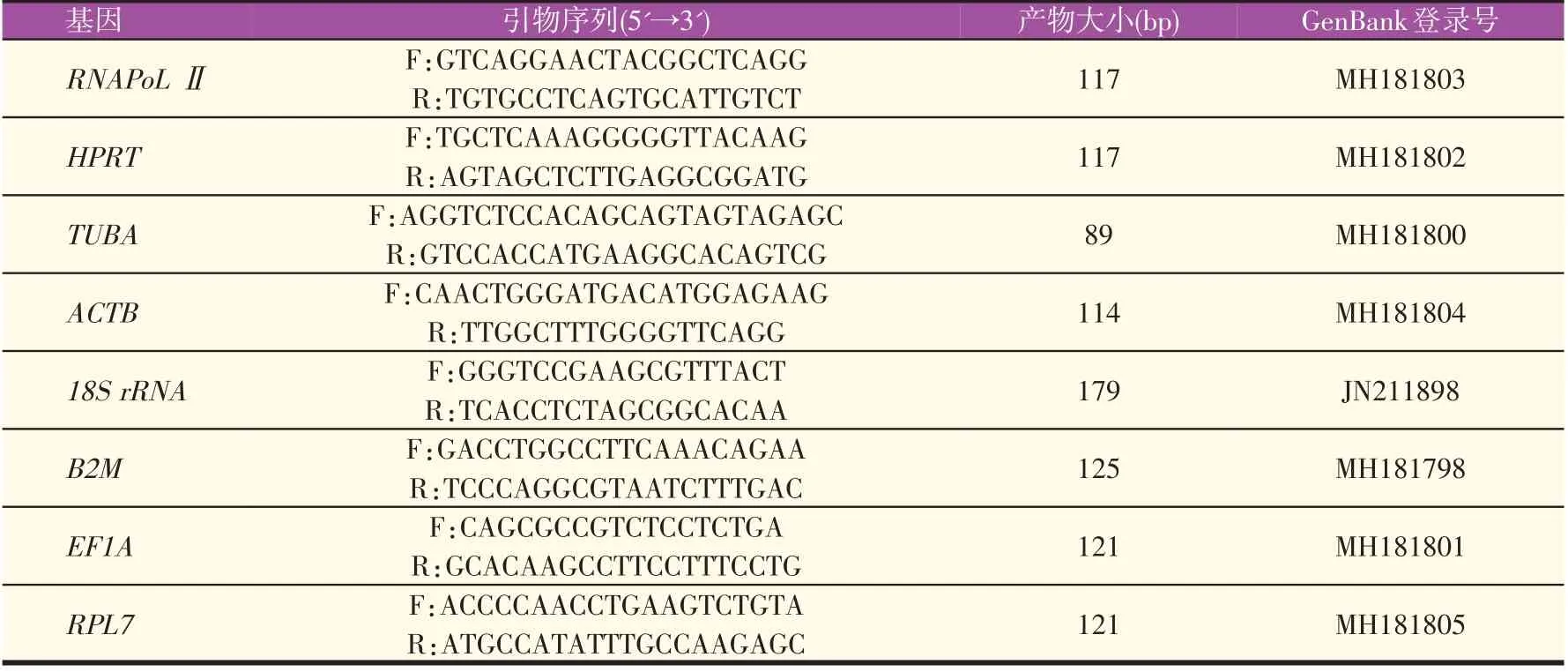
表1 内参基因引物序列

表2 LMIV 引物序列
1.5 基因的扩增及克隆载体构建
以1.3 节制备的cDNA 为模板,采用1.4 节中合成的引物进行PCR 扩增。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s,40 个循环;72 ℃延伸2 min,4 ℃保存。取5 μl PCR 产物进行1.5%琼脂糖凝胶电泳检测;其余PCR产物采用AXYGEN PCR Cleanup Kit 试剂盒纯化,纯化产物连接pMD-18T载体(Takara),转化至大肠杆菌Top10 感受态细胞。筛选PCR 阳性克隆菌株送广州擎科生物技术有限公司测序。测序后,将包含上述载体的Top10扩大培养,提取质粒。
1.6 qPCR 方法建立以及内参基因、病毒基因的表达分析
提取1.5 节中成功构建的重组质粒,核酸定量后制备标准曲线[24],计算扩增效率(E 值)。采用建立的qPCR 方法,分析1.2 节样品中内参基因、病毒基因的表达。qPCR 体系参照AceQ®qPCR SYBR®Green Master Mix 说明书,扩增程序为:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,共40 个循环;产物进行融解曲线分析:95 ℃15 s、60 ℃60 s、95 ℃15 s。每个样本设3个技术重复。
1.7 内参基因稳定性的软件分析
采用GeNorm、NormFinder、BestKeeper 软件分析1.6中qPCR结果(cycle threshold,Ct值)。每组基因的所有样品的Ct值减去该组基因样品中最小的Ct值,得到△Ct值并转换成相对表达量2-△Ct值[25]。将2-△Ct导入GeNorm软件,通过每组基因样品的相对表达量2-△Ct计算候选基因的平均表达稳定度(M),M值越小,基因表达越稳定,以此筛选出稳定的两个基因,并引入内参基因标准化因子的配对变异Vn/n+1值来判断攻毒组和对照组中最合适的内参基因个数,如果Vn/n+1大于0.15,内参基因最合适的个数为n+1个,若Vn/n+1小于0.15,则最合适内参基因个数应为n[26]。NormFinder软件分析与GeNorm软件相似,将相对表达量2-△Ct值导入,得出表明稳定程度的S值,S值越小内参基因越稳定。BestKeeper软件根据SD值和CV值作为第一次评估标准[14],即SD值<1,且越小则内参基因越稳定;再根据基因之间的相关系数(r),以及p(p-value)值进一步筛选出相关性基因组合。最后根据GeNorm、NormFinder和BestKeeper软件的排序结果,对内参基因稳定性进行综合排序。
1.8 稳定性内参基因的应用
准备5瓶长至80%~90%融合度的K2细胞,0.05%胰酶(Gibco)消化,L-15 培养基悬浮细胞,2 ml/孔接种至12 孔板,26 ℃培养箱培养,待细胞完全贴壁并长至75%融合度后,加入200 TCID50LMIV 病毒液(200 μl/孔),设置3组生物学重复,分别在10、24、48、72、96 h和120 h收集细胞,参照1.3节提取RNA进行反转录。以1.7节筛选的稳定表达的基因作为内参,采用1.6 节建立的qPCR 方法分析ORF92R、ORF101R、ORF407R、ORF543R基因的表达。
2 结果
2.1 花鲈攻毒结果
PCR 结果显示实验所用鱼未感染虹彩病毒。花鲈攻毒24 h 后体色变黑,游动缓慢,解剖观察发现脾脏肿大。采集脾组织提取DNA 进行PCR 鉴定,结果呈阳性(图1)。
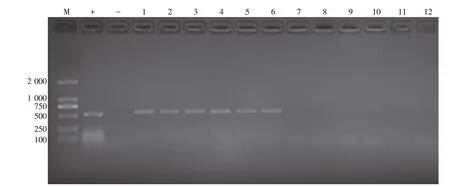
图1 攻毒组和对照组花鲈脾LMIV检测电泳图
2.2 引物特异性分析
本实验扩增的8 个花鲈候选内参基因以及4 个LMIV基因的PCR产物测序后进行Blast比对确定为目的片段;8个内参基因以及4个病毒基因PCR产物的熔解曲线均为单峰(图2),扩增效率均在96%~102%(表3)。
2.3 内参基因稳定性分析
2.3.1 GeNorm软件分析
GeNorm分析显示8个候选基因在正常花鲈不同组织/细胞中表达稳定性为:RNAPoL Ⅱ=RPL7>18S rRNA>HPRT>ACTB>B2M>TUBA>EF1A,其中RNAPoL Ⅱ和RPL7是表达最稳定的内参基因;攻毒后8个内参基因表达稳定性为:RNAPoL Ⅱ=HPRT>RPL7>TUBA>ACTB>18S rRNA>B2M>EF1A,其中RNAPoL Ⅱ和HPRT的M值最小,是最稳定的内参基因,EF1A 表达稳定性最差(图3A);根据配对变异Vn/n+1值可以筛选多个内参基因,最小配对变异值V2/3>0.15,且V3/4<0.15,因此选取3个内参基因(图4);因此在LMIV感染后选取3个内参基因(图4A),即RNAPoL Ⅱ、RPL7及HPRT。
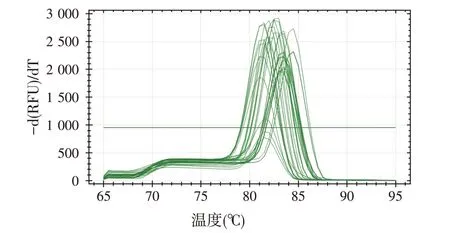
图2 8个内参基因及4个病毒基因熔解曲线
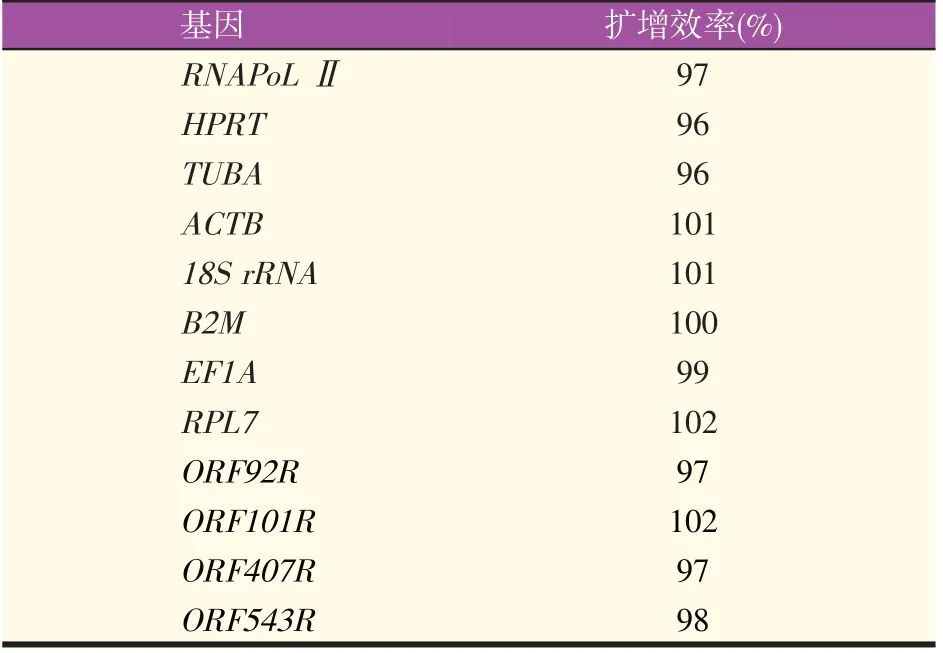
表3 基因扩增效率
2.3.2 NormFinder软件分析
NormFinder 软件结果显示18S rRNA在正常花鲈不同组织/细胞中表达最稳定(图5A),在攻毒后RPL7表达最稳定,EF1A表达稳定性最差(图5B)。
2.3.3 BestKeeper软件分析
BestKeeper 软件分析结果表明攻毒组中,TUBA、ACTB、18S rRNA、B2M、EF1A基因的SD>1,均不适合作为内参基因使用,对照组中HPRT、TUBA、ACTB、B2M、EF1A基因的SD>1,也不适合作为内参基因。8个内参基因在攻毒后花鲈不同组织/细胞中RPL7的SD值最小(0.68);18S rRNA在对照组中SD值最小(0.66)(表4)。

图3 GeNorm分析候选参考基因的平均表达稳定值

图4 Vn/n+1比值分析
2.3.4 综合分析
多种算法结合分析筛选的稳定内参基因组合可以准确校准系统误差。三种算法综合分析正常花鲈中RNAPoL Ⅱ、18S rRNA、RPL7 基因表达相对稳定;攻毒组中RNAPoL Ⅱ、RPL7、HPRT表达相对稳定(表5)。
2.4 筛选的稳定内参基因评价LMIV增殖的研究
采用qPCR 方法选取稳定表达的RNAPoL Ⅱ、RPL7及LMIV侵染后不稳定表达的18S rRNA分别作为内参基因分析LMIV ORF92R、ORF101R、ORF407R、ORF543R 的表达。结果表明,4 个病毒基因以RNAPoL Ⅱ、RPL7 为内参其表达趋势呈现更好的一致性,而以18S rRNA作为内参其表达趋势不稳定、表达量波动较大(图6)。
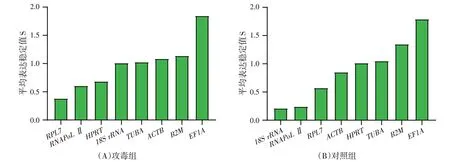
图5 NormFinder分析候选参考基因的平均表达稳定值
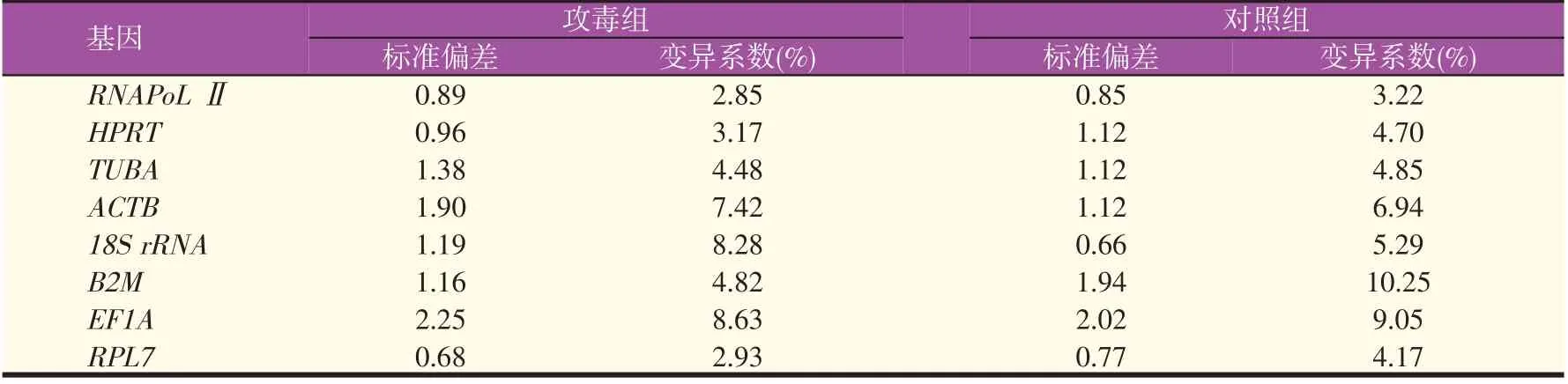
表4 BestKeeper分析结果
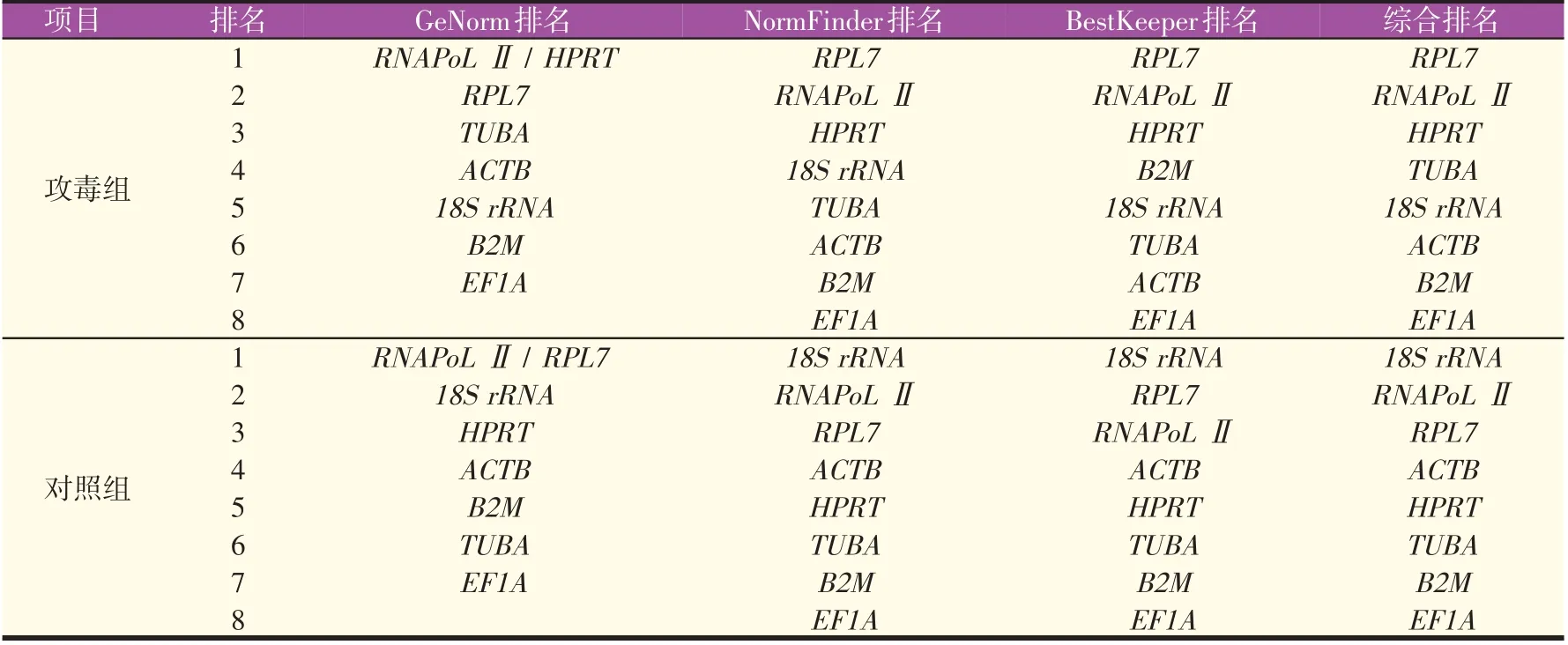
表5 内参基因表达稳定性综合分析排名
3 讨论
3.1 花鲈候选内参基因在病毒感染后其表达稳定性存在差异
研究表明选用单个内参基因进行归一化分析会导致相对较大的误差,选用多个内参基因进行评价可以获得更为准确的归一化因子[22]。内参基因在不同物种和不同环境中表达稳定性变化较大,可能是因为内参基因不仅仅参与细胞基础代谢还具有其他功能[27-29]。18S rRNA在机体各组织中表达量都很高,由于mRNA 变化相对较小,18S rRNA 经常作为mRNA定量研究的内参基因[30]。本研究结果显示花鲈在感染LMIV前后,3个软件分析结果显示,18S rRNA在正常花鲈不同组织/细胞中表达稳定性均高于其他基因。18S rRNA是自然条件下花鲈不同组织中最稳定的内参基因[15],这与本研究结果相似;在牙鲆的相关研究中,18S rRNA 是胚胎阶段表达最稳定的内参基因[31]。但在LMIV 感染后,GeNorm 和NormFinder 软件结果显示18S rRNA 表达稳定性发生明显变化。RNAPoL Ⅱ是编码mRNA 转录的主要功能酶。RNAPoL Ⅱ在不同组织的mRNA转录中均能被检测到并显示出较低的转录变异,是最合适的内参基因[32];上述结论与本研究结果一致,花鲈感染LMIV 前后RNAPoL Ⅱ均表现出较高的稳定性,是LMIV 感染后表达最稳定的内参基因;在其他鱼类,例如条石鲷(Oplegnathus fasciatus)[33]、大菱鲆(Scophthalmus maxi⁃mus)[34]中RNAPoL Ⅱ也是最合适的内参基因。RPL7作为一种核糖体蛋白不仅参与蛋白质合成,而且还参与细胞生长、分化、凋亡等[35],与花鲈在盐度胁迫中内参基因的稳定性研究结果类似,在LMIV 感染前后RPL7均可作为稳定内参基因使用。病原感染后鱼类的候选内参基因表达可能出现较大变化,HPRT 在LMIV 感染前表达并不稳定,但在感染后却表现出较高的稳定性。稳定内参基因的筛选也可能面临困难,例如条石鲷[33]、大菱鲆[34]、牙鲆(Paralichthys oliva⁃ceus)[36]等在细菌感染后,未能筛选出在所有组织中均能稳定表达的内参基因。
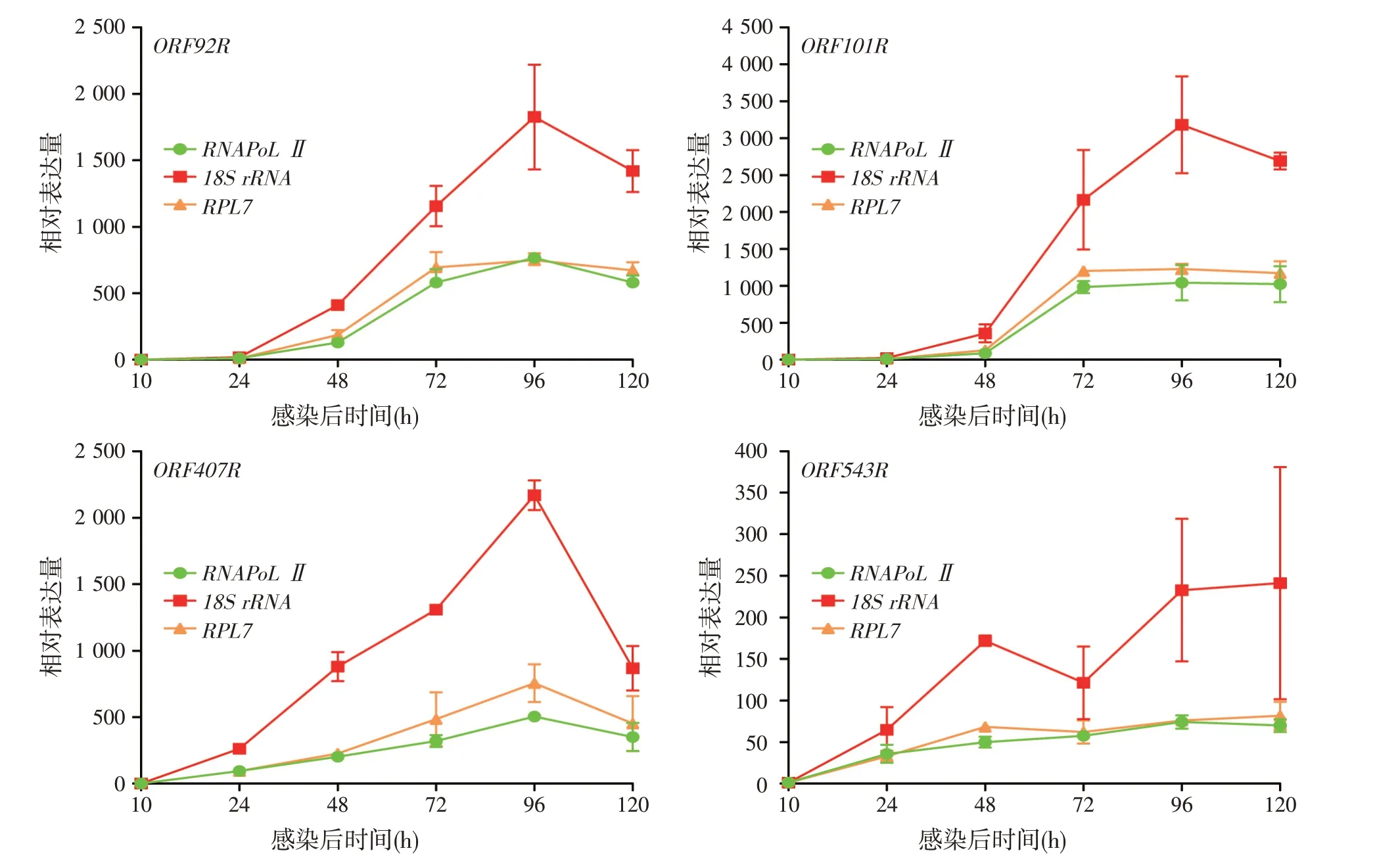
图6 4个LMIV基因的表达
3.2 内参基因在抗病毒功能饲料评价中的应用
在水产抗病毒饲料的评价中,稳定的内参基因是准确分析基因表达变化的基础。投喂含复合芽孢杆菌饲料并用WSSV 感染凡纳滨对虾,选取EF-α作为内参基因分析了含半胱氨酸的天冬氨酸蛋白酶(Cys⁃teinyl aspartate specific proteinase, Caspase)基因及硫氧还原蛋白(Thioredoxin, Trx)基因表达[17];用益生菌饲料投喂选取ACTB 作为内参分析了凡纳滨对虾血淋巴中酚氧化酶、超氧化物歧化酶及溶菌酶基因在WSSV刺激后的表达规律[18];选取GAPDH作为稳定内参基因分析了樱桃谷肉鸭投喂枯草芽孢杆菌饲料、用禽致病性大肠杆菌及新型鸭呼肠弧病毒(Novel duck reovirus,NDRV)感染后脾、胸腺中免疫基因的表达变化[19]。这些研究均为进一步分析含益生菌饲料在抗病毒感染保护作用提供了科学依据。因此稳定内参基因的筛选可以为花鲈抗病毒饲料开发中检测花鲈免疫基因表达及病毒增殖提供科学依据。
4 结论
本研究采用GeNorm、NormFinder、BestKeeper 软件对花鲈感染LMIV 前后适合qPCR 的内参基因进行了筛选并应用于4 个LMIV 病毒基因表达分析,证实RNAPoL Ⅱ、RPL7基因可以作为稳定内参,为进一步研究抗病毒饲料的作用效果及机制提供了基础。

