N,N-二乙基-1,4-苯二胺分光光度法游离氯和总氯校准曲线绘制探讨
孙世兵,李伟清,张秀丽,杨 美,冯成德
(四川合力新创环境监测有限公司,四川 彭州 611930)
前 言
N,N-二乙基-1,4-苯二胺分光光度法为目前测定水中游离氯和总氯标准方法之一,相关标准有《HJ 586-2010 水质 游离氯总氯的测定 N,N-二乙基-1,4-苯二胺分光光度法》[1]《GB/T 5750.11-2006 生活饮用水标准检验方法 消毒剂指标(1)》[2]《水和废水监测分析方法》(第四版)[3]等。
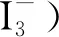
1 主要试剂及设备
碘酸钾(GR 成都市科隆化学品有限公司)
碘化钾(AR 成都市科隆化学品有限公司)
硫酸(AR 成都市科隆化学品有限公司)
DPD硫酸盐(AR 天津傲然精细化工研究所)
氢氧化钠(AR 成都市科隆化学品有限公司)
次氯酸钠(AR 成都市科隆化学品有限公司)
无水磷酸氢二钠(AR 成都市科隆化学品有限公司)
磷酸二氢钾(GR 成都市科隆化学品有限公司)
Na2-EDTA(AR 成都市科隆化学品有限公司)
天平(0.1mg,上海菁科仪器有限公司)
紫外可见分光光度计(UV-1601,北分瑞利分析仪器有限公司)
电热恒温水浴锅(HH-S8型A,北京科伟永
兴仪器有限公司)
2 反应机理与操作过程概述
KIO3+5KI+3H2SO4=3I2+K2SO4+3H2O
分别吸取一定量碘酸钾标准溶液于容量瓶中,加入适量水及硫酸溶液,1min后加入氢氧化钠溶液,定容至100mL。在锥形瓶中加入缓冲溶液和DPD溶液,于1min内将上述标准系列溶液加入锥形瓶中,混匀后于515nm用10mm比色皿测定其吸光度,于60min内完成比色分析。
3 操作过程中影响因素分析
根据碘类氧化还原反应速度及碘的保存条件,笔者经多次实验研究了有可能影响实验结果的因素有体系反应温度、反应时间、光照条件等。
3.1 反应温度对吸光度的影响
因碘化钾-碘酸钾混合溶液在酸性条件下生成的碘在高温下易损失及容量瓶不宜高温使用,故只在体系反应温度为15℃、20℃、25℃、30℃、35℃、40℃、45℃时对高低浓度曲线各最高浓度点按标准要求进行了吸光度测试,其吸光度值经空白校正后结果如表1。

表1 不同反应温度下高低浓度曲线最高浓度点吸光度值Tab.1 The absorbance value of the highest concentration point in the high and low concentration curve under different reaction times
经以上吸光度测试发现反应温度升高对吸光度值有积极作用,笔者按标准要求碘化钾-碘酸钾混合溶液在酸性条件下反应1min,体系温度在测试区间时各校准曲线最高浓度点吸光度值明显太低,根据朗柏比尔定律实验室温度常规控制范围,则选定一适宜的反应温度并控制反应时间就非常必要。
3.2 反应温度及时间共同作用对吸光度的影响
根据氧化原反应机理及能斯特方程和质量作用定律[4]得知影响氧化还原反应进程的反应温度、时间、浓度等因素中,推动反应进行的可能是某单一因素主导,也可能多个因素共同作用结果。故再次将反应温度及时间对吸光度的影响进行综合测量。
因体系中物质活度(浓度)与反应进程成正相关且碘的保存与时间成负相关,则只需在选定温度下对曲线最低浓度点进行反应时间测试即能确定曲线全浓度点的必要反应时间,对曲线最高浓度点的最长保存时间即能确定曲线全浓度点的最长保存时间。故取低浓度曲线最低点(0.2mg/L)、高浓度曲线最高点(1.5mg/L)为目标,在反应温度为15℃、20℃、25℃、30℃、35℃、40℃、45℃下分别进行了反应时间为1min、10min、20min、30min、40min、50min、60min吸光度三平行测试,其测试结果取均值绘制吸光度图1、图2。
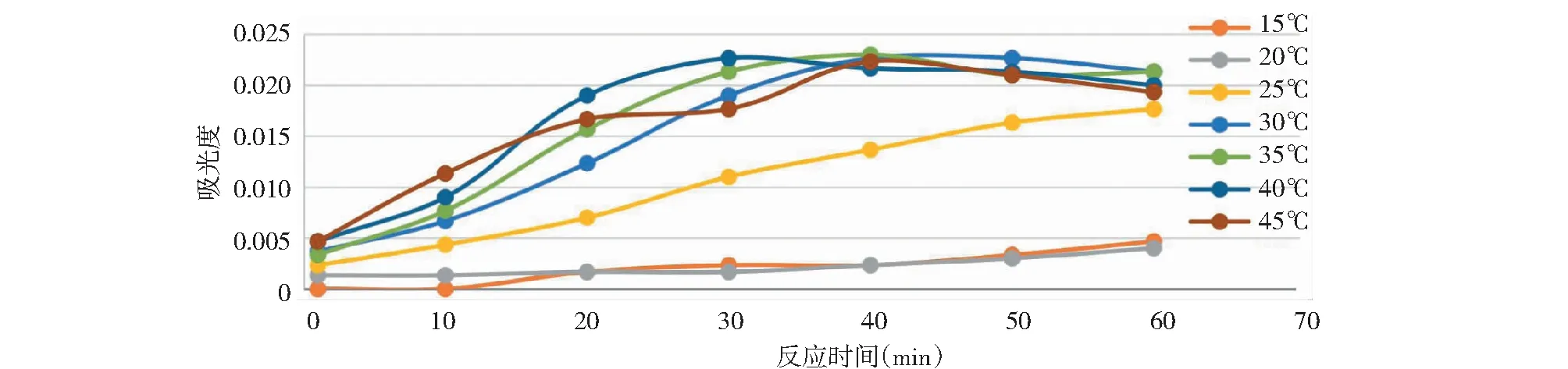
图1 0.2mg/L标准溶液在不同反应温度、不同反应时间下吸光度值Fig.1 The absorbance value of the 0.2mg/L standard solution at different temperatures andlength
图2 1.5mg/L标准溶液在不同反应温度、反应时间下吸光度值Fig.2 The absorbance value of the 1.5mg/L standard solution under different temperatures and reaction times
经以上吸光度测试发现曲线浓度最低点在反温度为30℃~40℃,反应时间为30~40min范围内有最大吸光度值;高浓度曲线最高点在反温度为25℃~30℃,反应时间为30~40min范围内有最大吸光度值;各浓度点随着温度升高及时间延长吸光度出现降低。笔者理解为在测试温度区间内反应温度太高反应时间太长生成的碘有损失导致吸光度下降。故笔者认为该试验在反应温度为30℃、反应时长为40min下有最大吸光度,该条件有利于校准曲线的绘制。
3.3 光照条件对吸光度的影响
根据碘易光解的理化性质, 则有必要对碘化钾-碘酸钾混合溶液在酸性条件下生成的碘的有效保存进行闭光和不闭光对比测试,在30℃下选用体系在棕色容量瓶和白色容量瓶内反应40min进行对比测试。测试结果如表2。

表2 反应温度30℃下闭光及不闭光反应高低浓度曲线吸光度值Tab.2 The absorbance value of the high and low concentration curve at 30℃ with and without light
经以上对照发现,碘化钾-碘酸钾混合溶液在酸性条件下闭光反应对吸光度有一定积极作用,各浓度点吸光度均有不同程度提高。
4 存在问题、方法改进措施及方法准确性验证
4.1 存在问题
综上实验数据表明,笔者认为标准(《HJ 586-2010》[1])对曲线绘制(碘化钾-碘酸钾混合溶液在酸性条件下反应)条件如反应温度、反应时间、光照条件未做明确规定,存在以下可以改善的内容。
(1)高低浓度曲线各点吸光度在反应温度高于40℃时生成的碘明显损失导致吸光度偏低,高浓度曲线最高点表现更为明显,在反应温度低于25℃时体系中碘的生成明显受到抑制,在低浓度曲线最低点表现更为明显;
(2)高低浓度曲线各点吸光度亦受反应时间的影响,在标准规定的1min后测试几乎不能达到标准要求,低浓度曲线各点吸光度更为明显;
(3)碘化钾-碘酸钾氧化还原反应体系与光照强度成负相关,生成的碘不够稳定易光解导致吸光度偏低;
(4)并由以上单一或综合因素导致校准曲线相关系数低于0.999。
4.2 方法改进措施
针对上述反应时间、温度、光照条件3个方面的操作进行如下改进。
(1)用30℃恒温水浴控制碘化钾-碘酸钾氧化还原反应体系温度;
(2)控制反应时间为40min;
(3)反应在闭光条件下进行。
笔者按上述改进后条件进行实验,测试结果经空白校正后如表3、图3。

表3 方法改进后高低浓度曲线吸光度及方程Tab.3 The absorbance curve and equation of the high and low concentration by improved methods
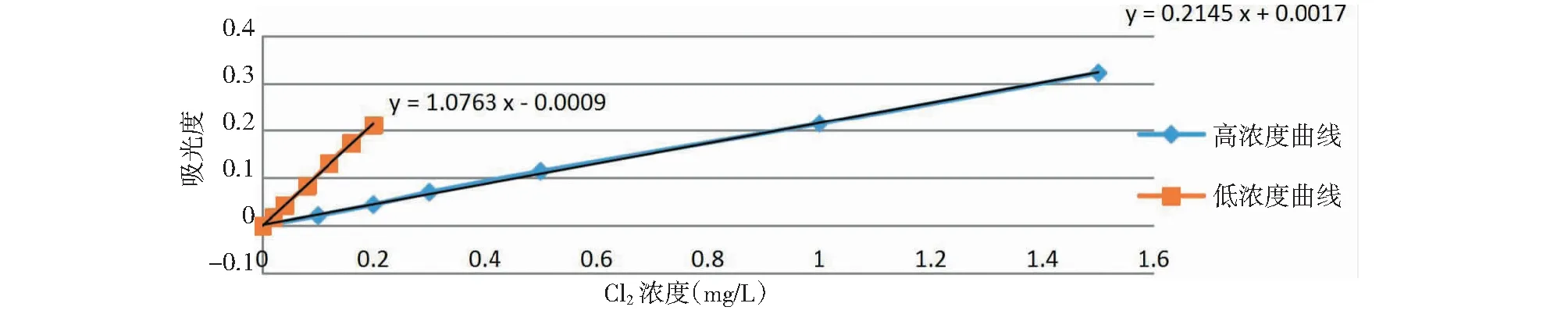
图3 方法改进后低、高浓度曲线Fig.3 The Absorbance curve of the high and low concentration by improved methods
4.3 改进后方法准确性验证
4.3.1 检出限测试
笔者按改进后方法进行检出限测试,低、高浓度曲线空白测试结果如表4。
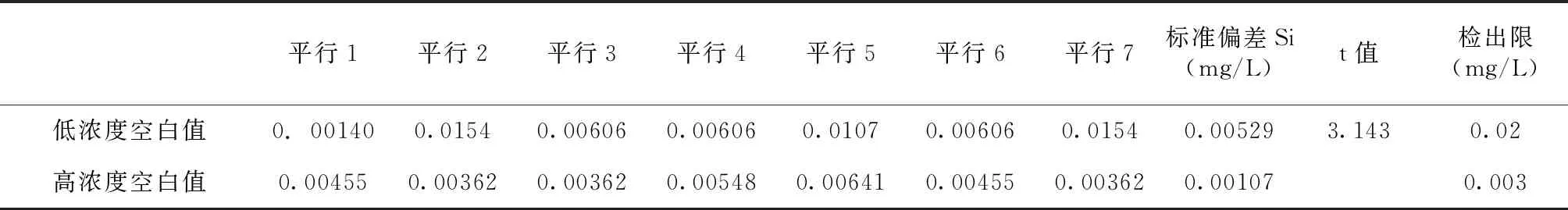
表4 低、高浓度曲线空白测试Tab.4 The blank test of low and high concentration curve
4.3.2 质控样测试
按改进后方法对低浓度质控样(P243-917)、高浓度质控样(编号为BY400166)进行验证测试,测试结果如表5。

表5 质控样测试Tab.5 The test results of the quality control samples)
4.3.3 实际样品加标回收率测试
分别取地表水、工业废水、生活污水100mL样品进行余氯含量三平行测试,另取3份分别加入含有效氯10.0μg的标准溶液(编号:GBW(E)082217)做加标测试,其测试结果如表6。
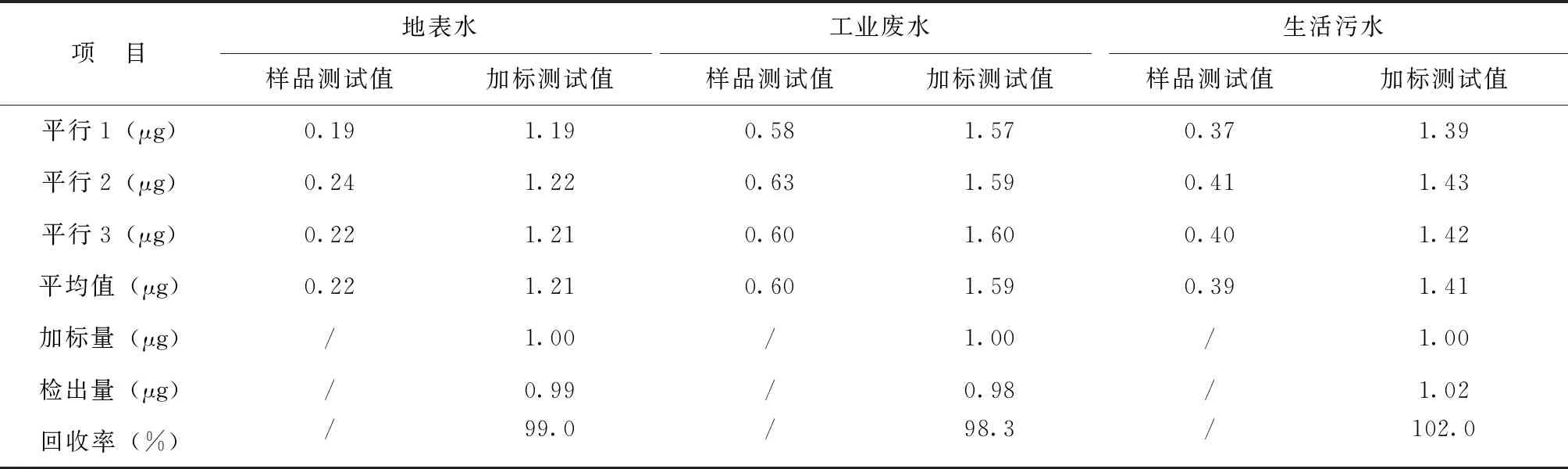
表6 实际样品加标回收率测试Tab.6 Standard recovery test of actual sample
经质控样及加标回收测试数据表明,该改进方法符合标准要求,具有很高准确度。
5 结 论
5.1 经笔者研究表明,将标准《HJ 586-2010》[1]中高低浓度曲线制作时碘化钾-碘酸钾体系反应温度控制在30℃,反应时间为40min,闭光条件下测试各浓度点吸光度均为其最大值。
5.2 方法经改进后,高浓度曲线检出限为0.02mg/L,低于标准(《HJ 586-2010》)中检出限0.03mg/L;低浓度曲线检出限为0.003mg/L,低于标准(《HJ 586-2010》)中检出限0.004mg/L;
5.3 方法经改进后所得低、高浓度曲线相关系数分别为0.999 6、0.999 7,满足标准大于0.999的要求。
5.4 经质控样及加标回收率测试合格,说明改进后的方法有很高的准确度。

