牙周炎微环境下静态牵张力对牙周膜干细胞中炎性细胞因子分泌的影响
蔡东轩,孙唯夫,金作林,刘 佳
牙周病是最常见的口腔疾病之一,在我国大约有90%的人患有牙周疾病,其中能造成深部牙周组织结构破坏的牙周炎发病率大于40%,有活动性牙周炎的人群比例也在逐年上升[1]。牙周炎造成的牙齿伸长、咬合创伤等情况会影响口颌系统功能和颜面美观,因此而寻求正畸治疗的患者越来越多。牙周炎症未得到有效控制的情况下对牙周炎患者进行正畸治疗会出现牙槽骨的快速吸收,这一情况大幅增加了治疗难度和风险,因此在正畸治疗前以及期间有效控制牙周炎症是十分必要的[2]。但即便牙周炎症得到控制,不可逆的牙周附着丧失等情况也会使得牙周病患者的牙周组织改建再生能力下降,正畸预后较差,其具体机制尚不清晰。作为牙周组织间充质干细胞之一的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)因具有高度的增殖、自我更新和多向分化能力[3],自发现以来就是修复与再生领域的研究热点[4],是参与牙周组织再生的主要候选干细胞[5]。然而牙周炎微环境对PDLSCs的生物学功能有很大影响,体外培养发现炎症微环境下PDLSCs的聚集受到显著抑制,成骨分化能力和免疫调节能力受损,其相应标记基因ALP、RUNX2、OCN的mRNA和蛋白表达水平下调[6-7]。本课题组前期研究发现牙周炎微环境会导致PDLSCs成骨能力下降,其功能损害无法通过体外培养扩增而恢复,但改善其所处的微环境,例如将其与牙囊细胞共培养时,可以恢复牙周炎环境下受损的再生能力[8]。因此,改善PDLSCs的炎症损伤对牙周组织的改建和再生至关重要。
正畸治疗时牙齿周围骨组织吸收与再生的平衡是正畸治疗的关键,炎症因子IL-1β、IL-6、TNF-α和抗炎因子IL-10作为重要的信号调节分子参与了骨和牙周膜重塑的过程[9]。与正常情况相比,牙周病组织来源的牙周膜干细胞(periodontal ligament stem cells obtained from periodontal tissues of periodontitis patients, PPDLSCs)中TNF-α、IL-1β和IL-6的表达明显上升[10],高表达的IL-1β通过激活核因子-κB(NF-κB)和有丝分裂原激活蛋白激酶(MAPK)抑制PDLSCs的成骨能力[11]。但目前关于PPDLSCs在牵张力加载情况下炎性细胞因子的表达情况仍不清晰,因此本实验建立不同静态牵张力(static mechanical strain, SMS)加载下正常来源的牙周膜干细胞(periodontal ligament stem cells obtained from healthy periodontal tissues, HPDLSCs)和PPDLSCs模型,通过Elisa检测炎性细胞因子表达水平,探明不同SMS加载条件下PPDLSCs的炎症反应情况与HPDLSCs的差异,为临床上牙周炎患者的正畸治疗提供一定的生物学依据。
1 材料与方法
1.1 试剂与仪器
α-MEM培养基(Gibco,美国);Ⅰ型胶原酶、胰蛋白酶(Sigma,美国);胎牛血清(四季青公司,中国);鼠抗人 CD105、CD29、CD14 (Bioscience,美国);ELISA 检测试剂盒(R&D Systems,美国);Bioplate 6孔板、FX-4000T Tension Plus Unit(Flexcell,美国);CO2孵箱(Heraeus,德国);紫外线分光光度仪(Eppendorf,德国);倒置相差显微镜及照相系统(Olympus,日本);台式水平离心机(Beckman,美国);流式细胞仪(Beckman-Coulter,美国);6 孔培养板(Falcon,美国)。
1.2 实验方法
1.2.1 HPDLSCs和PPDLSCs的获取 HPDLSCs来源于10例准备在空军军医大学第三附属医院正畸科接受正畸治疗且牙周组织健康的患者,平均年龄(37.9±7.2)岁,女5例,男5例。PPDLSCs 来源于8例准备在空军军医大学第三附属医院正畸科接受正畸治疗且被诊断为中度慢性牙周炎的患者,平均年龄(38.9±7.9)岁,女4例,男4例,诊断标准参考1999年国际研讨会所制定的牙周病分类标准[12]:探诊出血阳性,牙周袋深度≤6 mm,附着丧失 3~4 mm,X线片显示牙槽骨水平吸收达根长的 1/3~1/2。上述患者均无系统性疾病、吸烟史和用药史,因正畸原因拔除前磨牙或第三磨牙。所有患者对本研究知情同意。
1.2.2 细胞的原代培养和纯化 拔出患者牙齿后,立即放入含双抗的α-MEM培养液中转移至超净工作台。使用含双抗的0.01 mol/L的PBS避开近牙龈侧和根尖部位,反复冲洗离体患牙至牙根洁净,刮取根中1/3的牙周膜组织,用细滴管转移至离心管中,加入适量3 g/L Ⅰ型胶原酶,放入细胞培养箱中每隔5 min震荡1次,共消化15 min。终止消化反应后低速离心机800 r/min离心5 min,倒掉上清液保留底部沉淀组织。再次加入少许α-MEM,将离心管底部沉淀组织吹打均匀后接种于6孔板上,上盖无菌盖玻片以防止组织漂浮,加入少量α-MEM培养液覆盖6孔板底层,将6孔板置于恒温37 ℃ CO2孵箱,3天换培养液1次,约14 d细胞在六孔板底达到80%汇合。25 g/L胰蛋白酶1 mL孵箱内消化2 min,镜下观察细胞脱离贴壁呈球状后加入等量含10%胎牛血清(FBS)的α-MEM中和胰蛋白酶消化反应,细滴管反复吹打六孔板底壁至所有细胞脱离贴壁,将含细胞的培养液转移至离心管中以800 r/min离心8 min,弃掉上清液后加入α-MEM制备单细胞悬液,以每瓶1 000个的密度将细胞接种于10 cm培养皿中。10 d左右,低密度接种的细胞形成克隆团块,将不同患者来源的多克隆细胞消化混合后传至第3代,用于后续实验。
1.2.3 流式细胞仪检测间充质干细胞表面标记物 取上步实验所得第3代HPDLSCs和PPDLSCs,加入PBS冲洗,胰蛋白酶消化后,低速离心机中800 r/min离心5 min,保留管底沉淀,加入适量培养液吹打均匀。调整细胞密度为每200μL 5×105个,分别加入2 μL鼠抗人CD105、CD29、CD14抗体,4 ℃条件下避光孵育1 h,用含30 mL/L胎牛血清的PBS冲洗3遍,流式细胞仪检测CD分子的表达情况。
1.2.4 茜素红染色检查成骨分化能力 取第3代HPDLSCs及PPDLSCs,胰酶消化后制备成单细胞悬液,六孔板每孔接种2×105个细胞,用含10% FBS的α-MEM培养,待细胞达到80%汇合后,更换为含10% FBS的α-MEM,β-甘油磷酸钠10 mmol/L,维生素C 50 mg/L,地塞米松100 nmol/L的成骨诱导液,每3 d更换1次成骨诱导液。21 d后弃掉成骨诱导液,PBS冲洗3遍,4%多聚甲醛固定30 min,使用PBS洗净,加入茜素红染液,放置于37 ℃孵箱内30 min,吸弃染液,PBS冲洗2遍,显微镜下拍照。
1.2.5 构建SMS加载装置 取第3代HPDLSCs及PPDLSCs,制备单细胞悬液,以每孔3×105个的密度接种于Bioflex 6孔板,无血清饥饿培养使细胞同步化,24 h后更换10% FBS α-MEM培养基培养,运行FX-4000T软件,设置频率为0.1 Hz,力的种类为静态牵张力(static mechanical strain,SMS),力值分别为 6%、8%、10%、12%和14%,加力时间为12 h[13-14]。对照组HPDLSCs及PPDLSCs以同样密度接种于Bioflex 6孔板后不加力,放置于孵箱内静置培养12 h,收集实验组和对照组HPDLSCs及PPDLSCs用于后续实验。
1.2.6 Elisa检测炎性细胞因子分泌水平 吸弃上步实验所得细胞的原培养液,每孔加入2 mL新鲜的α-MEM培养液,静置24 h后收集上清液;设置8个标准孔,建立标准曲线;每孔按操作次序分别加入100 μL待检测样品,50 μL第一抗体,100 μL酶标抗体,100 μL底物液,50 μL终止液后,用分光光度仪在450 nm处检测各孔吸光度。
1.3 统计学方法
所有数据以平均值±标准差表示,采用SPSS 16.0进行分析,两对照组间比较,使用两独立样本t检验,加力组及对照组各组间比较,使用One-way ANOVA及Bonferroni post hoc test检验,P<0.05为有统计学意义。
2 结 果
2.1 HPDLSCs 及 PPDLSCs 形态学观察
倒置显微镜下观察多克隆来源的 PDLSCs,均呈间充质干细胞样的长梭形,漩涡状密集排列,肉眼观察HPDLSCs组和PPDLSCs组形态上无明显差异(图1)。
A:第3代HPDLSCs;B: 第3代PPDLSCs
2.2 流式细胞仪检测间充质干细胞表面标记物
HPDLSCs组和PPDLSCs组均强阳性表达间充质干细胞表面标记物CD105和CD29,而造血系标记物CD14则呈阴性表达。此外,强阳性表达标记物CD105和CD29在HPDLSCs组中的表达比率均显著高于PPDLSCs组(图2)。
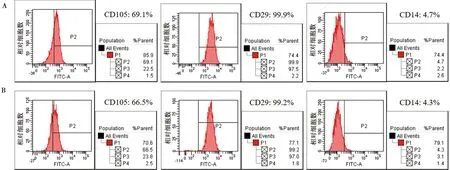
A: HPDLSCs间充质干细胞表面标记物表达情况;B: PPDLSCs间充质干细胞表面标记物表达情况
2.3 HPDLSCs 和 PPDLSCs成骨能力鉴定
21 d成骨诱导后镜下观察显示PDLSCs呈复层生长,并形成散在红色矿化结节。HPDLSCs组中矿化结节多且面积大,染色较深;PPDLSCs组中矿化结节面积小且分散,染色较浅(图3)。

A: HPDLSCs茜素红染色情况;B: PPDLSCs茜素红染色情况
2.4 Elisa检测炎性细胞因子分泌情况
PPDLSCs组中4种炎性细胞因子的表达水平均高于HPDLSCs组(P<0.05)(图4)。牵张力加载后,HPDLSCs和PPDLSCs组中IL-1β和TNF-α的表达水平略有升高,但不同力值组间炎性细胞因子的表达无明显差异(P<0.05)(图4A、B);而 IL-6和IL-8 的表达水平在牵张力加载后发生了大幅上调(P<0.05)(图4C、D),增加倍数达数百倍。同时在HPDLSCs 组,当力值低于12%时,加力组各组间IL-6和IL-8的表达水平无明显差异,但当力值高于12%时,IL-6和IL-8的表达水平显著上升(P<0.05)(图4);而在 PPDLSCs 组,6%和8%的牵张力值对IL-6和IL-8表达水平的影响基本无区别,但当力值大于8%,IL-6和IL-8的表达水平会随着力值的增大而提升(P<0.05)(图4C、D)。
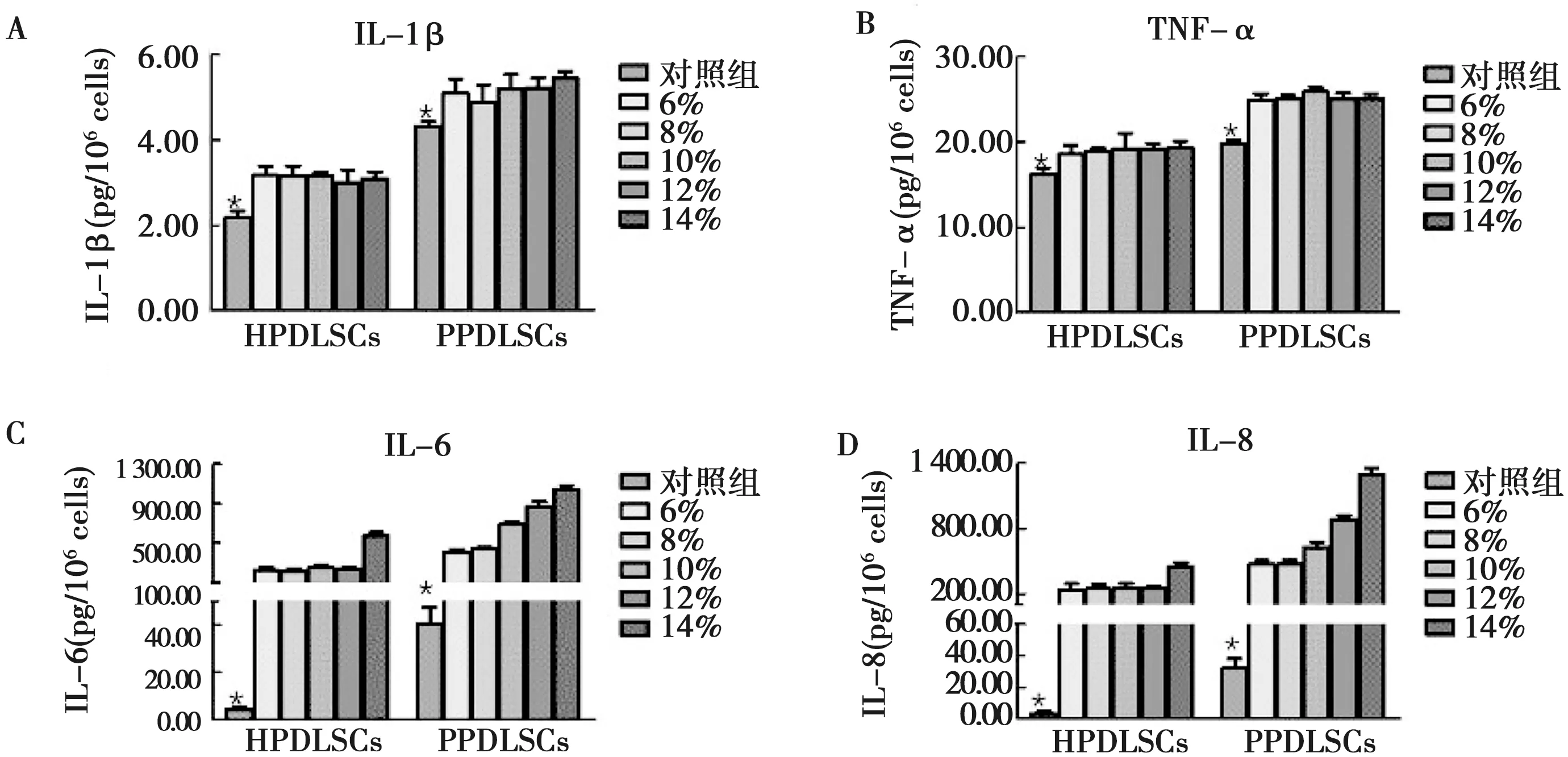
A: IL-1β的分泌水平;B: TNF-α的分泌水平;C: IL-6的分泌水平;D: IL-8的分泌水平;*: P<0.05
3 讨 论
临床上牙周炎的分级有轻度、中度和重度[15]。轻度牙周炎患者炎症表现不明显,不利于HPDLSCs和PPDLSCs 的生物学差异分析,而重度牙周炎患者因严重的牙槽骨吸收和附着丧失,牙周膜所剩无几,很难获得PDLSCs,因此我们选择中度牙周炎患者作为PPDLSCs供体。已有研究表明供体年龄也会影响PDLSCs的生物学特性[16],为了控制年龄因素对实验产生的影响,对PDLSCs供体的年龄进行筛选,确保两组年龄间无统计学差异。
以往文献中常采用力值为12%的SMS对PDLSCs进行机械刺激[17-18]。考虑到临床上牙周病患者对于正畸力较健康患者更加敏感,力值偏大经常会导致牙周组织的快速吸收,本研究中假设受到牙周病微环境损害的PPDLSCs,对SMS较HPDLSCs更为敏感。同时为了观察HPDLSCs 和PPDLSCs在较小力值和过大力值时的反应,故围绕12%构建了力值为6%、8%、10%、12%、14%的SMS加载系统。
间充质干细胞表面标记物的表达强度在一定程度上表明间充质干细胞干性的强弱[19]。HPDLSCs和 PPDLSCs组中 CD109、 CD29 均呈强阳性表达,说明细胞来源正确。定量分析显示, CD109、CD29 这两种标记物在 HPDLSCs组中的表达程度均高于 PPLDSCs组,这一结果可能与间充质干细胞干性受到炎症微环境损伤有关[20]。茜素红染色检验HPDLSCs和PPDLSCs成骨分化能力的实验结果进一步支持这一推论。
正畸牙齿的移动依赖于牙周组织吸收与形成的平衡,力加载作用下牙周组织中体液重新分布并出现局部缺氧的情况,进而引发无菌性的炎症反应,最终导致压力区破骨细胞的激活和张力区成骨细胞的聚集。同时正畸治疗下的牙周组织改建也取决于牙周组织中的MSC正常发挥免疫调节功能[21]。文献表明牙周组织长期处于炎症微环境中,正常成骨破骨平衡很容易被打破,具体表现为成骨能力下降[22-23]而破骨能力增加[24],导致牙周组织丧失。炎性细胞因子过多的分泌会导致牙周组织的损害,因此为了更好的牙周改建效果应该最大程度地保持炎性细胞因子的分泌平衡,本研究从这一角度切入,重点关注 SMS 对 HPDLSCs 和 PPDLSCs 炎性细胞因子分泌的影响。根据实验结果,对HPDLSCs 施加的力值不宜大于 12%,对 PPDLSCs 而言,牙周病的炎症微环境使其细胞功能受损,对SMS的耐受性明显低于HPDLSCs,若对其施加和HPDLSCs同等的力值,则会导致更多炎性细胞因子的释放,进一步抑制其成骨能力,激活其破骨能力。本研究还发现不同的炎性细胞因子对SMS的敏感性有差异,不同级别SMS加载下,IL-1β和TNF-α的分泌量略有增加,且各组间无明显差异,然而IL-6和IL-8的分泌量上调程度最高可达数百倍。根据实验结果我们猜测这两种炎性细胞因子很可能在正畸力介导下牙周组织改建的炎症反应中发挥了重要的作用。
综上所述,本研究发现牵张力加载下PPDLSCs中炎性细胞因子IL-1β、TNF-α、IL-6和IL-8的分泌水平相比HPDLSCs更高,其中不同力值组间IL-6和IL-8的分泌水平有较大差异,当力值大于8%时,IL-6和IL-8的分泌水平会随着力值的增大而提升。此发现为临床上牙周炎患者对正畸力较健康患者更敏感,更容易出现牙周组织快速吸收,提供一定的理论依据,对于牙周炎患者进行正畸治疗时,要慎重选择适宜的力值,必要时可以缩短牙周炎患者的回访时间,及时地评估患者的牙周状况,以便随时更改治疗计划,防止牙周组织出现不可逆的破坏。

