三氧化二砷对体外人小肠癌HIC细胞增殖和凋亡的影响*
杨云洪,尹朝晖,张汝一,颜登国,徐伟,赵洋,李国胜
(贵州医科大学附属医院 肛肠外科,贵州 贵阳 550001)
小肠癌是一种少见的恶性肿瘤,占消化道恶性肿瘤的1%~2%[1-2]。近年来,随着检查技术的进步和饮食结构的改变,小肠癌的发病率呈逐年升高趋势[3-4]。目前小肠癌的治疗仍以手术为主,然而确诊时多为晚期,总体预后较差,5年生存率低[5],因此如何寻求有效治疗小肠癌的新药物已经成为了目前研究的热点。三氧化二砷(arsenic trioxide,ATO)是中药砒霜的主要成分,古代主要用于治疗梅毒、瘟疫及疟疾等[6-8]。上世纪70年代,ATO首次应用于血液系统恶性肿瘤的治疗,并取得了显著的疗效[9]。近年研究陆续表明,ATO在治疗肝癌、结肠癌等多种实体瘤的过程中同样发挥着巨大的抗肿瘤作用[10-12]。然而由于小肠癌的发病率低,可供研究的临床资料较少[13],目前国内外关于ATO是否同样具有抗小肠肿瘤作用的研究尚未见报道。因此,本实验拟通过探讨ATO在体外对人小肠癌HIC细胞增殖和凋亡的影响,为ATO应用于临床提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞株及主要试剂 人小肠癌HIC细胞株购自美国ATCC细胞库,改良型RPMI-1640培养基、0.25%胰蛋白酶及双抗(青霉素、链霉素)均购自美国HyClone公司,胎牛血清购自美国Gibco公司。
1.1.2主要仪器 TGL-低速台式离心机(上海医用仪器厂),Millipore超纯水仪(美国 Millipore公司),超净工作台(苏净集团安泰公司),1 000、200及20 μL微量可调加样器(上海金花),0.5和2.5 μL微量可调加样器(德国Eppendorf公司),2300型隔水式电热恒温培养箱(美国SHELLAB公司),倒置显微镜(日本尼康公司),E-Plate 16检测板和xCELLigence RTCA DP实时无标记细胞分析仪(杭州艾森生物有限公司),FACSCanto Ⅱ流式细胞仪(美国BD公司)。
1.2 方法
1.2.1人小肠癌HIC细胞的复苏和培养 复苏冻存的HIC细胞,加入含 10%胎牛血清、1%双抗(100 U/mL青霉素和链霉素)的改良型RPMI-1640培养液中,5%CO2、37 ℃恒温培养。每24 h加培养液,48 h更换培养液,取对数期生长的细胞用于后续研究。
1.2.2实时无标记细胞分析(real-time label-free cell analysis,RTCA)系统动态监测ATO对HIC细胞的毒性作用 取生长状态良好的对数期HIC细胞,调整细胞悬液浓度为1×108/L,向E-Plate 16检测板中加入培养基50 μL并测定背景阻抗值,取出E-Plate 16检测板,向各孔中加入100 μL调整好的细胞悬液(细胞量为5~10×102/孔),将检测板放回RTCA仪,5%CO2、37 ℃恒温培养中孵育24 h,各孔分别加10、15、20、40及60 μmol/L ATO处理作为实验组,加等量磷酸盐缓冲液(phosphate buffer saline,PBS)作为空白对照组。E-Plate 16检测板再次放回RTCA仪,监控时长120 h、间隔30 min,连续监测并记录细胞指数(cell index,CI)值,通过RTCA 系统动力学变化反应曲线反映各孔HIC细胞的生长状况,并计算ATO对人小肠癌HIC细胞作用24和36 h时的增殖抑制率[细胞增殖的抑制率(%)=(空白对照组CI值-实验组CI值)/对照组CI值×100%。
1.2.3流式细胞仪(flow cytometer,FCM)检测HIC细胞的凋亡 取处于对数期HIC细胞,培养48 h,分别加10、15、20及40 μmol/L ATO处理作为实验组,加等量PBS作为空白对照组,5%CO2、37 ℃恒温培养48 h,以不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的0.25%胰酶消化后收集细胞,将细胞密度调整为1×109/L,PBS洗涤2次,1×Binding Buffer缓冲液100 μL重悬细胞。各管中各加碘化丙啶(propidium iodide,PI) 5 μL和Annexin V-FITC染料室温避光孵育15 min,加1×Binding Buffer缓冲液300 μL终止,用流式细胞仪检测细胞凋亡情况。
1.3 统计学分析

2 结果
2.1 ATO对人小肠癌HIC细胞增殖的影响
RTCA系统动态监测结果,经过10、15、20、40及60 μmol/L ATO作用120 h,各实验组HIC细胞CI值均较空白对照组下降,且随着ATO浓度的增加,下降的趋势更明显。见图1。
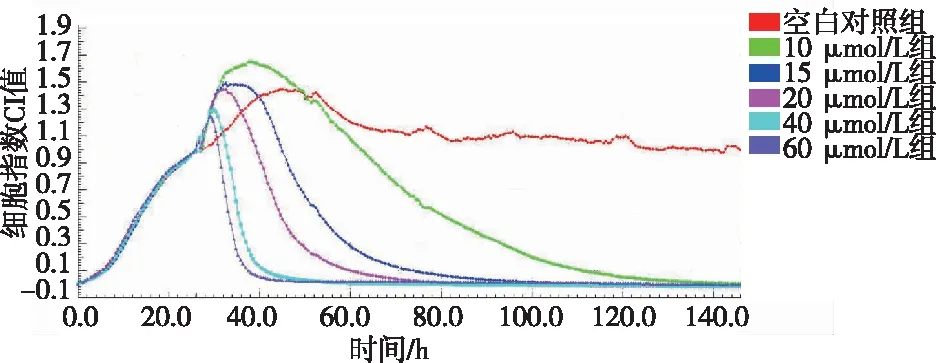
图1 不同ATO浓度抑制HIC细胞增殖的实时监测Fig.1 Real-time monitoring inhibitory HIC cell proliferation induced by ATO with indicated concentrations
2.2 不同浓度ATO对人小肠癌HIC细胞增殖的抑制率
不同浓度ATO对HIC细胞作用24和36 h时的增殖抑制率结果显示,增殖抑制率随着ATO浓度增加而增高(P<0.05),且随着ATO作用时间的延长而增高(P<0.05);当ATO浓度为60 μmol/L时,ATO对小肠癌HIC细胞作用24及36 h时的增殖抑制率均接近100%。见表1。
表1 不同ATO浓度处理后HIC细胞的抑制率Tab.1 The inhibitory rates in HIC cell proliferation induced by ATO with indicated
2.3 流式细胞仪检测人小肠癌HIC细胞的凋亡
通过FITC标记的Annexin V抗体和PI双染色,流式细胞仪检测结果显示,在流式细胞图结构中,右下(lower right,LR)象限表示早期凋亡细胞,右上(upper right,UR)象限表示中晚期凋亡细胞,将LR+UR作为总凋亡细胞,结果显示经10、15、20及40 μmol/L ATO对HIC细胞作用48 h后的总凋亡率均高于空白对照组,差异均有统计学意义(P<0.05),且随着ATO浓度的升高,凋亡率亦增高(P<0.05)。见图2。
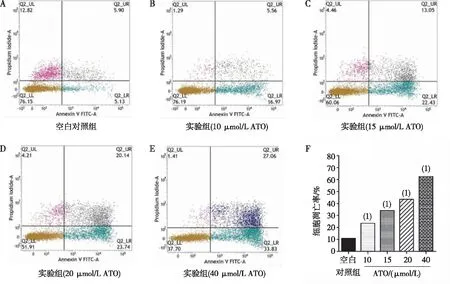
注:A、B、C、D及E分别为不同浓度ATO作用HIC细胞48 h的凋亡流式细胞检测结果,F为不同浓度ATO作用HIC细胞48 h的各组细胞凋亡率;(1)与空白对照组比较,P<0.05。图2 不同浓度ATO 处理后HIC细胞的凋亡率Fig.2 The apoptotic rates in HIC cells induced by ATO with indicated concentrations
3 讨论
2000年,美国食品药品管理局(food and drug administration,FDA)正式批准ATO用于临床治疗早幼粒细胞白血病(acute promyelocytic leukemia,APL),治愈率近 90%[14]。ATO不仅在白血病的治疗中有显著的疗效,对其他血液系统恶性肿瘤及多种实体瘤也具有明显的抗肿瘤效果[15]。Kim等[16]在体内外实验中证实ATO可以显著地抑制胆管细胞癌的生长,He等[17]研究表明ATO在多发性骨髓瘤的临床治疗中取得了较好的疗效。本研究结果显示,与空白对照组对比,ATO作用人小肠癌HIC细胞后,抑制率随浓度的增加而增高(P<0.05),且随时间的延长而增高(P<0.05),表明ATO可以显著抑制人小肠癌HIC细胞等增殖。细胞增殖抑制的实验检测方法目前常用的为噻唑蓝比色法,但其并不能连续监测药物的作用过程[18],本研究使用的实时无标记细胞分析系统,即RTCA法能够实时监测和反应细胞生长和增殖的动态过程,相对于传统的MTT法,观察效果更加准确、可控,可以更好地筛选和确定药物最佳浓度及最佳药物处理时间等[19]。
ATO在体外发挥抗肿瘤作用主要是通过抑制肿瘤细胞的增殖和诱导肿瘤细胞的凋亡来实现[20]。有研究报道,ATO可以在体外抑制结肠腺癌LS-174T细胞生长,其作用是通过抑制细胞增殖和促进凋亡两方面协同完成的[21]。细胞凋亡是由基因编码调控的细胞程序性细胞死亡,是调控维持机体内环境稳定和平衡的一个重要机制,凋亡调控失衡与肿瘤的发生发展密切相关,因此为消除异常增生的肿瘤细胞提供了一个重要途径[22]。Annexin V-FITC/PI双染色法可以将早期凋亡细胞及中晚期凋亡细胞区分开来,相比于传统的其它检测方法,如原位末端转移酶标记法(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay,TUNEL)检测法,其结果更加灵敏且准确可靠[23]。本研究中,通过流式细胞技术检测不同浓度ATO作用的HIC细胞48 h后的凋亡情况,结果显示ATO可以促进HIC细胞的凋亡,且随着ATO浓度的增加,凋亡率亦增高(P<0.05),因此ATO通过抑制肿瘤细胞的增殖同时促进肿瘤细胞的凋亡,来抑制肿瘤生长。
综上所述,ATO可以在体外抑制HIC细胞的增殖,且抑制率随浓度的增加而增高,随时间的延长而增高,同时ATO还可以促进人HIC细胞的凋亡,且凋亡率随浓度的增加而增高,从而发挥抗肿瘤的活性,这说明ATO具有广泛且有效的抗肿瘤作用。但本研究并没有对其机制进行研究,同时也没有行动物体内实验,ATO 本身并不具备靶向性,对机体毒副作用也巨大,因此今后可深入研究ATO发挥其抗肿瘤作用的具体机制,同时进行动物体内实验,期望能发现某种靶向物质与ATO连接后使其具备靶向性。本研究虽然存在一定局限性,但初步显示了ATO对体外HIC细胞的增殖及凋亡的作用,为小肠癌的临床治疗研究提供了新的方向。

