溶出曲线法评价卡马西平片的质量一致性
曹晓杰 轩少杰 傅麟勇
摘要:目的:对比自制卡马西平片和国外参比制剂原研药进行溶出曲线,为质量一致性评价提供依据。方法:通过比较不同溶出介质(中测定的溶出曲线,使用桨板法,转速为75转/min,采用f2因子进行溶出曲线的相似性评价。结果:f2相似因子结果证明,自制卡马西平片与原研药在四种溶出介质中溶出曲线相似。结论:自制卡马西平片与原研药质量一致。
关键词:卡马西平片;溶出曲线;一致性评价,f2因子
【中图分类号】R97 【文献标识码】A 【文章编号】2107-2306(2021)13--01
1.引言
卡马西平是一种三环抗惊厥剂,原研为诺华制药生产的Tegretol(100mg),于1974年在美国批准上市,现已退市。1996年美国首次推出卡马西平缓释制剂,在美国卡马西平缓释制剂用于三叉神经痛引起的疼痛的治疗,在欧盟用于治疗急性躁狂症和双相情感障碍。
卡马西平具有较窄治疗窗(4~12mg/L)[1]、血药浓度较大个体差异、吸收不规则,因此有必要对自制品与参比制剂原研药进行质量评估,而体外溶出曲线实验对固体制剂质量的重要性勿庸置疑[2],因此溶出曲线的测试现已成为了评价固体制剂内在质量的一种有效的手段与科学的方法。
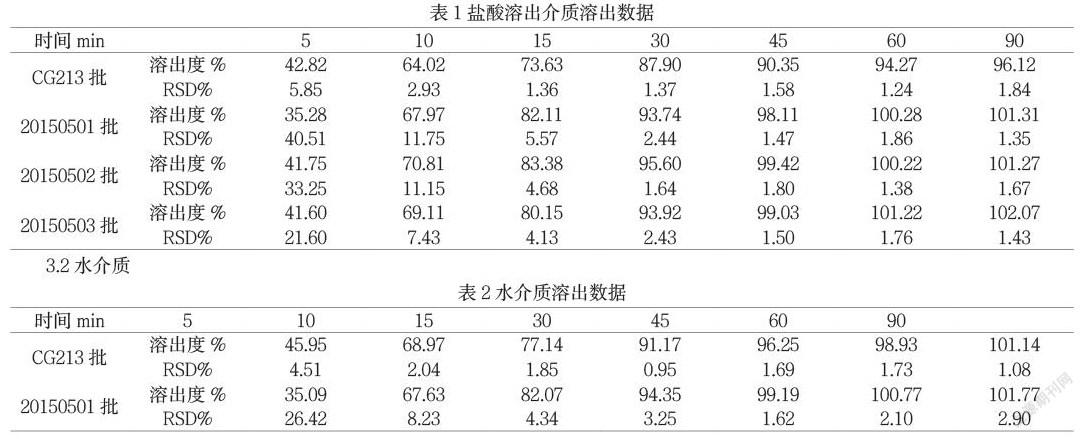
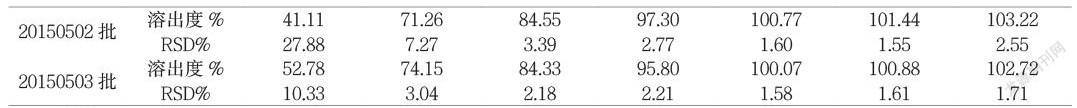
本试验参照日本“药品品质再评价”工程,在溶出曲线的研究中模拟人体消化道内体液的4种介质,采用日本IF文件规定的浆法75rpm,溶出体积900mL。该方法与《中国药典2015版》二部中卡马西平片(规格0.1g)溶出度方法相同。利用f2相似因子来评估溶出曲线的相似性。
2材料与方法
2.1仪器与试药
2.1.1仪器
智能溶出试验仪ZRS-8G、电子天平XS105、电子天平ESJ 182-4、紫外可见分光光度计TU-1810、pH计PHSJ-3F、超声仪SYU-10-200D。
2.1.2试药
盐酸(分析纯);甲醇(色谱纯);纯化水。
卡马西平工作用对照品(批号CN17090504,含量99.3%);卡马西平片(自制,0.1g,批号20150501/20150502/20150503;卡马西平片(日本诺华,100mg,批号CG213)
2.2方法
2.2.1溶液配制
对照溶液的配制:精密称取卡马西平工作用对照品25mg置于50ml量瓶中,加入适量甲醇,超声使卡马西平溶解后,放冷至室温,用甲醇稀释至刻度,摇匀;精密量取1.0ml置50ml量瓶中,用相对应的溶出介质稀释至刻度,摇匀。
样品溶液的配制:
5min时间点的样品溶液:精密量取5min时间点的续滤液3.0ml置于10ml量瓶中,用相应的溶出介质稀释至刻度,摇匀。
10min~90min时间点的样品溶液:精密量取10min时间点(或其它时间点)的续滤液1.0ml置于10ml量瓶中,用相对应的溶出介质稀释到刻度,摇匀。
2.2.2溶出过程
取卡马西平片12片,照溶出度测定法第二法,分别以上述溶出介质900mL为溶出介质,转速为75rpm,温度为37℃,依法操作,分别经5、10、15、30、45、60、90时,取溶出液10ml(同时补充相同温度相同體积相同相对应溶出介质)滤过,得续滤液备用。
2.2.3测定法:
分别取溶出介质、对照溶液、样品溶液在285nm处测定吸光度,按外标法计算每片样品各时间点的累积溶出度。
3结果
3.1盐酸介质
3.2水介质
4结论
根据药品质量再评价的原理,对仿制药的溶出曲线标准提出更高的要求,不仅在溶出限度上需要符合要求,溶出曲线也应该与参比制剂原研药保持相似,这样才能更好地保持药品的质量一致性。
通过自制卡马西平片与参比制剂原研药卡马西平片在不同介质中的体外溶出曲线对比,f2因子均大于50,证明自制卡马西平片与参比制剂原研药卡马西平片体外溶出曲线相似。可知,自制卡马西平片与参比制剂原研药卡马西平片质量一致。
参考文献:
[1] 龙妮,孙笃新,李万亥.临床药物手册[M].北京:金盾出版社。1992:311—311.
[2] 谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志。2009,40(4):308—310.

