调控脂质代谢的转录因子研究进展
李欣慧,赵 飞,施雪卿,徐倩茹,周宝进,吴若菲,林弘举(青岛理工大学 环境与市政工程学院,青岛 266033)
脂质由饮食摄入,并能在肝脏、脂肪和肠等许多组织中储存,其在保持能量平衡、控制食物摄入、调节生长、生殖和维持机体健康方面发挥重要作用.脂质代谢过程及其调控机制形成的复杂调控网络对维持机体代谢平衡至关重要.食物中的脂肪经摄食进入小肠内后由脂肪消化酶和胆汁酸盐水解为甘油和脂肪酸,中、短链脂肪酸被小肠吸收后直接进入血液,长链脂肪酸会再次生成甘油三酯然后结合载脂蛋白形成乳糜微粒释放到血液中,脂质吸收后在体内涉及甘油三酯、胆固醇、磷脂、血浆脂蛋白四类物质的代谢,代谢过程分为合成代谢和分解代谢.脂肪在肝脏、小肠和脂肪组织中合成,涉及的酶主要有脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)、甘油二酯酰基转移酶和溶血性磷酸酰基转移酶,合成后与载脂蛋白结合成极低密度脂蛋白进入血液,然后运送到脂肪组织进行储存或者在激素敏感性甘油三酯脂肪酶和单酰甘油酯酶或脂蛋白脂肪酶(LPL)作用下,将脂肪分解为脂肪酸最后进入肝脏进行β-氧化(脂肪酸分解的核心过程)产生能量.脂质代谢过程受多种转录因子的调控[1],这些转录因子会单独或与其他转录因子一起促进或抑制与脂质合成和分解相关基因的转录.目前研究较多的转录因子有过氧化物酶体增殖物激活受体(PPARs)、CCAAT增强子结合蛋白(C/EBP)、固醇调节元件结合蛋白(SREBP)、肝X受体(LXRs)和碳水化合物反应元件结合蛋白(ChREBP)等,本文将详细介绍以上几种以及其他转录因子对脂质代谢的调控机制.
1 PPARs
脂质代谢的调控网络中,PPARs是研究最多的一类转录因子.PPARs蛋白结构包含A—F 6个区,可划分为4个功能域:A/B区为配体依赖的转录激活域;C区为DNA结合域,具有高度保守性,可以结合过氧化物酶体增殖物反应元件PPRE,调节目的基因的转录;D区为铰链区,主要功能为连接DNA结合域和配体结合域;E/F区为配体结合域,是结合配体的部位.PPARs是一类配体依赖型转录因子,天然配体多为不饱和脂肪酸及其衍生物(如亚油酸、花生四烯酸)、前列腺素PGJ2等[2],当其被配体激活后与视黄醇类X受体/维甲酸X受体(RXR)形成异源二聚体,释放共抑制蛋白并结合辅激活蛋白,然后二聚体由细胞质转入细胞核,并结合PPAR反应性DNA调控元件PPRE,在其他转录激活因子的配合下控制与脂肪细胞分化和脂肪酸氧化有关基因的表达[2-4](图1).PPARs分为三种亚型:PPARα,PPARβ/δ和PPARγ.PPARα在肝脏、肌肉、肾脏和心脏等组织中高度表达[5],诱导涉及脂肪酸分解代谢和生酮作用的各种基因的表达[6-7]:PPARα促进脂肪酸转运蛋白、脂肪酸氧化限速酶肉碱乙酰转移酶、乙酰辅酶A合成酶的表达,从而催化脂肪酸活化,加速脂肪酸分解[4,8-10];降低载脂蛋白C-Ⅲ的表达,从而增加LPL的合成[5,9],催化脂蛋白中的甘油三酯分解成游离脂肪酸,降低甘油三酯的含量[1,8,11-12];增加载脂蛋白A-I(ApoA-I)和载脂蛋白A-Ⅱ的表达,促进高密度脂蛋白的合成,从而促进高密度脂蛋白胆固醇的成熟和代谢[2,8-9];诱导肝X受体α(LXRα)的表达,从而刺激ATP结合盒转运体A1的表达,促进胆固醇流向ApoA-I[9].PPARγ主要在肠和脂肪组织中表达[5],促进前脂肪细胞的分化并调节脂质的生物合成和储存[13-14]:PPARγ能够激活脂肪型脂肪酸结合蛋白和磷酸烯醇式丙酮酸羧激酶的表达,促进脂肪细胞分化[8,15-18];激活葡萄糖转运蛋白,促进乳糜微粒和极低密度脂蛋白中甘油三酯的分解[9,17];激活脂肪酸转运蛋白、脂肪酸转位酶、LPL和乙酰辅酶A合成酶,促进脂肪细胞摄取脂肪酸,最终影响脂肪细胞中甘油三酯的合成[8,10-11,17,19];此外,PPARγ还能抑制炎症反应基因,如白细胞介素-2、白细胞介素-6、白细胞介素-8、肿瘤坏死因子和金属蛋白酶等.相对于PPARα和PPARγ来说,PPARβ/δ的研究较少,但也有研究表明它也具有调控脂质代谢的作用[1,20]:促进脂肪酸氧化、脂蛋白代谢、葡萄糖利用和抗炎作用等.
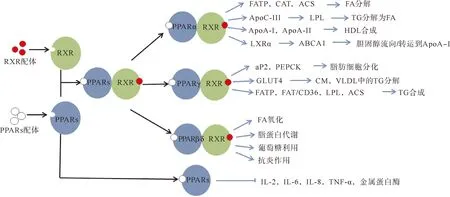
图1 PPARs在脂质代谢中的调控作用FATP—脂肪酸转运蛋白;CAT—脂肪酸氧化限速酶肉碱乙酰转移酶;ACS—乙酰辅酶A合成酶;FA—脂肪酸;TG—甘油三酯;ApoC-Ⅲ—载脂蛋白C-Ⅲ;ApoA-Ⅱ—载脂蛋白A-Ⅱ;HDL—高密度脂蛋白;ABCA1—ATP结合盒转运体A1;aP2—脂肪型脂肪酸结合蛋白;PEPCK—磷酸烯醇式丙酮酸羧激酶;GLUT4—葡萄糖转运蛋白;CM—乳糜微粒;VLDL—极低密度脂蛋白;FAT/CD36—脂肪酸转位酶;IL-2/6/8—白细胞介素-2/6/8;TNF-α—肿瘤坏死因子
2 C/EBP
C/EBP是碱性亮氨酸拉链蛋白家族的一个亚家族,C/EBP蛋白结构分为三个功能域:转录激活域,对于蛋白质-蛋白质的相互作用十分重要,可直接或间接启动转录功能;DNA 结合域;亮氨酸拉链域,可与其他蛋白形成二聚体,二聚体的形成是其结合DNA的先决条件.目前已经发现了六类亚型:C/EBPα,C/EBPβ,C/EBPγ,C/EBPδ,C/EBPε和C/EBPζ[21],其中主要是C/EBPα和C/EBPβ参与脂质代谢过程.C/EBPα在肝脏中高表达,C/EBPβ在脂肪组织、肝脏、肾脏、小肠等中高表达[21].C/EBPβ,C/EBPα和PPARγ在脂肪形成过程中参与级联反应:C/EBPβ激活C/EBPα和PPARγ的转录,激活后C/EBPα产生自身诱导作用,诱导许多脂肪细胞基因的表达[22],如硬脂酰辅酶A去饱和酶1(SCD1)、脂肪酸结合蛋白、磷酸烯醇式丙酮酸羧激酶等,还可以促进PPARγ高表达[21-22],从而促进脂肪细胞分化,在脂肪组织发育中发挥重要作用;C/EBPβ激活PPARγ因子可介导脂质生成,影响全身脂肪含量[1],还可以通过激活二脂酰甘油酰基转移酶2促进脂肪生成[23](表1).
3 SREBP
SREBP是脂质代谢的主要参与者,控制着对脂质合成和摄取重要基因的表达[24].SREBP前体蛋白有三个结构域:第一个结构域是碱性螺旋-环-螺旋-亮氨酸拉链区,负责蛋白质二聚体的形成和DNA的结合;第二个结构域包含两个疏水的跨膜片段;第三个结构域是羧基末端片段,通过与SREBP剪切激活蛋白(SCAP)的相互作用,发挥重要的调节功能.SREBP有三种亚型:SREBP-1a,SREBP-1c和SREBP-2.SREBP-1(SREBP-1a和SREBP-1c)在肝脏、肾上腺中高表达,主要调节脂肪酸和脂质的合成[25-28]:SREBP-1可以调节FAS,ACC,SCD1和甘油三磷酸酰基转移酶[29-30],以促进脂肪酸的生物合成和低密度脂蛋白受体的表达[26];SREBP-1c还可以调节脂肪细胞分化相关的酶,并且在脂肪细胞分化以及形成过程中会与C/EBPβ,PPARγ共同作用[1,31-32].SREBP-2广泛表达,主要调节胆固醇代谢,激活胆固醇生物合成途径中的多个基因的表达[28],如3-羟基-3-甲基戊二酸单酰辅酶A还原酶、角鲨烯合成酶等[25,33](表1).此外,SREBPs还与包括炎症、自噬和细胞凋亡在内的致病过程有关,并以这种方式促成多种代谢紊乱的发生[34-35].在能量丰富的状态下,与蛋白质合成相关的SREBP-1激活导致内质网应激;未折叠蛋白反应最初可恢复体内平衡,但长期的内质网应激可导致SREBP-1c进一步激活,从而加重脂肪变性、细胞应激和炎症[34];最后,慢性炎症增加了纤维化和癌症的风险;脂肪变性-炎症-脂肪毒性介导的纤维化是导致免疫代谢紊乱的器官病理学的最终常见途径,严重的细胞应激通过终末未折叠蛋白反应诱导细胞凋亡[35].在能量耗尽状态下,脂滴中的脂质通过脂肪吞噬作用被降解以恢复能量水平;SREBP-2可能参与巨噬细胞的吞噬和自噬,它介导的自噬相关基因的调节可能是自噬与胆固醇代谢之间的一种联系;而SREBP-1a可能参与巨噬细胞的固有免疫反应,因为SREBP-1a可以直接激活巨噬细胞NLRP基因和caspase-1,介导IL-1β的分泌.
4 LXRs
LXRs(LXRα,LXRβ)也属于核受体超家族,LXR由四个结构域组成:N末端配体非依赖性激活功能结构域;包含两个锌指蛋白的DNA结合结构域;配体结合和受体二聚化所需的疏水配体结合结构域;C末端配体依赖性反式激活序列,激活对配体结合反应的转录.LXR与RXR形成异源二聚体,在配体结合时激活靶基因的表达[36],天然配体为氧化胆固醇衍生物(氧甾醇).LXRα在具有高代谢活性的组织中大量表达,包括肝脏、脂肪和巨噬细胞,而LXRβ广泛表达,但表达水平较低[37].LXR主要调控胆固醇代谢:可以激活SREBP-1c,FAS,ACC和SCD1的表达,促进脂肪酸和肝脏中脂肪的生成[9];激活LPL、胆固醇酯转移蛋白、磷脂转移蛋白、载脂蛋白C-Ⅰ/Ⅲ/Ⅳ,促进脂蛋白分泌和代谢;激活ATP结合盒转运体A1,促进胆固醇从细胞转运到ApoA-I[9];激活ATP结合盒转运体G1,G4,促进胆固醇转运到高密度脂蛋白胆固醇[9];激活胆固醇7α-羟化酶、ATP结合盒转运体G5,G8,促进胆固醇从体内排出[9];还能刺激肝脏中ChREBP的表达,增加脂质合成基因的转录[25,38];可以通过Wnt/β-连环蛋白抑制脂肪细胞分化[38](表1).
5 ChREBP
ChREBP是一种被高糖激活的转录因子,在糖酵解和脂肪生成中起着关键作用.ChREBP蛋白主要包括N端的核定位信号肽、C端的DNA结合域、富含脯氨酸的结构域以及及亮氨酸锌指结构域.它也是一种碱性亮氨酸拉链蛋白转录因子,与Max样蛋白X形成异二聚体.ChREBP在肝脏、小肠、肾脏、脂肪和肌肉等组织中呈现高表达状态[39].ChREBP主要参与糖代谢和脂质生成相关酶基因的调控:通过L型丙酮酸激酶、葡萄糖6磷酸酶催化亚基调控糖异生,通过FAS,ACC,SCD1等酶调控脂质的合成[40](表1).此外,ChREBP还会促进葡萄糖向脂质转化.最近的一项研究表明,ChREBP可以通过感应脂肪细胞中的葡萄糖通量来调节脂肪的生成,而脂肪组织中的ChREBP水平与人体中的葡萄糖耐量和胰岛素敏感性密切相关.
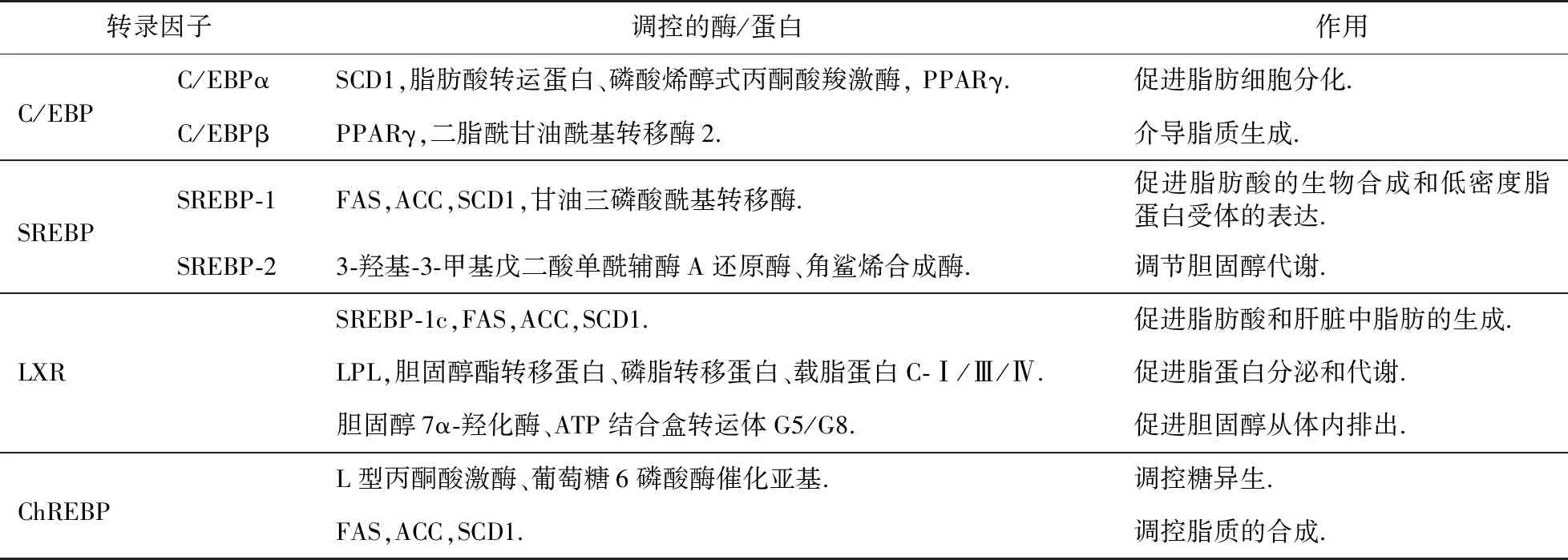
表1 C/EBP,SREBP,LXR,ChREBP对脂质代谢的调控作用
6 其他转录因子
除了以上5种研究较多的转录因子外,GATA2,GATA3,哺乳动物肝细胞核因子(Fox)、哺乳动物激活转录因子4,5(ATF4,ATF5)、法尼醇X受体(FXR)和Nur77(NR4A1)的研究较少,以下将具体介绍这几种转录因子对脂质代谢的调控作用.
6.1 GATA2和GATA3
GATA2和GATA3属锌指蛋白家族,它们是前脂肪细胞基因,在哺乳动物中发挥重要作用,控制着前脂肪细胞向脂肪细胞的转化.研究发现,GATA2和GATA3两种转录因子主要通过抑制PPARγ基因表达、与C/EBPα和C/EBPβ相互作用这两条途径来负向调控脂肪细胞分化[41].
6.2 Fox
叉框头蛋白家族(Fox)是一类广泛存在的转录因子,与脂质代谢相关的主要包含FoxA和FoxO亚家族.在前脂肪细胞中,FoxA-2通过激活前脂肪细胞因子1基因的转录抑制脂肪细胞分化;在分化的脂肪细胞中,FoxA-2的表达诱导了葡萄糖和脂肪代谢相关的基因表达,包括葡萄糖转运蛋白-4、己糖激酶-2、肌丙酮酸激酶、激素敏感脂肪酶和解偶联蛋白-2和-3[42].FoxO1通过下调PPAR-γ的表达减少脂肪生成;FoxO1是调节前脂肪细胞分化的关键因子,它会抑制脂肪细胞分化;可以通过不同的途径促进脂质分解;负向调节SREBP-1的表达,导致脂肪沉积减少[43].FoxO1通过促进脂肪分解和调节脂肪细胞分化两个主要机制调节脂质代谢,最终导致脂质积累减少,这在预防脂质相关疾病中至关重要[43].而FoxO1过量表达会增强SREBP-1,FAS,ACC的表达,降低PPARα,ACOX1的表达,从而增加甘油三酯的合成和脂肪酸的氧化,导致脂质积累[44].目前也有研究表明FoxO1是治疗肥胖症、NAFLD和2型糖尿病的潜在靶点,但还需要进一步研究FoxO1与脂质相关疾病之间的关系[43].
6.3 ATF4,ATF5
ATF4是脂质代谢的关键调节因子[45],参与脂肪生成和脂肪分解过程:利用基因敲除技术,WANG等发现ATF4可以负向调控小鼠中与脂质分解和β-氧化相关基因的表达,包括激素敏感脂肪酶、肉碱棕榈酰转移酶1和中链酰基辅酶A脱氢酶[45].在白色脂肪细胞[45]中,ATF4会下调SREBP-1c,FAS,SCD1等基因的表达,减少脂肪生成.ATF5在肝脏和脂肪组织中高度表达.ATF5不仅可以促进3T3-L1前脂肪细胞分化,而且ATF5在成熟脂肪细胞中也高表达,同样利用基因敲除技术,发现ATF5可上调FAS,SCD1,肉碱棕榈酰转移酶1的表达,从而增加脂质的储存[46].
6.4 FXR
FXR与PPAR,LXR类似,与RXR形成异源二聚体,与配体结合后来调节靶基因的表达,FXR的天然配体为胆汁酸.FXR主要在小肠、肝脏肾脏和肾上腺中高度表达,在心脏和脂肪组织中低水平表达.FXR在维持胆汁酸水平的控制方面起着至关重要的作用,胆汁酸有助于餐后脂肪和胆固醇的有效消化和吸收,而且胆汁酸的形成是胆固醇从体内排出的主要途径,FXR诱导多种基因的表达,这些基因修饰胆汁酸以保护肝脏免受毒性.FXR可上调PPARα的表达,通过SHP途径降低SREBP-1c的表达,从而减少甘油三酯的合成[37];下调载脂蛋白C-Ⅲ,上调载脂蛋白C-Ⅱ、载脂蛋白A-Ⅴ,从而LPL的表达上升,促进低密度脂蛋白胆固醇和乳糜微粒的分解[47].因此,FXRs似乎通过多种机制降低甘油三酯水平,包括减少脂肪生成和促进甘油三酯和脂肪酸的摄取、分解代谢和氧化.孕烷X受体与FXR一样同样可以调节胆汁酸代谢以及从多种水平参与脂质代谢过程[48].
6.5 Nur77(NR4A1)
Nur77(NR4A1)又叫神经生长因子诱导基因I-B,也是核受体家族的成员,因为目前没找到其内源性配体,所以称之为核孤儿受体.Nur77可以减少甘油三酯的合成[47,49]:抑制SREBP-1c的表达,SREBP-1c的靶基因SCD1、线粒体甘油-3-磷酸酰基转移酶、FAS和低密度脂蛋白受体的表达也降低;下调LXR及其靶基因ABCG5,ABCG8的表达;也可以抑制载脂蛋白B和载脂蛋白E的表达水平.在骨骼肌细胞中,利用基因敲除技术,发现Nur77会下调参与脂肪分解和能量消耗的几个基因的表达,其中最重要的是葡萄糖转运蛋白4、解偶联蛋白2、解偶联蛋白3、CD36和AMP激活蛋白激酶γ3[49].骨骼肌是脂肪和葡萄糖利用的重要组成部分,也是人体能量消耗的主要来源,所以Nur77沉默的骨骼肌细胞会减少脂质分解.Nur77在棕色脂肪细胞中的过度表达会诱导解偶联蛋白1的表达,解偶联蛋白1是一种重要的产热蛋白,被认为在能量消耗中起作用[49].此外,Nur77还与细胞调亡和炎症反应相关,有研究表明,它可以减少动脉粥样硬化组织以及巨噬细胞中的脂质摄入,并减少炎症反应[47](表2).
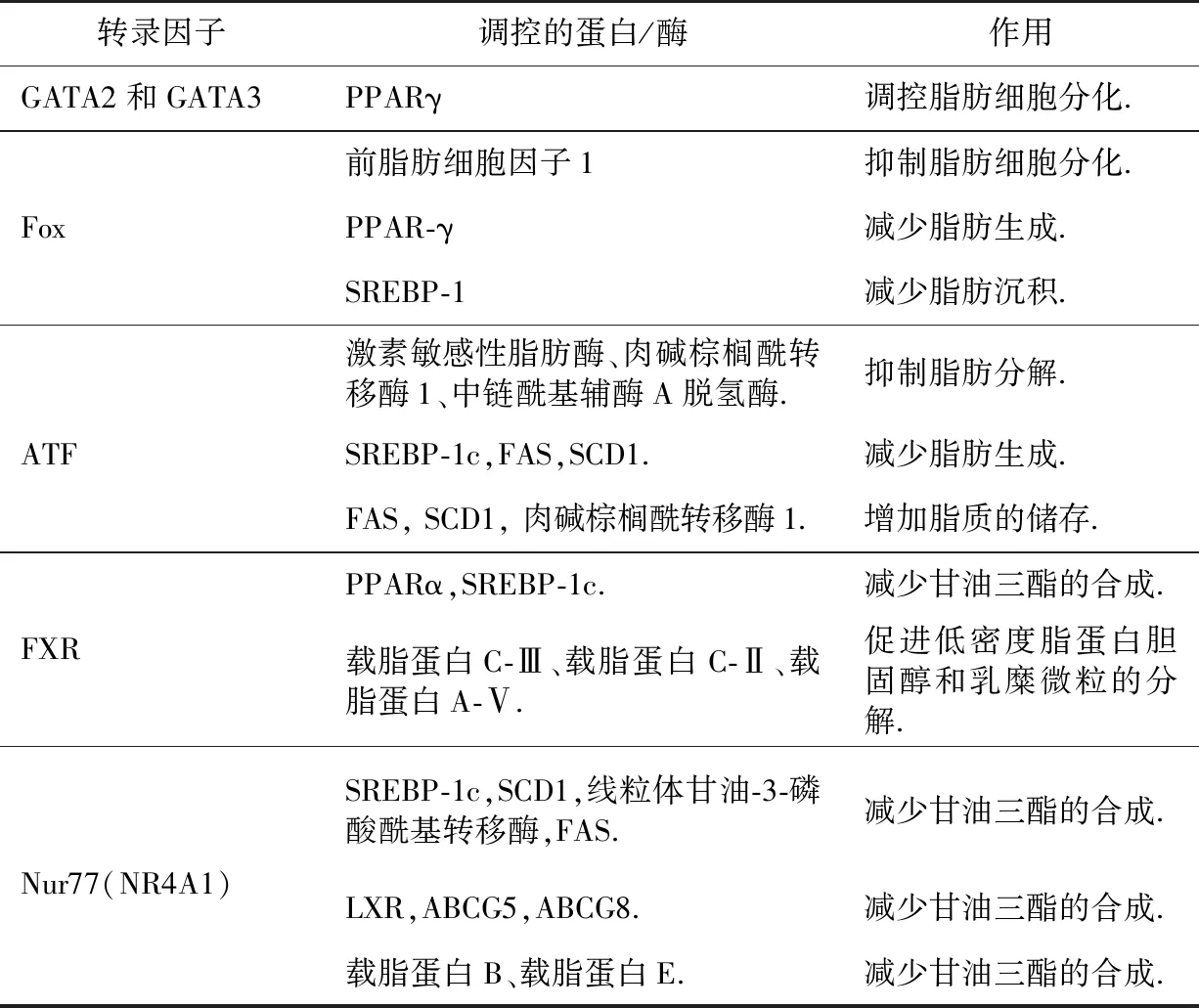
表2 其他转录因子对脂质代谢的调控作用
7 结束语
综上所述,脂质代谢过程会受到多种转录因子的调控.在脂质代谢过程中,这些因素会相互影响,共同维持机体的代谢平衡.目前以转录因子为作用靶点的药物已相继被开发出来,广泛用于肥胖、高脂血等脂质代谢疾病的治疗,随着对其他转录因子的深入研究,将来可能会开发出更多新型高效的药物并应用于疾病的防治.

