莪术提取物介导Wnt/β-catenin信号通路对人肝癌Hep-G2细胞的影响*
叶兴涛 史国军 陆 宁 董 晶 施 航 徐央波
(宁波市中医院肿瘤科,宁波 315010)
全球每年因肝癌死亡的患者超过100万人,全球病患总数中国人占43.7%,病死率近50%,治疗后5年生存率约50%,多数患者出现复发和转移[1-2]。近些年来,作为重要的细胞间黏附分子和Wnt信号转导通路的关键递质,β-catenin在肝癌方面的研究尤为重要[3]。大量数据表明,肝癌β-catenin的异常改变与Wnt信号激活有关系,β-catenin在肿瘤细胞增殖和转移过程中扮演重要角色[4-5]。莪术是姜科姜黄属植物的根茎,中医认为其功能多样,如消积、破淤、行气及止痛等,同时具有抗癌、抗早孕、抗凝血、抗氧化和保肝等作用[6]。研究显示,从莪术中提取的β-榄香烯在抗肿瘤方面作用显著,不良反应较少,对患者生存质量有明显改善作用[7-8],但其具体作用机制尚不清楚。本研究旨在探讨莪术提取物介导Wnt/β-catenin信号通路对肝癌细胞的影响。
1 材料和方法
1.1 主要试剂
TRIzol 试剂(浙江AMEKO 公司);逆转录试剂盒(武汉赛维尔公司);RT-PCR 试剂盒(上海优予公司);β-榄香烯(广东中山成诺生物公司);RPMI-1640 培养基(上海博升公司);BCA 蛋白浓度测定试剂盒(上海抚生实业公司);Hep-G2 人肝癌细胞(上海奥陆生物公司)。
1.2 细胞培养及分组
取Hep-G2 细胞常规接种培养,待Hep-G2 细胞密度生长为60%~80%时,在培养液中加入β-榄香烯,按照所加入浓度将Hep-G2 细胞分为20、50、100 μg/mL 组,将各组Hep-G2 细胞 置 于16 孔板中培养,以不加入β-榄香烯培养液作为正常对照组,4 组培养48 h 后,弃去上层清液,更换培养基, 培养48 h,收集细胞。
1.3 RT-PCR检测各组Hep-G2 Wnt1、β-catenin mRNA水平变化
采用TRIzol 法来提取Hep-G2细胞总RNA,再反转录成 cDNA,按说明书操作,用DNA 荧光染 料SYBR Green Ⅰ对Wnt1、β-catenin 表 达 水 平进行检测,各引物序列见表1,内参采用β-actin,60 ℃、10 min,95 ℃、72 ℃, 各 30 s,95 ℃、 5 min,循环次数以40为准,实验次数至少3次,用相对定量2-ΔΔCT计算Wnt1、β-catenin mRNA水平。

表1 引物序列Tab 1 Primer sequences
1.4 免疫印迹检测各组Hep-G2 细胞Wnt1、β-catenin蛋白表达
将Hep-G2 细胞进行裂解并提取核蛋白,并对核蛋白的浓度进行测量,分装后6 孔板中加入 100 μg 的胰蛋白酶提取液,再注入2 mL 培养基,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液按照4∶1 的比例混匀,将50 μg 蛋白样品电泳后转移到PVDF 膜上,加脱脂奶粉封闭1 h,加入2 抗室温封闭1 h,取出PVDF 膜TTBS 漂洗3 次,每次10 min,DAB 显色后数码相机照相,计算Wnt1、β-catenin 蛋白浓度。
1.5 流式细胞仪检测各组Hep-G2 细胞凋亡情况
收取各组Hep-G2 细胞,离心5 min,运用100 μL 结合缓冲液对细胞进行重悬,用 5 μL 标记lFITC 的Annexin Ⅴ与5 μL PI 染色混匀,无光条件下孵育15 min 后注入400 μL 结合缓冲液混匀,记录细胞凋亡情况。
1.6 划痕实验检测Hep-G2 细胞迁移能力
各取4 组1×105/mL 细胞进行饥饿处理,12 h 后再加入DMSO,24 h 后离心重悬细胞为5× 105/mL,将200 mL 细胞悬液注入Transwell 小室,加入培养基中培养12 h,培养结束拭去未迁移细胞,甲醛溶液固定8 min,结晶紫溶液染色,半定量计数,显微镜(×100)观察5 个视野。
1.7 MTT 检测Hep-G2 细胞增殖能力
取各组Hep-G2细胞接种在96 孔板, 每孔200 μL,室温37 ℃、5%CO2,培养时长不< 24 h,每孔加入10 μL MTT 溶液,继续培养4 h,与150 μL DMSO 溶液混匀,在酶标仪490 nm 处测量各孔的吸光值,分析细胞活力变化情况。
1.8 统计学处理
采用 SPSS 19.0 软件进行统计学处理,计量资料用±s表示,组间比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组Hep-G2 细胞Wnt1、β-catenin mRNA 及蛋白水平变化
RT-PCR 检测结果显示,正常对照组Wnt1、β-catenin mRNA 水平高于其他3 组,差异有统计学 意 义(P<0.05), 100 μg/mL 组Wnt1、β-catenin mRNA 水平显著低于20 μg/mL 组、50 μg/mL 组,组间比较差异有统计学意义(P<0.05)(图1)。

图1 各组Hep-G2 细胞Wnt1 和β-catenin mRNA 水平变化Fig 1 Changes in wnt1 and β-catenin mRNA levels in Hep-G2 cells
免疫印迹检测结果显示,正常对照组Wnt1、β-catenin 蛋白相对表达高于其他3 组,差异有统计学 意 义(P<0.05), 100 μg/mL 组Wnt1、β-catenin蛋白相对表达显著低于20 μg/mL 组、50 μg/mL 组,组间差异有统计学意义(P<0.05)(图2)。

图2 各组Hep-G2 细胞Wnt1、β-catenin 蛋白含量Fig 2 Wnt1 and β-catenin protein content in Hep-G2 cells of each group
2.2 各组Hep-G2 细胞凋亡率比较
流式细胞仪检测结果显示,正常对照组Hep-G2 细胞凋亡率显著低于其他3 组,差异有统计学意义(P<0.05), 100 μg/mL 组Hep-G2 细胞凋亡率显著高于20 μg/mL 组、50 μg/mL 组,组间差异有统计学意义(P<0.05)(图3)。
2.3 各组Hep-G2 细胞迁移能力比较
Transwell检测结果显示,100 μg/mL组Hep-G2细胞迁移细胞数为(45.69±5.44)个,显著低于正常对照组的(125.55±12.39)个、20 μg/mL组的(109.49±12.24)个和100 μg/mL组的(87.45±9.34)个,差异有统计学意义(P<0.05)(图4)。
2.4 各组Hep-G2 细胞增殖能力比较
MTT 检测结果显示,正常对照组Hep-G2 细胞增殖能力显著高于其他3 组,差异有统计学意义(P<0.05), 100 μg/mL 组Hep-G2 细胞增殖能力低于20 μg/mL 组、50 μg/mL 组,组间差异有统计学意义(P<0.05)(图5)。
3 讨论
肝癌是众多肿瘤中致死率较高的疾病之一,死亡率占全球疾病死亡人数一半左右,严重威胁着人类生命和健康[9]。癌症的侵袭转移过程十分复杂,与各种黏附相关分子、细胞因子、调节因子、信号转导通路密切相关[10]。莪术提取物β-榄香烯具有抗转移、不易耐药、抗癌等功效,在临床多种肿瘤应用中疗效显著[11-12]。运用转基因肝癌小鼠对Wnt信号通路进行研究,结果显示Wnt 信号通路在肝癌组织中异常激活,并与下游β-catenin 产生作用,对肝癌细胞的增殖、转移有促进作用[13]。
中医治疗肝癌多以活血化瘀、消积散结为主,莪术作为常见的活血化瘀的中药,其提取物β-榄香烯是萜烯类化合物的一种,具有非细胞毒性特点,其抗癌作用机制是通过阻碍癌细胞周期来实现。其次,莪术提取物β-榄香烯提升肿瘤细胞的免疫原性,促进荷瘤对机体中免疫细胞功能的恢复,毒副作用小,同时不易产生耐药性[14-15]。有研究证实,β-榄香烯体外抑制肝癌细胞增殖能力明显,阻滞癌细胞生长周期,使其停留在G1期, 达到抑制肿瘤生长的目的[16]。本研究结果显示,100 μg/mL组Hep-G2细胞凋亡率最高,其次为20 μg/mL组、50 μg/mL组,正常对照组Hep-G2细胞凋亡率最低。正常对照组Hep-G2细胞迁移能力最高,100 μg/mL 组迁移能力最低,50 μg/mL 组迁移能力高于20 μg/mL 组。 100 μg/mL 组Hep-G2 细胞增殖能力最低,正常对照组细胞增殖能力最高,50 μg/mL 组细胞增值能力低于20 μg/mL 组。
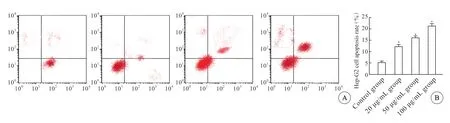
图3 各组Hep-G2 细胞凋亡率Fig 3 Hep-G2 cell apoptosis rate in each group

图4 各组Hep-G2 细胞迁移能力,结晶紫染色,×200,标尺=50 μmFig 4 Hep-G2 cells migration ability in each group, crystal violet staining, ×200, bar=50 μm

图5 各组Hep-G2 细胞增殖能力Fig 5 Hep-G2 cell proliferation ability in each group
本研究结果还显示,正常对照组Wnt1、β-catenin 表达水平高于其他3 组,20 μg/mL 组Wnt1、β-catenin 表达水平最低,20 μg/mL 组Wnt1、β-catenin 表达水平高于50 μg/mL 组,说明β-榄香烯在一定程度上降低了Wnt1 的表达,可能通过β-catenin 信号对肝癌细胞的发生发展起重要作用。相关文献报道,调节Wnt 信号相关蛋白的活性可以产生癌基因作用,而抑制肿瘤癌基因的表达,可发挥抑癌基因的作用[17-18]。有研究表明,多数癌症患者机体中β-catenin 的表达都有提升,异常表达的Wnt/β-catenin 可加剧机体免疫细胞的损伤,如在胶质瘤中Wnt 信号表达受到抑制后,癌细胞的放射敏感性就会降低,从而提高放疗和化疗的效 果[19]。Wnt 通路在众多肿瘤中被发现,在胃癌和子宫内膜癌中的异常变化具有重要参考价值[20]。Wnt通路信号被激活时,靶器官的分化受到限制,干细胞特异性被保留,会加快肝癌细胞的分化,导致肿瘤形成[21]。
综上所述,莪术提取物在肝癌细胞的凋亡中发挥重要作用,通过抑制Wnt/β-catenin 信号通路活性,抑制细胞增殖和迁移。

