脑深部核团磁敏感加权成像自回归模型纹理分析诊断帕金森病
彭媛媛,任翠萍*,程敬亮,张春艳,陈 晨,赵瑞琛,卢 宏,朱红灿
(1.郑州大学第一附属医院磁共振科,2.神经内科,河南 郑州 450052)
帕金森病(Parkinson disease, PD)是常见神经系统退行性疾病,病因尚不明确,脑铁负荷是PD的主要神经病理学特征之一[1-2]。目前已有多种MRI技术用于检测PD患者脑铁含量、分布及其与临床特征的关系,如T2*WI[2]、磁敏感加权成像(susceptibility weighted imaging, SWI)[3-4]及定量磁敏感图(quantitative susceptibility mapping, QSM)[5-6]等。SWI是在T2*梯度回波序列基础上发展而来,可更敏感地显示组织内铁沉积情况,后处理较QSM简单,可用于检测PD患者脑核团铁沉积[3,7]。纹理分析技术是基于像素灰度分布和相邻像素灰度值对图像纹理进行量化分析的方法[8]。既往研究[9]表明,通过纹理分析可捕捉认知能力下降PD患者脑内信号轻微改变,基于共现矩阵纹理分析可发现PD患者大脑结构纹理中尚无法被视觉评估的变化[10]。本研究探讨基于脑深部核团SWI序列自回归模型纹理分析诊断PD的价值。
1 资料与方法
1.1 一般资料 收集2017年9月—2019年11月郑州大学第一附属医院收治的60例PD患者(PD组),男29例,女31例,年龄41~79岁,平均(55.9±8.6)岁;病程0.25~11.00年,中位病程3.00(1.58,5.00)年;Hoehn-Yahr(H-Y)分级1~5级,中位分级2.5(1.5,3.0)级;PD综合量表(UPDRS-Ⅲ)评分18~101分,平均(45.00±30.20)分;简易精神状态检查(mini-mental state examination, MMSE)量表评分11~29分,中位评分23.00(21.00,26.00)分;蒙特利尔认知评估(Montreal cognitive assessment, MoCA)量表评分9~29分,平均(19.25±4.96)分;均符合英国脑库PD诊断标准,图像质量佳。
另选年龄、性别相匹配的30名健康志愿者为对照组,男、女各15名,年龄41~76岁,平均(59.3±9.9)岁。本研究通过院伦理委员会批准,所有受试者均签署知情同意书。
1.2 仪器与方法 采用Siemens Prisma 3.0T MR扫描仪,64通道头部线圈。扫描时嘱患者仰卧,使线圈十字中心位于眉间,行常规平扫T1W、T2W、DWI及SWI扫描。SWI参数:FOV 15°,TR 27 ms,TE 20 ms,层厚1.5 mm,层间距0 mm,视野220 mm×220 mm,矩阵256×246。
1.3 图像分析 以平扫图像为参考,以BMP格式将符合要求的SWI图像自图像存储与传输系统(picture archiving and communications system, PACS)工作站导出,确保所有图像窗宽、窗位保持一致。采用MaZda软件(Version 4.6,http://fwww.eletel.p.lodz.pl/mazda)进行纹理分析,图像标准化控制在μ±3δ,分别于显示双侧尾状核头、壳核、苍白球及丘脑最大且最清晰层面手动勾画并充填ROI,在黑质、红核同时显示最佳的层面及其相邻2个层面上勾画黑质及红核ROI(图1),提取自回归模型纹理特征参数值(包括Teta1、Teta2、Teta3、Teta4及Sigma)。由1名医学影像学研究生在2名主治医师指导下完成勾画。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示经Shapiro-Wilk检验符合正态分布的计量资料,组间比较采用独立样本t检验;以中位数(上下四分位数)表示不符合者,采用Mann-WhitneyU检验进行比较。以MedCaIc软件基于组间差异有统计学意义的参数建立ROC曲线,计算AUC,评价其诊断PD的效能。双变量均为正态分布时,采用Pearson相关性分析,否则采用Spearman相关性分析。P<0.05为差异有统计学意义。
2 结果
PD组与HC组间苍白球Teta1及Sigma、丘脑Teta2及Teta3、红核Teta2及Teta4差异均有统计学意义(P均<0.05),见表1。ROC曲线结果显示,苍白球Sigma诊断PD的AUC最大,为0.753,其敏感度及特异度分别为90.00%、60.00%;其次为丘脑Teta2,AUC、敏感度及特异度分别为0.706、73.33%及66.67%;见表2及图2。
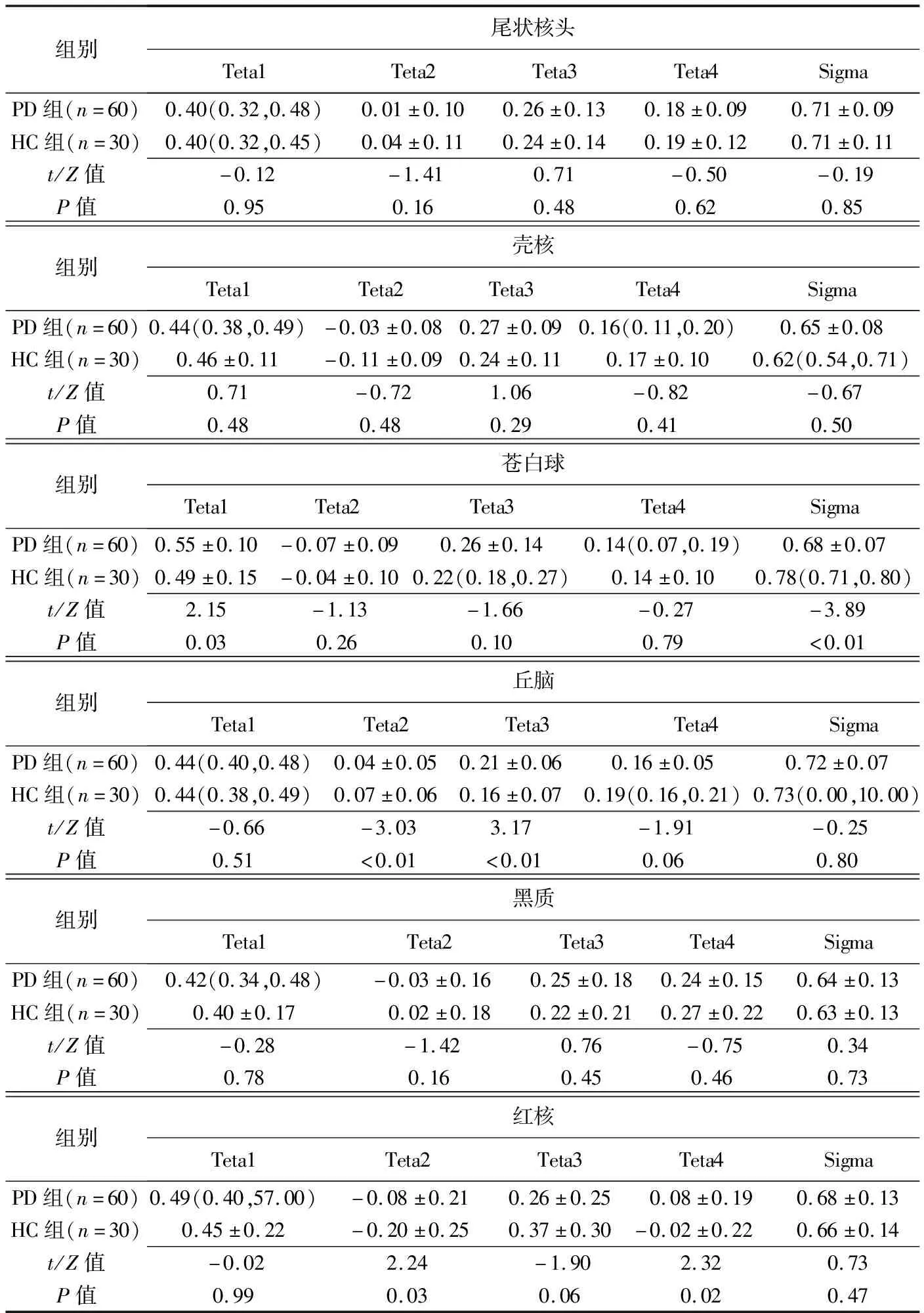
表1 PD组与HC组各核团纹理特征参数值比较
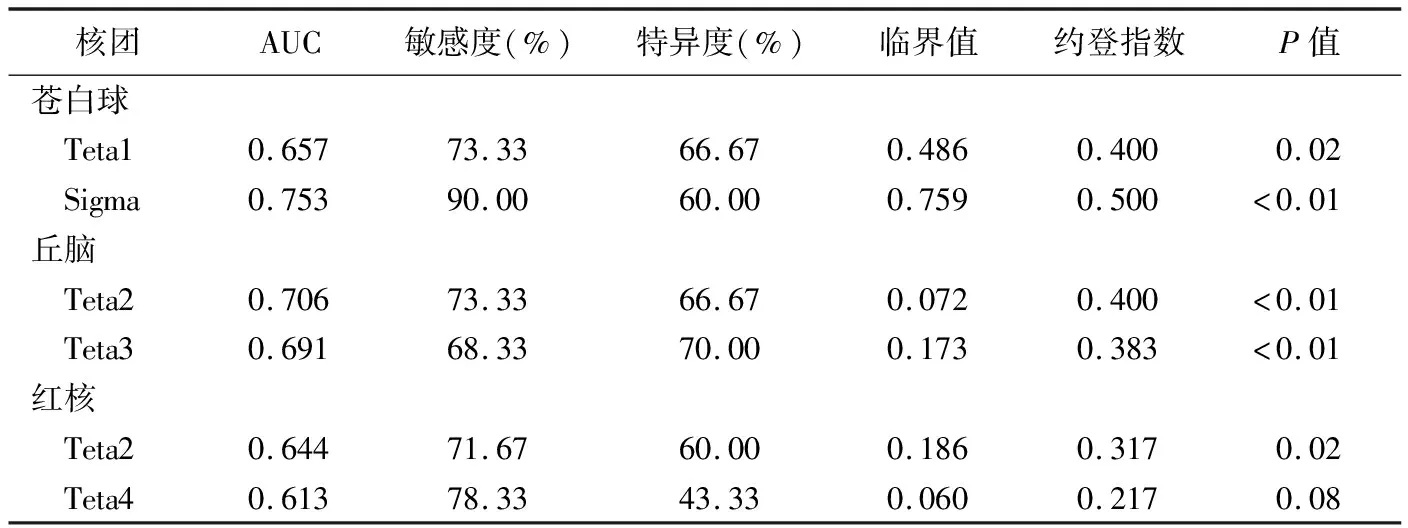
表2 PD组与HC组差异有统计学意义的核团参数的ROC曲线分析结果
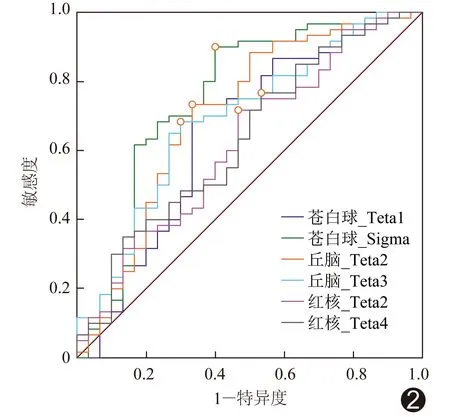
图2 苍白球Teta1及Sigma、丘脑Teta2及Teta3、红核Teta2及Teta4诊断PD的ROC曲线
各核团组间差异有统计学的纹理特征参数中,仅丘脑Teta3与MoCA评分呈负相关(r=-0.28,P=0.03),其余与病程及各量表评分均无明显相关(P均>0.05)。
3 讨论
MaZda软件是有效的图像定量分析工具,被广泛用于包括医学在内的多个领域。自回归模型纹理分析是MaZda软件计算纹理特征的方法之一,该模型假设图像像素之间存在局部交互,中心像素的灰度值由其左、上、左上及右上相邻体素灰度值的加权和表示[11];该模型不同于一阶直方图纹理分析仅单纯计算单体素灰度强度及空间分布,还考虑到邻近体素灰度值的影响。有学者[9]认为脑结构及功能改变可引起相应脑区MRI信号改变,并可影响相应脑区的灰度强度及分布,而这种灰度改变有可能被纹理分析识别;由此推测,PD患者脑铁分布及含量发生改变引起的脑区SWI信号减低及灰度变化也可被纹理分析所捕捉。
自回归模型纹理分析包括5个特征参数,其中Teta1、Teta2、Teta3及Teta4表示中心像素周围4个像素灰度值的加权和,反映相邻像素间的关系;Sigma表示最小预测误差方差,代表高斯和离群过程的混合[11-12]。本研究提取SWI的自回归模型纹理特征,比较PD组与HC组尾状核头、壳核、苍白球、丘脑、黑质及红核深部核团的纹理参数。相比HC组,PD组丘脑Teta2参数值减低,苍白球Teta1、丘脑Teta3、红核Teta2及Teta4参数值升高。Teta2参数减低提示其所代表的中心像素周围相邻像素灰度值加权和减小(整体信号减低),可能与这些像素的铁质含量增加有关,然而这并不能解释苍白球Teta1、丘脑Teta3、红核Teta2及Teta4参数值升高。有学者[13-14]认为过量的脑铁沉积是神经退行性改变的原因之一,神经元丢失后导致胶质细胞增生,参数值升高可能与相应像素区胶质细胞增生有关。本研究中PD组苍白球Sigma参数值较HC组减小,提示相邻像素灰度强度的差异较小[12];但不同于大多数研究[15]所显示的PD患者黑质含铁量增加,本研究中2组间黑质处各纹理参数值差异均无统计学意义,可能与黑质处大量铁沉积明显抑制SWI信号有关[4]。
对组间差异有统计学意义的参数进行ROC曲线分析,结果显示苍白球Sigma对PD的诊断效能最高,AUC为0.753,敏感度及特异度分别为90.00%和60.00%,其次为丘脑Teta2,AUC为0.706,与既往研究[16-17]中基于QSM、R2*图、T2液体衰减反转恢复序列纹理参数对PD的诊断效能分析结果相近。SWI对技术要求不高,后处理相对简单,显示黑质、红核等小核团尚佳,临床应用价值甚高。
丘脑是皮层、皮层下和小脑回路的关键联络点,与PD认知功能改变相关[18-19]。BETROUNI等[9]基于T1WI比较认知功能轻度减退、认知功能缺失及健康对照者包括丘脑在内的6个脑区纹理特征及脑区体积,发现3组间海马、丘脑及杏仁体处的偏度及熵值差异有统计学意义,且这种差异在脑区体积未发生改变的轻度认知功能减退PD患者中已经存在,表明纹理分析可在PD患者脑区萎缩前识别早期认知功能改变。本研究中丘脑Teta3参数值与MoCA评分呈负相关,提示自回归模型纹理分析有助于早期评估PD患者认知功能。
综上所述,SWI自回归模型纹理分析可为诊断PD提供客观依据,对评估PD患者认知功能具有一定价值。但本研究存在一定局限性:①采用bmp格式图像提取特征,而原始图像为DICOM格式;②样本量较小;③手工勾画ROI难免存在误差,尤其对于黑质、红核等较小核团;④仅提取针对核团单一层面或部分层面的纹理信息,可能造成部分信息丢失;⑤未比较左、右侧核团数据差异;⑥仅针对SWI,SWI与QSM、DKI等序列联合进行多模态MRI纹理分析可能更具价值。

