牛轮状病毒和牛冠状病毒双重TaqMan 荧光定量PCR 检测方法的建立及应用
彭志豪,韩荞忆,崔明江,范葶莉,刘 莹,王梦佳,马玉忠,左玉柱*,任玉红*,范京惠*
(1.河北农业大学动物医学院,河北 保定 071001;2.河北省畜牧总站,河北 石家庄 050035;3.沧州职业技术学院,河北 沧州 061000)
牛轮状病毒(Bovine rotavirus,BRV)和牛冠状病毒(Bovine coronavirus,BCV)是引起犊牛腹泻的主要病原,感染犊牛后引起的疾病具有发病率高、流行性广、危害性大等特点,严重影响我国养牛业的发展。BRV 临床上常导致30 日龄内犊牛水样腹泻、严重脱水和酸中毒,7 日龄犊牛感染BRV 时病死率较高,部分表现为温和性自限性腹泻和隐性感染[1-2]。BCV 主要引起犊牛出血性腹泻、成年牛冬痢和呼吸道感染,该病严重影响病畜的生长发育和生产性能的发挥[1,3]。由于二者临床上难以仅凭症状鉴别,且常发生混合感染,加重腹泻的严重程度,导致死亡率升高[2],因此建立一种快速、灵敏、特异性强的检测方法对准确诊断BRV 和BCV 的感染具有重要意义。
随着分子生物学的发展,PCR 方法在检测中的应用越来越广,而TaqMan 荧光定量PCR 是近些年来新一代的检测方法,该方法用来检测样品的同时还可以对病毒拷贝数准确定量,在病原诊断和分析方面具有更广阔的应用前景[4]。目前,尚无针对BRV 和BCV 的双重TaqMan 荧光定量PCR 检测方法的报道。基于此,本研究根据BRV VP6 基因保守序列和BCV N 基因保守序列分别设计1 对特异性引物和探针,建立了能够同时检测BRV 和BCV 的双重TaqMan 荧光定量PCR 方法,为BRV 和BCV 的临床检测提供了技术手段。
1 材料与方法
1.1 病毒及样品牛轮状病毒(BRV)、牛冠状病毒(BCV)、牛病毒性腹泻病毒(BVDV)、牛细小病毒(BPV)、牛肠道病毒(BEV)、牛传染性鼻气管炎(IBRV)均由河北农业大学动物医学院保存。72 份牛腹泻粪便样品于2019 年3 月~9 月采自河北省不同规模化牛场,保存于-80 ℃。
1.2 主要试剂DNA/RNA 提取试剂盒购自北京全式金生物科技有限公司;质粒小量提取试剂盒、琼脂糖凝胶DNA纯化回收试剂盒、Fast TaqMan Mixture购自北京康为世纪生物科技有限公司;反转录试剂盒、DL2000 DNA Marker、pMD19-T载体、DH5α感受态细胞均购自宝生物工程(大连)有限公司、Super GelRed®核酸染料购自苏州宇恒生物科技有限公司。
1.3 引物和探针的设计与合成根据GenBank 登录 的BRV VP6 基 因(MN047454)和BCV N 基 因(MN517908)序列,利用Beacon designer 7 分别设计2对特异性引物和探针(表1)。引物和探针均由上海生工生物工程技术服务有限公司合成。

表1 荧光定量PCR 探针及引物Table 1 Primers and probes for the real-time PCR
1.4 重组质粒标准品的构建和鉴定利用DNA/RNA 提取试剂盒提取BRV、BCV 病毒核酸,反转录为cDNA 后,分别作为模板,以BRV-F/BRV-R 和BCV-F/BCV-R 引物分别经PCR 扩增相应病毒目的基因。BRV 的反应条件:94 ℃5 min;94℃30 s、53 ℃30 s、72 ℃15 s,共30 个循环;72 ℃10 min。BCV的反应条件:94 ℃3 min;94℃30 s、54 ℃30 s、72 ℃15 s,共30 个循环;72 ℃10 min。PCR 产物纯化回收后连接到pMD19-T 载体,构建重组质粒,PCR 鉴定为阳性后由上海生工生物工程技术服务有限公司测序鉴定,并利用Nanodrop 2000 测定质粒浓度,计算拷贝数,作为相应病毒的质粒标准品。
1.5 双重荧光定量PCR 条件优化及标准曲线的建立
采用方阵法优化引物探针浓度,体系为20 μL,其中2×Fast TaqMan Mixture 10 μL,上下游引物(20 μmol/L)各0.1 μL、0.2 μL、0.3 μL、0.4 μL、0.5 μL、0.6 μL,探针(10 μmo1/L)各0.1 μL、0.2 μL、0.4 μL、0.6 μL、0.8 μL、1.0 μL,BRV 和BCV 重组 质 粒 标 准品 各1 μL 混匀后作为模版,ddH2O 补充至20 μL。使用优化好的引物和探针体系经PCR 扩增,优化退火温度(56 ℃~62 ℃)。
将BRV 和BCV 的重组质粒标准品按1:1 混匀后10 倍倍比稀释,选取6 个浓度(1.0×107拷贝/μL~1.0×102拷贝/μL)作为模板,按照优化好的反应体系和条件进行双重荧光定量PCR 扩增,以标准品浓度的对数为横坐标,Ct 值为纵坐标建立标准曲线。
1.6 特异性试验利用DNA/RNA 提取试剂盒提取BRV、BCV、BVDV、BEV、IBRV、BPV 病毒核酸后,将各病毒DNA 和反转录得到的各病毒cDNA 作为模板,同时以ddH2O 作为阴性对照,利用优化好的反应体系和条件进行双重荧光定量PCR 扩增,评估该方法的特异性。
1.7 敏感性试验将稀释成1.0×107拷贝/μL~1.0×100拷贝/μL 的BRV 和BCV 重组质粒标准品,利用优化后的双重荧光定量PCR 进行扩增,确定其敏感性,同时利用本实验室建立的常规PCR 进行检测,比较两种方法的敏感性。
1.8 重复性试验组内重复性试验:将浓度为1.0×106拷贝/μL~1.0×102拷贝/μL 的BRV 和BCV 重组质粒标准品作为模板,利用优化后的双重荧光定量PCR方法进行组内重复试验,每个浓度重复3 次;选取3 个不同时间,对上述5 个不同浓度的质粒标准品进行组间重复性试验,根据试验结果得到的Ct 值来计算组内组间变异系数,评估该方法的重复性。
1.9 临床样品的检测从河北省不同地区的规模化牛场中采集的72 份腹泻粪便样品,PBS 稀释后提取核酸反转录成cDNA 后作为模板,利用本实验建立的双重TaqMan 荧光定量PCR 方法进行检测,同时利用本实验室建立的常规PCR 对样品进行检测,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 BRV 和BCV 重组质粒标准品的鉴定结果将BRV 和BCV 病毒核酸作为模板,利用BRV-F/BRVR 和BCV-F/BCV-R PCR 扩增后,分别在116 bp 和139 bp 出现和预期相符的目的条带(图1)。PCR 产物纯化回收后克隆至pMD19-T 载体,构建重组质粒pMD-BRV和pMD-BCV,测序结果显示插入片段与预期一致,表明正确构建了重组质粒标准品。经计算pMDBRV和pMD-BCV的拷贝数分别为4.36×1010拷贝/μL和3.55×1010拷贝/μL。

图1 目的基因的PCR 扩增结果Fig.1 Amplification of the target genes by PCR
2.2 双重荧光定量PCR 反应条件的优化结果及标准曲线的建立通过优化后,双重TaqMan 荧光定量PCR 的最佳反应体系为20 μL:Fast TaqMan Mixture 10 μL;BRV-F/BRV-R(20 μmoL/L)各0.3 μL,BRV 探针(10 μmoL/L)0.2 μL;BCV-F/BCV-R(20 μmoL/L)0.2 μL,BCV 探针(10 μmoL/L)0.2 μL;模板2 μL;ddH2O 补齐至20 μL。反应条件确定为:95 ℃5 min;95 ℃10 s,58 ℃30 s,40 个循环,每个循环结束后收集荧光信号。
将BRV 和BCV 重组质粒标准品10 倍倍比稀释后作为模板,经双重TaqMan 荧光定量PCR 扩增。结果显示,当两种质粒标准品在1.0×107拷贝/μL~1.0×102拷贝/μL 时与Ct 值呈现良好的线性关系,回归方程式分别为BRV:y=-3.3064x+38.76 E=107%;BCV:y=-3.1551x+41.81,E=102%,R2均大于99%(图2)。因此可以根据检测样品的Ct 值,对样品进行定量分析。

图2 BRV 和BCV 双重荧光定量PCR 标准曲线Fig.2 Standard curves of BRV and BCV duplex real-time PCR
2.3 特异性试验结果分别以BRV、BCV、BVDV、BEV、IBRV、BPV 的核酸作为模板,同时以ddH2O作为阴性对照,利用优化好的反应体系和条件进行双重TaqMan 荧光定量PCR 扩增。结果显示,除BRV 和BCV 的核酸扩增结果为阳性外,其他均为阴性结果(图3),表明该检测方法具有较强的特异性。
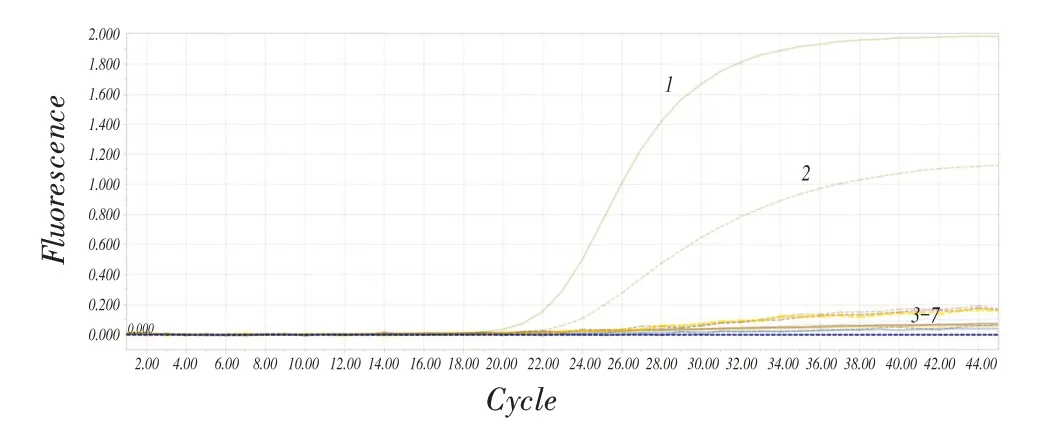
图3 荧光定量PCR 的特异性试验结果Fig.3 Specificity test result of the real-time PCR
2.4 敏感性试验结果将BRV 和BCV 重组质粒标准品稀释成1.0×107拷贝/μL~1.0×100拷贝/μL 后,经双重TaqMan 荧光定量PCR 检测其敏感性。结果显示,BRV 和BCV 的重组质粒标准品最低检测限分别为4.18×101拷贝/μL 和3.55×100拷贝/μL(图4);而常规PCR 对BRV 重组质粒标准品最低检测限为4.18×104拷贝/μL,对BCV重组质粒标准品的检出最低限为3.55×103拷贝/μL(图5)。表明该方法敏感性优于常规PCR,敏感性较高。
2.5 重复性试验结果采用本研究建立的双重Taq⁃Man 荧光定量PCR 进行组内和组间重复性试验,结果显示组内组间的变异系数均小于2%(表2),表明该方法具有良好的重复性。
2.6 临床样品的检测结果利用建立的双重Taq⁃Man 荧光定量PCR 方法对来自河北省的72 份腹泻样品进行检测。结果显示, BRV 阳性率为50.0%(36/72),BCV 阳性率为75.0%(54/72),共感染率为33.3%(24/72);常 规PCR 检 测 的BRV 阳 性 率 为47.2%(34/72),BCV 阳性率为70.8%(51/72),共感染率为29.1%(22/72)。二者检测BRV、BCV 的阳性符合率分别为97.2%,BCV 96.8%(表3)。表明本实验建立的方法优于常规PCR 检测方法,可以应用于临床检测。

表2 TaqMan 荧光定量PCR 的重复性试验结果Table 2 The repeatability test of the TaqMan real-time PCR
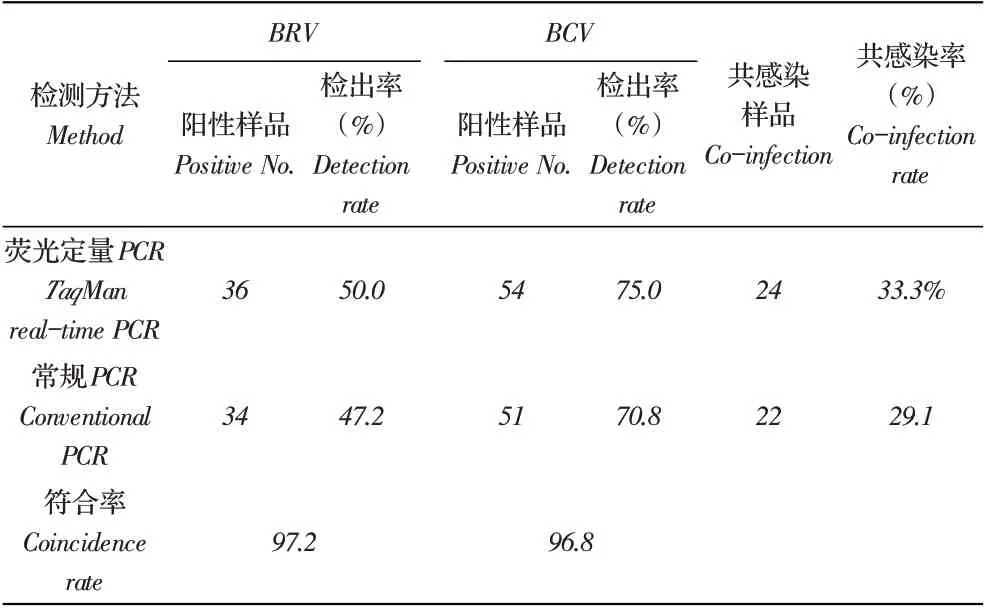
表3 临床样品的检测结果Table 3 Detection of clinical samples with the duplex TaqMan real-time PCR
3 讨 论
BRV 和BCV 是犊牛腹泻的主要病原,严重损害世界各国畜牧业的经济利益。1968 年BRV 首次被Mebus 等分离鉴定,并证明了其对犊牛的致病性[5];1972 年Mebus 等再次从牛腹泻粪便样品中分离出BCV[6];1980 年和1985 年在我国分别确认了BRV 和BCV 的存在[7-8]。这两个病毒自报道以来,其引发的疫病在我国各省市均有发生和流行。有研究表明,在我国新疆地区,BRV 阳性率为92.86%~100%,BCV 阳性率为86.67%~100%,混合感染率为86.67%~100%[9-10]。因此,建立两种病毒的快速、灵敏、特异的检测方法非常重要。
当前用于BRV 和BCV 的检测方法主要有PCR、环介导等温核酸扩增(LAMP)、酶联免疫吸附试验(ELISA)、SYBR Green 荧光定量PCR 法等[11-15],但常规PCR 耗时长,特异性相对较低;而LAMP 因其对环境要求严格,假阳性率较高;ELISA 相较于Taq⁃Man 荧光定量PCR 则具有灵敏度较低、耗时长、成本高等缺点;另外,有研究报道,相较于SYBR Green 荧光定量PCR,TaqMan 荧光定量PCR 的检测结果更佳[16]。TaqMan 荧光定量PCR 具有耗时短、操作简易、灵敏性高、特异性强等优点,对样品检测的同时还可以对其定量分析,因此广泛应用于国内外的临床检测。
目前同时检测BRV 和BCV 方法较少,林初文、沈志强建立了可以同时检测BRV 和BCV 的多重PCR方法[1];曹禹建立了检测BRV 和BCV 的单一SYBR Green I 荧光定量PCR 方法,但无法同时检测BRV 和BCV[13]。目前,尚无同时检测BRV 和BCV 的多重TaqMan 荧光定量PCR 方法,本研究建立的双重Taq⁃Man 荧光定量PCR 方法较林初文、沈志强建立的多重PCR 相比具有更高的灵敏度和特异性;与曹禹建立的方法相比,该方法更敏感、准确,且可以同时检测BRV 和BCV。本研究建立的双重TaqMan 荧光定量PCR 方法对BRV 和BCV 重组质粒标准品的最低检测限分别为41.8 拷贝/μL 和3.55 拷贝/μL,组内组间变异系数均小于2%,与BVDV、BEV、IBRV、BPV 均无交叉反应,临床样品检测结果优于常规PCR,表明本实验建立的方法特异性强,敏感性高,具有较好的重复性和准确性,可以用于BRV 和BCV 的临床检测,为犊牛腹泻病诊断和流行病学调查提供了有效的检测方法,对我国犊牛腹泻病早期诊断和防控具有重要意义。

