再血管化年代冠心病死亡原因分析
盖兢泾,韩志奇,金琴花,盖鲁粤
(解放军总医院第一医学中心心血管内科,北京 100853)
减少心肌耗氧量直到现在一直是冠心病药物治疗的理论基础[1]。1960年5月2日美国开展了第1例冠状动脉搭桥手术(coronary artery bypass graft,CABG)[2]。以后手术方式不断改进,1964年Vasilii Kolesov首次成功实施乳内动脉-冠状动脉吻合术[3]。阿根廷外科医师René Favaloro使用自体的大隐静脉增加冠状动脉供血[4]。CABG术后心绞痛明显改善,从而受到患者和医师的欢迎,但是延长生存的效果并不理想[5]。1974年Gruentzig医师通过股动脉穿剌插入导管对狭窄的冠状动脉进行扩张,患者的心绞痛症状也得到明显改善[6-8]。这两种技术都是以重新建立冠状动脉血液供应为基础,称之为冠状动脉再血管化。急性冠脉综合征再血管化的效果是明显的,可以缓解心绞痛,改善心肌缺血,改善收缩功能,降低死亡[9]。慢性冠心病再血管化降低死亡的效果一直有争议[10]。再血管化本身并非没有问题。桥血管会急性或慢性堵塞,会产生新的病变。冠状动脉介入(percutaneous coronary intervention,PCI)治疗后,球囊扩张后的病变会再狭窄,植入的支架会再狭窄[11-13],冠状动脉本身也会有动态变化,而且有时会很快速,导致急性心肌梗死(acute myocardial infarction,AMI)。除了冠状动脉本身外,其他器官也在发生变化,例如癌症、脑血管意外等,也会导致死亡[14]。因此,分析不同的死亡原因对评价再血管化的效果是必要的,特别重要的是寻找死亡的因果关系。既往的临床研究多是通过长期随访,以心血管死亡和全因死亡作为评价效果的终点。但是这种简单的死亡和全因死亡并不探索死亡的具体原因和因果关系。有些因果关系是非常明确的,例如PCI后并发冠状动脉夹层,冠状动脉急性闭塞,导致死亡,因果关系非常明确;癌症的死亡多与癌症全身转移和多器官功能衰竭有关,而与再血管化无关,也是非常肯定的;再血管化后并发大面积脑梗死,脑梗死和死亡的关系非常明确,而与再血管化没有关系。例如大面积心肌梗死,即使再血管化,左心室功能仍然恶化,最后死于多器官衰竭,这些因果关系模糊。因此,我们暂且进行更细致的分类,将死因分成直接因果关系和非直接因果关系,这样的分类可能有助于今后临床试验终点的制定。
1 对象与方法
1.1 研究对象
连续入选解放军总医院第一医学中心心血管内科2008年1月至2014年1月行冠状动脉造影(coro-nary angiography,CAG)的住院患者共1 645例,根据患者接受的治疗方法分为CABG组284例、优化药物治疗组(optimal medical treatment,OMT)425例、PCI组936例。入选标准:病情稳定1周以上(胸痛症状已经缓解,血流动力学稳定);术前根据医院常规签署知情同意书;年龄18~85周岁;首次行CAG,且结果显示冠状动脉直径狭窄程度≥50%。排除标准:AMI;急性左心衰竭;多次CAG;>85岁;合并其他影响预期寿命的严重疾病,如心脏瓣膜疾病、先天性心脏病、心脏黏液瘤、大动脉疾病;神志不清,不能配合诊断和治疗;严重肾功能不全;恶性肿瘤;严重感染;凝血功能障碍;碘造影剂过敏;未签署随访知情同意书;失去生活自理能力等。
1.2 方法
1.2.1 冠状动脉造影 造影采用Philips和GE Innova 3100血管造影机系统,常规穿刺股动脉或桡动脉,常规静脉注射肝素抗凝,根据主动脉的解剖结构选择合适的造影导管,股动脉多采用Judkins导管,桡动脉采用共用型单根造影导管。造影导管多采用6 F,但根据实际情形也可能采用5 F或7 F。造影剂多采用非碘造影剂,如碘帕醇、碘海醇、碘普罗胺、碘美普尔等,但以碘普罗胺(Iopromide Injection,优维显,拜耳医药保健有限公司广州分公司,0.769 g/ml)造影剂370 mg/ml较多。左冠状动脉采用左前斜位20°向足20°、右前斜10°向头30°、右前斜30°向足30°、右前斜45°向足25°、左前斜40°向头20°,共5个体位进行造影投射;右冠状动脉采用左前斜45°、正位向头30°、右前斜30°,共3个体位进行造影投射。结果主要是根据目测,大致得出冠状动脉狭窄程度,必要时采用定量造影评价系统(quantitative coronary angiography,QCA),由2位高年资介入医师独立进行判断分析,根据造影结果登陆http://www.syntaxscore.com/,利用在线网页工具计算Syntax积分。
1.2.2 各组治疗方法 治疗策略由诊疗小组根据患者入院时的临床情况和CAG结果,结合心外科会诊意见,充分评估不同再血管化方法可能的风险和获益,并征求患者本人的意愿后决定。再血管化治疗选择PCI或CABG,均采用标准术式,如果PCI失败,则进入OMT组,其后患者可以再次考虑PCI或CABG,但随访出现的不良事件会归为该治疗方法组进行分析。PCI组和CABG组患者均同时予以规范的药物治疗。PCI术后服用氯吡格雷75 mg至少12个月,另需长期服用阿司匹林、他汀类、β受体阻滞剂、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)等药物;CABG术后长期服用阿司匹林、他汀类、β受体阻滞剂、ACEI等药物。内科治疗方案还包括戒烟限酒、科学的体育锻炼、低盐低脂饮食、控制体质量等。介入治疗和内科药物治疗参照最新指南。
1.2.3 随访 随访患者以CAG检查后并给予相应的治疗之日为起点,采用以下3种方式。(1)电话随访:请专业的病例随访信息公司杏树林公司协助随访,随访前进行统一培训,根据事先设计好的随访登记表,按要求逐条询问记录,通过反复多次拨打并尽可能多的搜集患者联系电话,随访成功率≥85%。(2)查阅既往住院病历:通过查阅患者在解放军总医院的所有入院病历,详细记录入院时间和原因,是否发生主要不良心脑血管事件(major adverse cardiocerebral events,MACCE),发生的时间、类型、次数及相应的诊疗和转归结果;(3)门诊随访:如CAG后没有再次入院,可记录门诊复查的病情变化和检查化验结果。
随访患者以死亡作为终点。死亡原因的确定,以临死前的最后诊断为依据。癌症死亡应该有明确病因、诊断和治疗过程;冠心病猝死(严格意义上应该是意外死亡),是否符合WHO的猝死标准仍不确定;心力衰竭死亡应有严重临床症状和体征,如心脏扩大、脑利钠肽(brain natriuretic peptide, BNP)>400 pg/ml;ST抬高或非ST抬高心肌梗死应有新出现的Q波、缺血性的胸痛、肌钙蛋白增高;多器官衰竭为发病≥24 h,有两个或两个以上的器官或系统发生功能衰竭;脑血管意外是随访期间发生有定位体征的脑梗死或脑出血,例如偏瘫、失语,同时得到脑部CT或核磁的证实;与再血管化相关的大失血,如消化道溃疡、腹膜后血肿、CAG相关的血红蛋白下降至70 g/L出血等。
1.3 统计学处理
2 结 果
2.1 3组中死亡患者的临床特征
3组患者随访中共有113例死亡。CABG组死亡28例、OMT组死亡22例,PCI组死亡63例。各组死亡患者生前基础临床资料除Syntax积分外,其余指标没有显著差异(表1)。各组死亡患者Syntax积分分别为CABG组(33.45±17.89)分,OMT组(31.23±12.99)分,PCI组(21.35±11.65)分。CABG组、OMT组、PCI组死亡患者Syntax积分依次降低,差异有统计学意义(P<0.05;表1)。
2.2 3组中患者死亡原因分析
分析3组患者中所有死亡患者的随访资料,发现患者死亡原因可以归纳为8种(表2)。从高到低依次为AMI 35.40%,猝死18.58%,癌症15.04%,心力衰竭12.39%,多器官衰竭9.73%,脑梗死5.31%,支架血栓2.65%,出血0.88%。其中,AMI和猝死是主要的死亡原因,占所有死亡的53.98%。
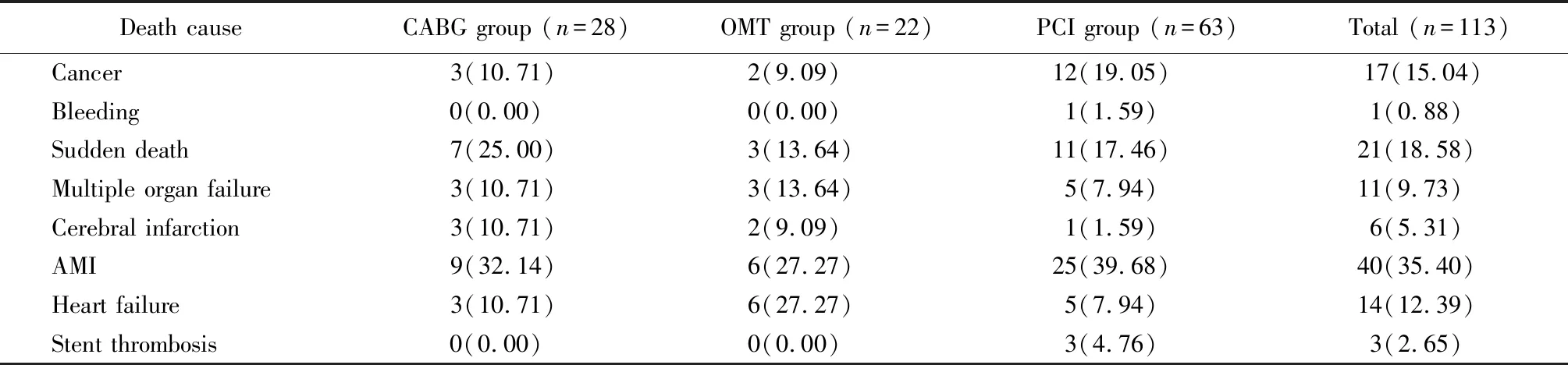
表2 3种治疗方法组中死亡原因的分布Table 2 Distribution of death causes in three treatment groups [n(%)]
3组共113例死亡患者中,CABG组死亡28例(24.78%),OMT组死亡22例(19.47%),PCI组死亡63例(55.75%)。虽然PCI组患者死亡比例明显高于其他2组,但差异无统计学意义(P>0.05)。3组相比,PCI组AMI死亡和猝死比例均最高,但与其他2组差异均无统计学意义(P>0.05)。因支架血栓死亡3例,全部为PCI组患者,但与其他2组相比,差异亦无统计学意义(P>0.05)。
将死亡患者分为非心血管死亡、迁延心血管死亡和意外死亡。非心血管死亡主要是癌症和脑血管意外,占21.23%。迁延心血管死亡主要包括心力衰竭和多器官衰竭,占22.12%。意外死亡主要包括急性心肌梗死、猝死和急性支架血栓,占56.64%。各组间差异无统计学意义(P>0.05;表3)。
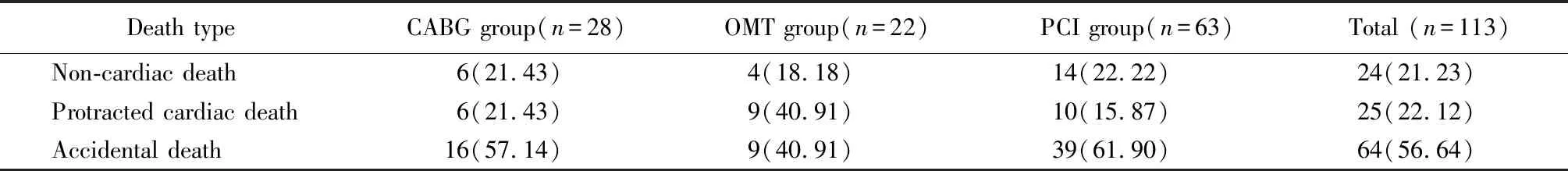
表3 3种治疗方法组中患者死亡类型的分布Table 3 Distribution of death types in three treatment groups [n(%)]
3 讨 论
本研究的主要目的是探讨再血管化年代患者死亡的原因。既往冠心病的治疗主要以药物为主[1]。1974年冠状动脉球囊扩张成功应用于临床治疗,获得了理想的即时效果[6]。但是球囊扩张后急性闭塞和再狭窄发生率仍不理想[7,8]。直到2000年药物洗脱支架诞生后,支架再狭窄率才出现明显的下降,因此得到临床广泛应用[11]。中国2000年以前CABG技术发展较慢[12],但随后获得了长足进展,过去只能是较大的心血管中心才能完成的CABG,现在已快速普及到国内众多心血管中心。李丽等[13]分析了CABG术后症状复发患者的冠状动脉造影特征和缺血原因,发现CABG也可以发生急性闭塞、桥血管狭窄、吻合口狭窄等问题。因此,2008年到2014年的确是再血管化的年代,故本研究选择此时间阶段患者进行分析。全因死亡和心血管死亡是评价冠心病治疗的主要终点指标,但是,这个指标并不理想,也不准确。既往研究并不十分关注具体的死亡原因和死亡的因果关系。本研究将更加细致地研究死亡的具体原因,特别关注死亡的因果关系。例如,癌症晚期与死亡有因果关系。支架血栓导致完全闭塞也是与死亡有因果关系的。但是稳定性心绞痛可能与死亡没有关系。
本研究发现,所有纳入对象中患者死亡的原因可归纳为8种,占比从高到低依次为AMI、猝死、癌症、心力衰竭、多器官衰竭、脑血管死亡、支架血栓和出血。其中,AMI和猝死是主要的死亡原因。3组相比, PCI组AMI和猝死占比均最高,但与其他2组差异均无统计学意义。
鉴于本研究样本量较小,分层过多会弱化组间差异,我们将所有死亡原因分为3大类,即非心血管病死亡,包括癌症和脑血管病;迁延性心血管病死亡,包括多器官衰竭和心力衰竭;意外死亡,包括急性心肌梗死和猝死。分析发现,与CABG和OMT相比,PCI与意外死亡关系最为密切。Syntax研究[14]也分析了再血管化治疗后的死亡原因。研究者们发现CABG组死亡97例,其中心血管死亡48例,占49.4%;PCI组死亡123例,其中心血管死亡83例,占67.5%。心血管死亡以AMI死亡为主,主要发生在PCI组;PCI组AMI占29.3%,而CABG组仅 4.1%,说明AMI死亡与应用支架相关。有关CABG和PCI比较的临床研究较多,普遍认为对于多支血管病变,PCI的死亡率高于CABG,其中主要原因可能是应用支架后发生了再狭窄和血栓[15]。临床真实世界中支架再狭窄和支架血栓也是比较常见的[16-18]。Madhavan 等[19]于2020年进行的支架相关事件的荟萃分析发现,植入支架后事件率(死亡、AMI、心肌缺血所致再血管化、靶血管失败)以2%速度增加,多数与支架相关。
既往的研究只统计全因死亡,没有细化死亡的原因。本研究结果显示癌症是第三位的死亡原因,占15.04%。如果将AMI、猝死和脑血管意外合并为心脑血管疾病,癌症则为第二位的死亡原因。中国心血管病调查的结果显示,心脑血管病的死亡率为42.61%,位列第一;肿瘤的死亡率26.44%,位列第二[20]。心血管内科PCI专业医师通常仅重视冠心病死亡,而忽略癌症死亡。必须强调,治疗冠心病的同时,随着社会老龄化,癌症问题必然出现。患者因冠心病接受再血管化治疗(CABG和PCI),随后发现癌症;或者,因为患有癌症,深入检查又发现了冠心病。外科医师或肿瘤科医师常常因担心心血管方面的危险,而拖延肿瘤的治疗。指南认为,如果患者没有典型心绞痛症状,是没有必要做术前冠状动脉CT检查的,预防性的CAG和PCI并没有足够的依据[21]。本研究的癌症患者有19.05%前接受了PCI操作,寄希望于术前CAG和PCI可以改善心肌缺血,增加手术的安全性,其中大多数是没有症状的冠状动脉狭窄。其实,我们认为,这样做并没有充足的依据,相反,可能还会因为支架再狭窄和支架血栓而死亡[16-18]。
迁延心血管死亡(多器官衰竭和心力衰竭)主要发生于那些久治不愈的患者,这些多为终末期患者,同时受多种因素困扰,包括高龄、心力衰竭、肾衰竭、脑血管意外、长时间住院等。尽管积极治疗,但是仍然回天无力。比较3种治疗方法,其预后差别不大,似乎CABG的效果稍好一些,但是差异没有统计学意义。再血管化治疗可以缓解心绞痛,但是并不能预防死亡。随着科学的进展,过去认为不治的患者现在可以使用机械辅助循环装置进行治疗,例如主动脉气囊反搏、成人体外膜氧合、人工心脏等,心脏支持的手段使患者能维持生命到心脏移植,但是否值得,仍有待探讨[22]。
本研究中,脑血管意外死亡占5.31%, 为2例明确的脑出血。随着抗血小板药物、抗凝药物和溶栓药物的广泛应用,脑出血的发生率也有所增高[23,24]。临床实践中,PCI术后突发脑血管意外的不在少数,多数为脑梗死,可能和导管操作有关;亦有脑出血,多与肝素的应用有关。在广泛溶栓治疗的年代,脑出血多与溶栓剂的应用有关,例如尿激酶、链激酶和重组人组织型纤溶酶原激活物。近年来房颤的诊断和治疗有了新的发展,随之而来的是华法林和新型抗凝药广泛应用,致死性脑出血的发生率也随之增高。
综上所述,PCI术后AMI、猝死和支架血栓并不少见,多与支架植入相关。癌症是第二位的死亡原因,癌症患者再血管化治疗并不能改变预后,应该谨慎。多器官衰竭和心力衰竭病程迁延,其进程很难改变。随着抗血小板药物、抗凝药物和溶栓药物的广泛应用,脑出血的问题将更加凸显。

