循环肿瘤细胞分离富集与分析检测技术的研究进展
蒲思思 周朝辉 贾能勤

摘要:癌症死亡患者中有90%由癌症转移引起,研究表明:患者的外周血、胸腔液等体液中的循环肿瘤细胞(CTC)与癌症转移及肿瘤结节转移(TNM)分期密切相关.因此,CTC检测在实体肿瘤前期诊断、预后及疗效评估等方面扮演着举足轻重的角色,该综述基于CTC区别于正常细胞的物理学、电学、生物学特征,总结了目前CTC分离富集及分析检测技术的研究进展,并就国内外CTC检测面临的挑战进行了讨论,对其未来发展趋势进行了展望.
关键词:循环肿瘤细胞(CTC);CTC检测;分离富集
中图分类号:O6-1;R 730.4 文献标志码:A 文章编号:1000-5137(2020)02-0219-15
0引 言
在1869年,ASHWORTH[]首次报道了血液中存在与其患者肿瘤具有相同大小、形状和外观的上皮肿瘤细胞,即循环肿瘤细胞(CTC).在实体肿瘤部位,肿瘤细胞发生上皮至间充质的转换(EMT),E-钙黏连蛋白表达降低,肿瘤细胞脱离,随后内渗进入血管.多数CTC发生凋亡或被吞噬,只有不足0.01%的CTC可逃过人体自身免疫的捕杀,而肿瘤微栓子(CTM)的集体迁移及更高的存活率,使其更具有转移和侵袭的潜力[2].CTC随着循环系统到达远端器官,再外渗出血管,找到合适的“土壤”,并发生黏附,进行间充质至上皮的转换( MET),开始血管的生成及肿瘤细胞的增殖与生长,继而发展成实体肿瘤,形成致死性转移[3].扩散的肿瘤细胞甚至可以循环到骨髓中,并休眠于此,数年后,重新进入血液形成继发性转移[4].
目前,肿瘤诊断严重依赖于影像学检测和组织切片,肿瘤细胞的脱落、侵袭并进入血液循环是实现肿瘤转移的最初阶段,为最终形成肿瘤转移病灶提供了可能,由此可见,CTC检测对于癌症的早期诊断,以及检测患者的术后复发与转移、评估疗效与预后、选择合适的个体化治疗等方面具有重要的临床意义,且能帮助理解CTC在外周血中的存活、吸附、侵袭等生物学行为,破译肿瘤转移的机制,通过综述CTC富集技术及分析检测技术,深入探讨了CTC检测的研究进展及其面临的挑战,并对未来发展趋势做出展望.
1 CTC分离富集技术
1.1 物理特性富集法
1.1.1基于尺寸差异分离富集
“不死”肿瘤细胞的异常增殖,使其区别于正常细胞,具有较大的核质比及细胞尺寸,且不同肿瘤细胞系的细胞平均直径与白细胞直径的比率不同[5].而白细胞和红细胞等正常血液细胞的尺寸较肿瘤细胞小,红细胞直径约为4~8 um,白细胞尺寸约为6~19 um.该差异为基于细胞尺寸差异的无生物标记的分离富集提供可能,
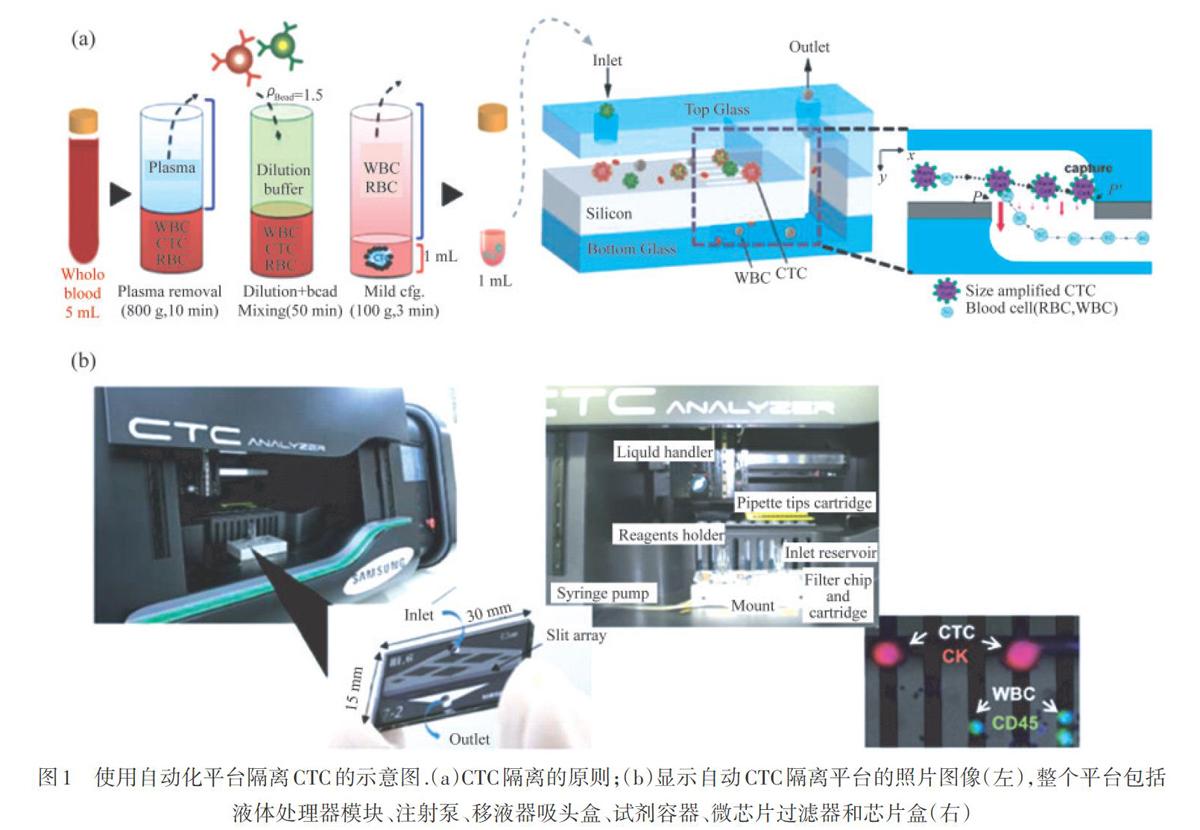
基于尺寸的分离富集常采用8um孔径的临界尺寸(D),有效截留CTC,过滤除去尺寸较小的红细胞、白细胞.2011年,TIBBE等;[6]在上皮肿瘤细胞过滤技术(ISET)平台,采用氢氧化钠刻蚀法制备具有8um孔径的聚碳酸酯膜分选CTC,在4h内成功分离肺癌患者外周血中的CTC和CTM.为避免ISET技术中孔不均匀密度分布的缺点[7],具有体积小、易加工、无毒及易自动化优势的微小型装置被广泛研究,如新月形隔离微结构的微装置[8]、柔性微弹簧阵列装置[9]、蛇纹通道的微装置[10]等,实现了对CTC的高通量、高灵敏检测.ZHENG等[11]采用湿法刻蚀设计了圆形孔(D=11 um)的聚对二甲苯膜微过滤器装置,用于捕获和电解人血液CTC,同时利用聚合酶链反应(PCR)进行基因组分析.除膜过滤,基于细胞尺寸差异捕获的微流控芯片分离富集技术也广受关注[12-14].如图l所示,KIM等[15]通过离心处理血样后,利用CAVl-EpCAM偶联的微球,增大CTC与白细胞的尺寸差异,结合具有狭缝阵列的微流控芯片,自动化分离富集CTC.
基于细胞尺寸差异进行过滤富集CTC的技术避开了依赖于肿瘤细胞表面特异性抗原EpCAM的分离富集技术的局限,但在临床应用中也有缺陷.COUMANS等[16]研究发现,从转移性乳腺癌患者、直肠癌患者、前列腺癌患者的全血中捕获的CTC平均直径为13.1,11.0,10.7 um,比相应肿瘤细胞系的细胞直径小.PARK等[17]研究发现,相比于实验室培养的前列腺癌(prostate)细胞(13.38+2.54 um),从前列腺癌患者外周血中分离出来的CTC具有更小的尺寸(7.97+1.81 um),并且形状更细长,核质比也更高,因此,肿瘤细胞尺寸及其形变能力的异质性,使得基于细胞尺寸差异的分选方法具有较低的特异性及灵敏性,且过滤高浓度的颗粒物容易导致堵塞.
1.1.2密度梯度分离(DGC)
对于复杂的人类外周血,在每毫升约l07~109个血液细胞中,除了极少量的CTC以外,还有大量的红细胞、中性粒细胞和单核细胞,其密度各有不同,红细胞密度为1.10—1.15 g ·mL-1,白细胞密度为1.07—1.09 g·mL-1,而肿瘤细胞的密度相对白细胞较低,基于Stokes-Einstein公式,采用一定密度的等渗溶液,如Ficoll或Percoll细胞分离液,进行密度梯度离心,将目标细胞分离开来.
作为标准化的血液细胞分离方法,密度梯度离心虽操作简单、成本低廉,但回收率低,且CTC纯度低.GERTLER等[18]將新型密度梯度离心系统OriCoQuiCkTM与标准密度梯度离心系统Ficoll进行比较,发现改良的OncoQuickTM密度梯度离心系统,结合基于CTC尺寸差异分离方法,于离心管中放人多孔的过滤膜,从10 mL血液中分离出9.5 xl04个单核细胞,只需转移到1~2个载玻片上进行免疫细胞化学评估,极大地减少了工作量,且提高了CTC检出率.2004年,LARA等[19]研究者结合密度梯度离心、阴性磁分选及过滤法富集CTC.先密度梯度离心除去大量的红细胞,再用免疫磁分选除去大量的白细胞,最后通过过滤法过滤得到目标细胞CTC,如图2所示.该方法有效避免了肿瘤细胞的密度异质性,将白细胞与肿瘤细胞成功地区分开来.
1.1.3介电泳场流分级分离(depFFF)
肿瘤细胞的特殊组成、形态及表型使其介电特性异于红细胞、T淋巴细胞等血液细胞的介电性质.当肿瘤细胞与血液细胞暴露在交变电场中,会发生不同的极化现象,从而具有不同的电动效应,导致细胞出现区域分布,此时若再施加适当的外部力,通常通过流体流动,洗除阴性细胞,便可截留下目标细胞,这样的方法即是基于CTC介电异质性分离富集CTC的介电泳场流分级分离.
1995年,BECKER等[20]采用17.6 mmX55.O mm电极阵列的depFFF腔室,如图3所示,利用介电亲和力成功分离MDA-231乳腺癌细胞,实现了95%以上的回收率.通过断开电压释放被电泳力(DEP)截留的CTC,释放的CTC细胞活性大于98%,并且对CTC的生长能力几乎没有影响.1997年,GASCOYNE等[21]细化并扩展了通过介电亲和力进行细胞分选的原理,并得出了可以评估最佳细胞分选条件和效率的表达式.2009年,GASCOYNE等[22]设计了带有3 000个相互交错的铜金电极元件的depFFF腔室(0.6 mmx25 mmx300mm),实现了模拟小样本的90%以上的肿瘤细胞回收率,并且能在15 min内完成细胞分离.
基于肿瘤细胞介电特性,可以实现对肿瘤细胞不同亚型的分离,且不需要对细胞进行任何的修饰或处理,对CTC下游分析来说,这是关键且重要的.depFFF相比于磁分选,其分选效率、回收率都较高,通过该方法分离富集的未经标记的活肿瘤细胞可用于培养,并进行所有分子类型的分析检测.depFFF也可作为常规方法的辅助手段,以提高诊断和细胞分离应用的总体分辨率、速度和效率.
1.2亲和性富集法
1.2.1磁分选富集技术
区别于正常细胞,肿瘤细胞表面会上调或下调相关抗原、蛋白质表达量,如上皮肿瘤细胞表面的上皮细胞黏附分子(EpCAM)、乳腺癌细胞表面人类表皮生长因子受体2(HER2)、非小细胞肺癌细胞表面表皮生长因子受体(EGFR)等,而正常细胞表面低表达,甚至不表达.再如白细胞表面特异性表达白细胞共同抗原(如CD45抗原),则在肿瘤细胞中不表达.磁分选富集技术,即基于这样的生物学特征,在具有超顺磁性的颗粒表面偶联特异性抗体,如抗一上皮细胞黏附分子(EpCAM抗体/anti-EpCAM)、靶向肿瘤细胞,在外加磁场的作用下,肿瘤细胞被吸引而滞留在磁场中,从而分离出目标细胞(阳性分选),或是通过抗白细胞共同抗原的CD45抗体移除血液中的白细胞、巨核细胞及血小板(阴性分选).基于免疫学方法对CTC进行富集,具有极高的特异性.
唯一被美国食品药品管理局(FDA)批准的CellSearchTM( Veridex)半白动检测系统,通过免疫铁磁流体靶向CTC表面的EpCAM抗原,从全血中分选CTC,然后对CTC进行肿瘤标记染色并使用荧光显微镜计数,能可靠地检测出血液中的CTC,适用于临床实验室对转移性乳腺癌、结直肠癌和前列腺癌患者的常规评估[23-24].且联合抗一细胞角蛋白(CK抗体)、EpCAM抗体捕获,能显著提升CellSearch系统的灵敏度[24].此外,亦有多种技术平台基于免疫磁分选技术富集CTC,如MagSweeper[25]、磁激活细胞分选技术( MACS)[26].除了anti-EpCAM特異性识别分子,周朝辉等[27]设计了anti-EGFR抗体偶联的免疫磁珠,结合磁分选技术与免疫荧光技术实现了对非小型肺癌细胞A549的检测,
以上方法均在体外捕获CTC,2008年哈佛医学院的VERMESH等[28]开发了柔性磁力“鱼线”(MagWIRE),希望能直接在患者静脉血管中富集CTC,如图4所示,他们选择在活猪的耳静脉血管中模拟“磁钓”癌细胞,MagWIRE成功捕获了循环肿瘤细胞,并且回收了34%的免疫磁珠,该“磁钓”CTC的回收率是体外磁分选CTC的10~80倍.
中国科学院国家纳米科学中心研究院PENG等[29-31]开发了拥有独立知识产权的新技术“肿瘤捕手”,通过筛选特异性多肽,并巧妙地组装到纳米磁珠表面,克服了抗体磁珠的位点少、方向性差、靶向性差的缺点,实现了在模拟血液中大于80%的CTC捕获率,而传统的抗体磁珠捕获率仅在30%左右.2015年,中国科学院HUANG等[32]以免疫活细胞为生物模板,并结合表面化学,仿生制备了“Smart”免疫磁珠,实现对CTC的高靶向效率,比商业化的磁珠(Dynabeads M280,Invitrogen)具有更高的捕获率,并通过可切割的二硫键,按需释放捕获的活肿瘤细胞.
综上所述,基于抗体一抗原识别的免疫磁分选技术具有极高的特异性,但也较为耗时耗财,由于其依赖于肿瘤细胞表面特异性抗原的表达,CTC的异质性也影响了该技术对CTC的分选效率.
1.2.2微流控芯片技术
近年来,基于CTC物理特性和生化特性的免疫微流控芯片受到广泛重视.2007年,NAGRATH等J33j构筑了微柱“CTC-chip”芯片,通过化学方法将anti-EpCAM抗体修饰到微柱阵列表面,在116个癌症患者中成功检测出115个癌症转移患者,并在7例早期癌症患者的外周血中均检测到CTC,每毫升外周血中CTC数量在5~1 281个变化(纯度为50%).STOTT等[34]设计的人骨形免疫(anti-EpCAM)芯片“HB-Chip”,从15位转移性前列腺癌患者中检测出14位的外周血中有CTC(检出率为93%).麻省理工学院的PARK等J35J将金纳米颗粒应用到HB-Chip芯片中(NP-HBCrC-C}iip),采用谷胱甘肽(GSH)通过化学配体交换实现竞争反应,释放高活性的CTC,为后续的RNA基因测序等研究提供便利.改良的人骨形芯片的微通道使流体产生微涡流,以增加肿瘤细胞与芯片表面抗体的接触机会,从而实现了高通量、高灵敏及高特异性的捕获CTC,且能检出之前不被重视的细胞团簇.2014年,KARABACAK等[36]设计的CTC-iChip芯片利用确定性侧向位移(DLD)原理及惯性聚焦,在一个平台上实现两步法分选CTC,如图5所示,在模组1利用确定性侧向位移(DLD)原理,将血液红细胞进行分离弃除;在模组2使用磁泳法分离出CD45功能化磁珠标记的白细胞,分选CTC.CTC-iChip可处理8 mL·h-1全血,回收(97±2.7)%的癌细胞,
此外,捕获界面的纳米结构在微流控芯片中也被广泛研究.如利用混沌混合器使流体产生垂直流向,结合二氧化硅( Si02)三维纳米结构高效捕获CTC[37].2018年CUI等[38]通过正硅酸四乙酯原位水解法,在生物芯片表面生长Si02纳米阵列,以促进生物芯片与CTC微绒毛及丝状伪足之间的地形相互作用,协同特异性靶向作用捕获CTC.实验证明,相比光滑的表面,纳米线修饰的具有纳米结构的表面对CTC具有更高的捕获率(85.4±8.3)%.如图6所示,人体前列腺癌细胞PC-3与光滑表面的接触面积很小,而在纳米三维结构的界面上,PC-3伸出更多伪足与界面相互作用,并铺展开来,
相比于传统方法,微流控芯片结合亲和分选方法,利用流体动力学分离细胞,具有更高的分辨率和灵敏度,易实现单个CTC分选及检测工作,操作简单高效,且尽可能地避免了人为误差,但该方法与免疫磁分选类似,筛选靶向目标细胞的特异性抗体是该技术难点及瓶颈.
2 CTC的分析检测技术
2.1 免疫熒光染色检测
免疫荧光检测法作为传统CTC鉴定方法,即将荧光素偶联的荧光抗体与肿瘤细胞进行抗体抗原特异性反应,在荧光显微镜下观察,借此对肿瘤细胞进行鉴定及定位.在CeIISearch系统中,通过结合CD45绿色荧光抗体(靶向白细胞)、CK8/18/19红色荧光抗体(靶向肿瘤细胞)与细胞核DAPI蓝色荧光染色剂对CTC进行荧光识别鉴定[23-24].具有红色和蓝色荧光,无绿色荧光(CK+/CD45-/DAPI+)的细胞鉴定为CTC,具有绿色和蓝色荧光,无红色荧光(CK-/CD45+/DAPI+)的细胞则是白细胞,如图7所示[39].该方法是大部分实验室采用的CTC鉴定方法,通过免疫荧光鉴定CTC表面相关特异性蛋白的表达,该检测方法具有耐污染的优势,但易产生假阳性结果,且操作复杂、耗时耗力,因此不宜大规模使用.
2.2核酸分析检测
近年来,基于CTC中核酸的分子分析方法被不断开发用于CTC鉴定,定量逆转录聚合酶链反应(RT-qPCR)作为一种被广泛使用的检测手段,可在106个白细胞的复杂背景下检测到一个CTC,并定量CTC相关基因的表达情况.CK-19-mRNA作为CTC的特异性核酸序列,是RT-qPCR定量检测的普遍目标[40].STATHOPOULOU等[41-42]采用LightCyclerTM(Roche)系统,通过优化扩增引物,实时地定量检测外周血中CK-19-mRNA,极大提高了检测的特异性和灵敏性.Multiplex-RT-qPCR可以在一个样本中同时评估多个目标分子(如:EpCAM,MUC-1,HER2等),这有利于对有限的CTC进行更高灵敏度的检测[43],如图8所示,甲基化特异性基因聚合酶链式反应(MSP)的出现也证明了CTC多参数检测的重要性[44],
通过荧光素标记的DNA探针与CTC细胞核内的DNA靶序列杂交,从而获得核内染色体或基因拷贝状态的相关信息的荧光原位杂交(FISH)法,可用于评估乳腺癌、前列腺癌患者CTC中的HER2的表达情况[45-46],及ALK基因的复制数量[47].相比于PCR,FISH具有较高的抗污染能力,且重复性好.
总之,相比于免疫荧光成像,核酸分析更客观、可量化、成本低,不需要专门的检验师评估,易实现自动化及标准化.核酸检测可以确定与治疗相关的分子靶标,如:基因突变、染色体易位等,从而指导患者的个性化治疗.但是,由于CTC的异质性,分子分析法无法对CTC个数进行绝对定量.
2.3光学分析检测
稀土发光材料的荧光信号亦被应用于CTC检测.2015年,WANG等[37]结合上转换磁性复合免疫材料(NaYF4-Fe3O4-Ab)及硅纳米线整合的芯片,进行CTC捕获,实现近红外(980 nm)上转换荧光(UCL)成像.2019年,GUO等[48]结合时间分辨光致发光技术(TRPL技术)和稀土纳米材料(NaEuF4-Ab)溶解增强荧光放大技术,通过100us的延迟,大大消除了短周期背景信号,提高了信噪比,首次实现了全血中CTC的高灵敏直接检测,如图9所示.
基于材料的荧光信号检测,极大简化了操作过程,精准灵敏,且较为客观.但由于该方法需要对细胞进行特异性荧光材料的孵育,易造成样品污染,细胞存活率也低.
2.4拉曼检测
拉曼检测多用于分子层面的检测,近年来,由于拉曼检测具有信号稳定、检测限低、灵敏度高的优势,其在CTC检测领域被广泛关注.利用特异性靶向磁珠及表面增强拉曼(SERS)探针与CTC形成三明治夹结构是研究者普遍选择的方法,实现对CTC的拉曼检测[49-50].XUE等[51]则合成金纳米粒子(Au NPs)包裹的超顺磁性纳米球(SPION-PEI),并采用巯基苯甲酸(MBA)、还原性牛血清蛋白(r-BSA)与叶酸(FA)进行层层修饰,巧妙设计了SPION-PEI@Au NPs-MBA-r-BSA-FA复合SERS探针,实现了对宫颈癌患者的CTC(检测限为1个·mL-I)的捕获检测及释放,如图10所示.
研究表明,该方法有效避开了免疫荧光检测的光降解及光漂白劣势,灵敏度可以与RT-qPCR相媲美,制样简单,测量高效准确,但由于CTC在外周血中极少,这对SERS探针的设计提出了更高的要求,且设备昂贵.
2.5其他分析检测方法
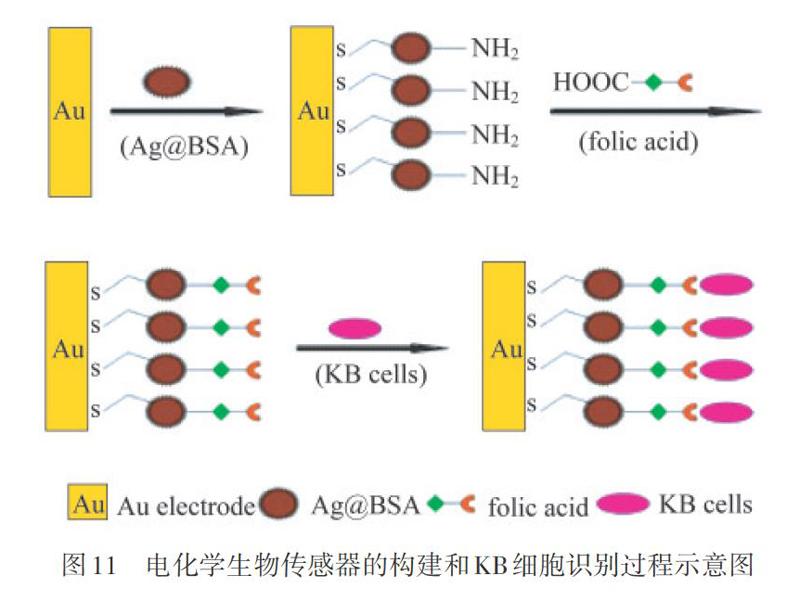
除上述CTC检测方法,研究者亦将电化学传感器应用于CTC检测.如图11所示,HU等[52]将通过生物模板法合成的牛血清蛋白包裹的银纳米微球( Ag@BSA)负载于金电极上,构筑了新型的细胞传感器,灵敏检测了人口腔表皮样癌细胞(KB瘤细胞),实现了电化学方法检测CTC(检测限:20个·mL-l KB细胞).为提高电化学检测灵敏度,QU等[53]构建了一个两种特异性适配体修饰(ss-TLSlc,ds-TLSlla)的超灵敏电化学传感器.电化学检测具有检测方便、灵敏度高的优势,且易实现便携式仪器检测,在CTC检测的临床应用中具有广阔的应用前景.此外,其他检测方法如酶联免疫检测( ELISA)也被应用于CTC检测[54].KIM等[55]利用四氧化三铁(Fe304)纳米颗粒及铂(Pt)纳米颗粒的协同催化效应,将两者负载在氧化石墨烯(GO)上,制备特异性抗体修饰的纳米复合材料,通过3,3,5,5一四甲基联苯胺(TMB)催化显色,实现比色检测CTC.但该方法灵敏度有限,且对样品纯度要求高,其捕获效率还有待提高,总的来说,以上检测方法为CTC检测开拓了新思路.
3 CTC檢测面临的挑战及展望
目前,基于肿瘤细胞的物理电学特性进行分离的技术缺乏特异性,因此联合利用CTC的物理及生物特性,结合蛋白及核酸分析,可实现对CTC的高效精准捕获及检测.
然而,CTC检测面临的挑战也不容忽视.首先,CTC在复杂的血液背景下,含量极少.且CTC具有异质性,没有一种抗体能特异性100%靶向某种肿瘤细胞,只有约60%的CTC携带着生源实体肿瘤的生物信息.由于CellSearch仅适用于少数类型的癌症,且检测灵敏度不高,无法分离活的CTC,因而较大程度地限制了其在临床检测中的有效应用,为应对该挑战,有研究联合使用多种抗体,对肿瘤细胞表面抗原进行表达分型,实现更高灵敏性检测,或是寻找新的蛋白,如肌动蛋白结合蛋白( plastin-danbai) [56].最后,抗体定向偶联亦是CTC检测面临的一项技术挑战,抗体取向决定着抗原结合位点的活性,也就决定着材料或设备对肿瘤细胞的靶向能力[57-58],抑或是用分子更小的特异性靶向多肽替换抗体,实现更高灵敏度的检测[29-30].此外,寻找具有肿瘤特异性的其他生物标志物也是研究的热点.肿瘤来源外泌体相比于CTC,是具有脂质双分子层膜结构的小囊泡,结构稳定,尺寸小(30~150 nm),且量多.外泌体参与细胞通信、迁移,促血管新生和抗肿瘤免疫等生理过程,与多种疾病的发生和进程密切相关[59].2016年,在液体活检领域,基于一种新的生物标志物,外泌体的肿瘤诊断产品首次在美国上市[60].因此,作为CTC的替代与补充,肿瘤来源的外泌体的检测对于肿瘤早期预警具有很大的临床应用前景.
总的来说,CTC检测具有很大潜力,基于理论技术和深入探索,仍有望实现对CTC的高灵敏度、高特异性、高通量及高活性的分选,达到精准检测.
参考文献:
[1] ASHWORTH T R.A case of cancer in which cells similar to those in the tumours were seen in the blood after death [J].Australasian Medical Journal, 1869, 14: 146 - 149.
[2]HOU J M,KREBS M G,LANCASHIRE L,et al.Clinical significance and molecular characteristics of circulating tumorcells and circulating tumor microemboli in patients with small-cell lung cancer[J].Journal of Clinical Oncology, 2012, 30(5):525 - 532.
[3] MICALIZZI D S,FARABAUGH S M,FORD H L.Epithelial-mesenchymal transition in cancer: parallels hetween normaldevelopment and tumor progression [J].Journal of Mammary Gland Biology and Neoplasia ,2010,15(2):117 - 134.
[4]RIETHDORF S,WIKMAN H,PANTEL K.Biological relevance of disseminated tumor cells in cancer patients[J].International Journal of Cancer,2008 ,123(9):1991 - 2006.
[5] VONA G,SABILE A,LOUHA M, et al_Isolation by size of epithelial tumor cells:a new method for theimmunomorphological and molecular characterization of circulating tumor cells [J].The American Journal of Pathology,2000,156(1):57 - 63.
[6]TIBBE A G,DE GROOTH B G,GREVE J,et al.Optical tracking and detection of immunomagnetically selected andaligned cells [J].Nature Biotechnology, 1999 ,17( 12): 1210 - 1213.
[7] ROSTAGNO P,MOLL J, BISCONTE J, et al.Detection of rare circulating breast cancer cells by filtration cytometry andidentification by DNA content: sensitivity in an experimental model [J].Anticancer Research, 1997, 17( 4A): 2481 -2485.
[8] TAN S J,YOBAS L,LEE G Y,et al.Microdevice for the isolation and enumeration of cancer cells from blood [J].BiomedMicrodevices,2009,1 1(4):883 - 892.
[9] HAROUAKA R A,ZHOU M D,YEH Y T,et al.Flexible micro spring array device for high-throughput enrichment ofviable circulating tumor cells [J].Clinical Cheruistry ,2014 ,60(2):323 - 333.
[10]KUO J S,ZHAO Y,SCHIRO P G,et al.Deformability considerations in filtration of biological cells[J].Lah on a Chip,2010,10(7):837- 842.
[11] ZHENG S, LIN H, LIU J Q,et al.Membrane microfilter device for selective capture, electrolysis and genomic analysis ofhuman circulating tumor cells[J].Journal of ChromatographyA ,2007, 1162(2): 154 - 161.
[12]DONG Y, SKELLEY A M, MERDEK K D,et al.Microfluidics and circulating tumor cells [J].The Journal of MolecularDiagnostics,2013,15(2):149 - 157.
[13] HUANG T,JIA C P, SUNW J,etal.Highly sensitive enumeration of circulating tumor cells in lung cancer patients usinga size-based filtration microfluidic chip[J].Biosensors and Bioelectronics ,2014, 51: 213 - 218.
[14] YAMADA M, NAKASHIMA M, SEKI M.Pinched flow fractionation: continuous size separation of particles utilizing alaminar flow profile in a pinched microchannel[J].Analytical Chemistry ,2004 ,76( 18): 5465 - 5471.
[15] KIM Y J,KOO G B, LEE J Y, et al.A microchip filter device incorporating slit arrays and 3-D flow for detection ofcirculating tumor cells using CAV l-EpCAM conjugated microbeads[J].Biomaterials ,2014,35( 26): 7501 - 7510.
[16] COUMANS F A,VAN DALVM G,BECK M,et al.Filter characteristics influencing circulating tumor cell enrichment fromwhole blood[J ].PLoS ONE ,2013, 8(4): e61770.
[17] PARK S,ANG R R, DUFFY S P,et al.Morphological differences between circulating tumor cells from prostate cancerpatients and cultured prostate cancer cells[J ].PLoS ONE ,2014,9(1):e85264.
[18] GERTLER R, ROSENBERG R, FUEHRER K, et al.Detection of circulating tumor cells in blood using an optimizeddensity gradient centrifugation [C]//ALLGAYER H, HEISS M M, SCHILDBERG F W.Molecular Staging of Cancer.Berlin:Springer,2003.
[19] LARA O,TONG X,ZBOROWSKI M ,et al.Enrichment of rare cancer cells through depletion of normal cells using densityand flow-through ,immunomagnetic cell separation[J].Experimental Hematology,2004, 32( 10): 891 - 904.
[20] BECKER F F,WANG X B,HUANG Y, et al.Separation of human breast cancer cells from blood by differential dielectricaffinity [J].Proceedings of the National Academy of Sciences, 1995,92(3):860 - 864.
[21]GASCOYNE P R, WANG X B, HUANG Y, et al.Dielectrophoretic separation of cancer cells from blood [J].IEEETransactions on Industry Applications,1997,33(3):670 - 678.
[22] GASCOYNE P R, NOSHARI J, ANDERSONT J,et al.lsolation of rare cells from cell mixtures by dielectrophoresis [J].Electrophoresis ,2009,30(8):1388 - 1398.
[23] CRISTOFANILLI M ,BUDD G T,ELLIS M J,et al.Circulating tumor cells, disease progression ,and survival in metastaticbreast cancer[J ].New England Journal of Medicine ,2004 ,351(8):781 - 791.
[24]DENG G, HERRLER M, BURGESS D, et al.Enrichment with anti-cytokeratin alone or combined with anti-EpCAMantibodies significantly increases the sensitivity for circulating tumor cell detection in metastatic breast cancer patients[J].Breast Cancer Research ,2008, 10(4):R69.
[25] TALASAZ A H,POWELL A A, HUBER D E,et al.lsolating highly enriched populations of circulating epithelial cells andother rare cells from blood using a magnetic sweeper device [J].Proceedings of the National Academy of Sciences, 2009,106(10):3970-3975.
[26] HYUN K A,LEE T Y,LEE S H,et al.Two-stage microfluidic chip for selective isolation of circulating tumor cells( CTCs)[J].Biosensors and Bioelectronics ,2015 ,67: 86 - 92.
[27] 周朝輝,付聪颖,贾能勤.基于磁分选技术和间接免疫荧光技术的肺癌A549细胞的分离检测[J].上海师范大学学报(自然科学版),2017,46(4):489 - 498.
ZHOU C H, FU C Y, JIA N Q.Isolation and detection of A549 lung cancer cells based on magnetic separation andindirectimmunofluorescence technologies[J].Journal of Shanghai Normal University( Natural Sciences), 2017, 46 (4):489 - 498.
[28] VERMESH O,AALIPOUR A,GE T J,et al.An intravascular magnetic wire for the high-throughput retrieval of circulatingtumour cells in, vivo [J].Nature Biomedical Engineering,2018,2( 9 ) : 696 - 705.
[29]PENG J, ZHAO Q, ZHENG W, et al.Peptide-functionalized nanomaterials for the efficient isolation of HER2-positivecirculating tumor cells [J ].ACS Applied Materials & Interfaces ,2017,9( 22) : 18423 - 18428.
[30] BAI L,DU Y, PENG J,et al.Peptide-based isolation of circulating tumor cells by magnetic nanoparticles [J].Journal ofMaterials Chemistry B ,2014 ,2( 26) : 4080 - 4088.
[31] XIANG Z , YANG X, XU J , et al.Tumor detection using magnetosome nanoparticles functionalized with a newly screenedEGFR/HER2 targeting peptide [J] .Biomaterials ,2017, 115 :53 - 64.
[32] HUANG C , YANG G, HA Q, et al.Multifunctional “smart”particles engineered from live immunocytes : toward captureand release of cancer cells [J].Advanced Materials ,2015 ,27( 2 ) : 310 - 313.
[33] NAGRATH S,SEQUIST L V,MAHESWARAN S,et al.lsolation of rare circulating tumour cells in cancer patients bymicrochip technology [J ].Nature , 2007,450( 7173 ) : 1235 - 1239.
[34] STOTT S L, HSU C H, TSUKROV D I, et al.lsolation of circulating tumor cells using a microvortex-generatingherringbone-chip [J ] .Proceedings of the National Academy of Sciences,2010,107 ( 43 ) : 18392 - 18397.
[35] PARK M H, REATEGUI E, LI W, et al.Enhanced isolation and release of circulating tumor cells using nanoparticlebinding and ligand exchange in a microfluidic chip [ J ] .Journal of the American Chemical Society ,2017 , 139 ( 7) : 2741 -2749.
[36] KARABACAK N M , SPUHLER P S, FACHIN F, et al.Microfluidic , marker-free isolation of circulating tumor cells fromblood samples [J].Nature Protocols ,2014,9(3 ) : 694 - 710.
[37] WANG C, YE M, CHENG L, et al.Simultaneous isolation and detection of circulating tumor cells with a microfluidicsilicon-nanowire-array integrated with magnetic upconversion nanoprobes [J].Biomaterials,2015 ,54 : 55 - 62.
[38] CUI H, WANG B, WANG W, et al.Frosted slides decorated with silica nanowires for detecting circulating tumor cellsfrom prostate cancer patients [J].ACS Applied Materials & Interfaces,2018, 10( 23 ) : 19545 - 19553.
[39] YOON H J, KIM T H,ZHANG Z, et al.Sensitive capture of circulating tumour cells by functionalized graphene oxidenanosheets [J].Nature Nanotechnology ,2013 ,8( 11 ) : 735 - 741.
[40]DATTA Y H,ADAMS P T,DROBYSKI W R,et al.Sensitive detection of occult breast cancer by the reverse-transcriptasepolymerase chain reaction [J] .Journal of Clinical Oncology , 1994 ,12( 3 ) : 475 - 482.
[41]STATHOPOULOU A , GIZI A , PERRAKI M , et al.Real-time quantification of CK-19 mRNA-positive cells in peripheralblood of breast cancer patients using the lightcycler system [J] .Clinical Cancer Research ,2003,9( 14) :5145 - 515 1.
[42 ] STATHOPOULOU A , NTOULIA M , PERRAKI M , et al.A highly specific real-time RT-PCR method for the quantitative determination of CK-19 mRNA positive cells in peripheral blood of patients with operable breast cancer [J].InternationalJournal of Cancer,2006 ,119( 7) : 1654 - 1659.
[43]SIEUWERTS A M, KRAAN J, BOLT DE VRIES J, et al.Molecular characterization of circulating tumor cells in largequantities of contaminating leukocytes by a multiplex real-time PCR [J].Breast Cancer Research and Treatment, 2009,118(3):455 -468.
[44]CHIMONIDOU M,KALLERGI G, GEORGOULIAS V,et al.Breast cancer metastasis suppressor-l promoter methylationin primary breast tumors and corresponding circulating tumor cells [J]. Molecular Cancer Research, 2013, 11 (10) :1248 - 1257.
[45]DI CARLO D,IRIMIA D, TOMPKINS R G, et al.Continuous inertial focusing, ordering, and separation of particles inmicrochannels [J ].Proceedings of the National Academy of Sciences ,2007 ,104 ( 48) : 18892 - 18897.
[46]LEVERSHA M A, HAN J, ASGARI Z, et al.Fluorescence in, situ hybridization analysis of circulating tumor cells inmetastatic prostate cancer [J ] .Clinical Cancer Research ,2009, 15 ( 6) :2091 - 2097.
[47]KHOO B L,WARKIANI M E,TAN D S W,et al.Clinical validation of an ultra high-throughput spiral microfluidics forthe detection and enrichment of viable circulating tumor cells [J ] .PLoS ONE ,2014 ,9( 7) :e99409.
[48] GUO H,SONG X,LEI W,et al.Direct detection of circulating tumor cells in whole blood using time-resolved luminescentlanthanide nanoprobes [ J ] .Angewandte Chemie ,2019 ,58( 35) :12195 - 12199.
[49] SHA M Y,XU H,NATAN M J, et al.Surface-enhanced Raman scattering; tags for rapid and homogeneous detection ofcirculating tumor cells in the presence of human whole blood [J].Journal of the American Chemical Society,2008, 130( 51) :17214 - 17215.
[50]RUAN H,WU X,YANG C,et al.A supersensitive CTC analysis system based on triangular silver nanoprisms and SPIONwith function of capture , enrichment, detection, and release [J].ACS Biomaterials Science & Engineering , 2018, 4 ( 3 ) :1073 - 1082.
[51] XUE T, WANG S, OU G, et al. Detection of circulating tumor cells based on improved SERS-active magneticnanoparticles [J ].Analytical Methods ,2019 ,11( 22) :2918 - 2928.
[52]HU C Y,YANG D P,WANG Z H,et al.Bio-mimetically synthesized Ag@BSA microspheres as a novel electrochemicalbiosensing interface for sensitive detection of tumor cells [J].Biosensors & Bioelectronics ,2013 ,41 : 656 - 662.
[53] QU L, XU J, TAN X, et al.Dual-aptamer modification generates a unique interface for highly sensitive and specificelectrochemical detection of tumor cells [J ].ACS Applied Materials & Interfaces ,2014 ,6( 10) : 7309 - 7315.
[54]SAFAEI T S, MOHAMADI R M, SARGENT E H, et al.in, situ electrochemical ELISA for specific identification ofcaptured cancer cells [J ] .ACS Applied Materials & Interfaces ,2015 ,7( 26) : 14165 - 14169.
[55] KIM M I, KIM M S, WOO M A, et al.Highly efficient colorimetric detection of target cancer cells utilizing superiorcatalytic activity of graphene oxide-magnetic-platinum nanohybrids [ J].Nanoscale ,2014,6 ( 3 ) : 1529 - 1536.
[56] YOKOBORI T,IINUMA H,SHIMAMURA T, et al.Plastin3 is a novel marker for circulating tumor cells undergoing theepithelial-mesenchymal transition and is associated with colorectal cancer prognosis [J ].Cancer Research , 2013 , 73 ( 7 ) :2059 - 2069.
[57]LOU D, FAN L, CUI Y, et al. Fluorescent nanoprobes with oriented modified antibodies to improve lateral flowimmunoassay of cardiac troponin I [J].Analytical Chemistry , 2018,90( 11) :6502 - 6508.
[58]LOU D,JI L, FAN L,et al.Antibody-oriented strategy and mechanism for the preparation of fluorescent nanoprobes forfast and sensitive immunodetection [J ].Langmuir,2019 ,35 ( 14) :4860 - 4867.
[59] SHARMA S,ZUNIGA F,RICE G E,et al.Tumor-derived exosomes m ovarian cancer-liquid biopsies for early detectionand real-time monitoring of cancer progression [ J].Oncotarget ,2017 , 8 ( 61 ) : 104687.
[ 60]SHERIDAN C.Exosome cancer diagnostic reaches market [J ].Nature Biotechnology,2016,34(4) :359 - 360.
(責任编辑:郁慧,包震宇)
收稿日期:2019-12-12
基金项目:上海市地方院校能力建设专项(17070503000)
作者简介:蒲思思(1993-),女,硕士研究生,主要从事纳米生物技术方面的研究.E-mail:Pss_Anita@163.com
通信作者:贾能勤(1970-),男,教授,主要从事生物电化学、生物传感器和纳米生物技术方面的研究.E-mail:nqjia@shnu.edu.cn
引用格式:蒲思思,周朝辉,贾能勤.循环肿瘤细胞分离富集与分析检测技术的研究进展[J].上海师范大学学报(自然科学版),2020,49(2):219-233.

