β-HgS对丙咪嗪缓解小鼠抑郁的增效作用
乔亚俊,高婷婷,李岑,张明,魏立新,毕宏涛
(1.中国科学院西北高原生物研究所,中国科学院藏药研究重点实验室,青海省藏药药理学和安全性评价研究重点实验室,青海 西宁 810001;2.南方医科大学公共卫生学院心理学系,广东 广州 510515;3.中国科学院大学,北京 100049)
随着生活方式和社会心理环境的改变,抑郁症的发病率逐年增加.Ali等[1]预测,2020年抑郁症将成为全球疾病负担的第二大诱因.世界卫生组织(WHO)统计,目前全球约有3.5亿人遭受抑郁症的折磨,预计到2030年将成为全球首要疾病负担[2].
目前,临床使用的抗抑郁药物主要有4类:三环类药物(TCAs)、五羟色胺再摄取抑制剂(SSRIs)、选择性五羟色胺去甲肾上腺素再摄取抑制剂(SNRIs)和单胺氧化酶抑制剂(MAOIs),此外还有安非他酮、奈法唑酮、曲唑酮、米氮平等其他类药物[3].尽管治疗抑郁症临床用药诸多,但抑郁症的防治仍缺乏快速及长期有效的干预策略[4].因此,现有抗抑郁药的辅助治疗药物研发成为抑郁症药物治疗的研究热点之一.
丙咪嗪(imipramine,IMI)是世界第一种三环类抗抑郁药物,1957年成功合成至今,被广泛用于治疗内因性抑郁症,也可用于治疗官能性或反应性抑郁症.丙咪嗪的研发成功在抗抑郁药发展史上具有里程碑式的意义[5].藏药“佐太”是藏语“仁青欧曲佐珠钦木”的简称,也叫“甘露精王”,始载于公元8世纪宇妥宁玛·元丹贡布编著的《四部医典》.佐太在藏药中最为贵重,被藏族人民称为“众药之王”,是生产“七十味珍珠丸”等名贵藏药的主要原料.赵静等[6]研究表明,佐太能够通过抑制HPA轴亢奋和上调单胺类神经递质含量,显著改善小鼠抑郁样行为.进一步研究表明,佐太的主要成分β-HgS可以显著增强抑郁模型小鼠的糖水偏爱率[7]和减少不动时间[6],改善慢性束缚刺激(chronic restraint stress,CRS)造成的好感缺失和学习无助行为,且100倍临床等效剂量时,β-HgS的抗抑郁效果最为显著.因此,为了探寻临床抗抑郁药的辅助治疗药物,本研究选择丙咪嗪和β-HgS联合使用,通过糖水偏爱试验、开场试验、悬尾试验和强迫游泳4个行为学试验,观察海马组织切片,测定大脑皮层单胺神经递质、海马脑源性神经营养因子(BDNF)和下丘脑促肾上腺皮质激素释放激素(CRH)含量,研究二者联用对慢性束缚刺激(CRS)小鼠的抗抑郁作用.
1 材料与方法
1.1 试验动物
昆明种(KM)小鼠40只,SPF级,雄性,体质量(35±2)g,购买于甘肃中医药大学实验动物中心(许可证号SYXK(甘)2015-0005),饲养于SPF级动物房内,恒温恒湿环境(湿度为50%~80%,温度为21~23 ℃)人工光照昼夜循环12 h.
小鼠适应性喂养一周后,按照体质量随机分为5组,每组8只,分别为对照组、模型组、β-HgS组(338 mg/kg)、丙咪嗪组(15 mg/kg)和β-HgS+丙咪嗪(338 mg/kg+15 mg/kg).
1.2 药物与试剂
盐酸丙咪嗪(纯度:98%),购于中国食品药品检验研究院;β-HgS(纯度:98%)购于Alfa Aesar公司;5-羟色胺(5-HT)、去甲肾上腺素(NE)、脑源性神经营养因子(BDNF)、促肾上腺皮质激素释放激素(CRH)酶联免疫(ELISA)检测试剂盒,购于上海江莱生物科技有限公司.
1.3 仪器与设备
束缚管(50 mL离心管,每管3~4个0.2 cm小孔,自制);开放式现场试验系统设备(OFT-100,中国泰盟公司);悬尾试验装置(木架,高75 cm,自制);强迫游泳试验装置(圆柱形玻璃缸,高25 cm、直径10 cm,自制);硬盘摄录机(GZ-MG174AC,日本JVC公司);高速冷冻离心机(Sigma 3K-15,Sigma公司);多功能酶标仪(Enspire2300,Perkin Elmer公司);高通量组织匀浆仪(Scientz-48,宁波新芝生物科技股份有限公司);脱水机(JJ-12J,武汉俊杰电子有限公司);包埋机(JB-P5,武汉俊杰电子有限公司);病理切片机(RM2016,上海徕卡仪器有限公司);病理成像系统(Nikon DS-U3,日本尼康).
1.4 试验方法
1.4.1 动物给药与处理 将丙咪嗪和β-HgS悬浮或溶解在2%淀粉水溶液中.对照组和模型组小鼠每天灌胃给予0.1 mL/kg的2%淀粉混悬液,β-HgS组、丙咪嗪组和β-HgS+丙咪嗪组每天灌胃给予338 mg/kg(剂量参考100倍的佐太成人临床等效剂量)[8]的β-HgS、15 mg/kg(剂量参考成人临床等效剂量)的丙咪嗪[9],灌胃剂量为0.1 mL/kg.除空白组小鼠外,其余各组小鼠在给药的同时给予慢性束缚刺激,具体操作为:将小鼠置于自制束缚管中,每日束缚3 h(9∶00~12∶00)[10-12].给药和慢性束缚刺激持续21 d,每隔一周记录一次动物体质量.行为学试验于应激结束后第1天开始(即第22天),为了避免行为学试验之间互相影响,每组小鼠每天同步进行一个行为学试验.
1.4.2 开场试验(OFT) 第22天进行开场试验,提前60 min将小鼠笼移动到设备房间中适应环境,随后将小鼠置于开场试验装置(长、宽、高分别为500 mm×500 mm×415 mm)中央,通过开场设备上方的摄像机及监视器记录5 min内小鼠的活动情况并计算中央区停留时间百分率(中央区停留时间/300 s)、中央区水平运动百分率(中央区水平运动距离/水平运动距离).试验结束后将小鼠放回笼内,70%乙醇彻底擦拭试验装置并用纸巾擦干[13].
1.4.3 糖水偏爱试验(SPT) 第19~22天进行糖水适应训练,3 d适应训练结束后,禁食、禁水22 h.SPT于第23天19∶00开始,小鼠单笼喂养,同时给予一瓶1%蔗糖水和一瓶超纯水,自由饮食、饮水2 h.2 h后记录每只小鼠的糖水和超纯水消耗量,计算小鼠的糖水偏爱率[14].

1.4.4 悬尾试验(TST) 第24天进行悬尾试验,用医用胶布缠绕在距离小鼠尾巴尖部2~3 cm处,然后将其固定在木板上,摄录6 min内小鼠的行为.所有试验结束后,采用间隔观察法,记录最后4 min视频小鼠被悬挂时的完全不动的时间[15].
1.4.5 强迫游泳试验(FST) 第25天进行强迫游泳试验,将每只小鼠分别置于一个圆柱形玻璃缸中(高25 cm,直径10 cm),在室温23~25 ℃的条件下加入10 cm高的等温度的水,摄录6 min内小鼠的行为.使用双盲定时器记录试验最后4 min内小鼠的不动时间[16].
1.4.6 组织切片染色观察 行为学试验结束后,每组随机抽取2只小鼠断颈取血,在冰板上迅速剥离脑组织,全脑置于4%多聚甲醛溶液中固定24 h,石蜡包埋,矢状面切片(厚5 μm),进行苏木精-伊红染色(HE染色),在显微镜下观察海马组织病理变化.
1.4.7 单胺神经递质、脑源性神经营养因子及促肾上腺皮质激素释放激素含量检测 行为学试验结束后,每组6只小鼠颈椎脱臼处死,在冰板上迅速剥离脑组织,分别取出皮层、海马组织和下丘脑置于1.5 mL离心管中,分别加入20倍、10倍、10倍质量的PBS缓冲液(pH7.0~7.2),使用组织匀浆仪进行组织匀浆(频率60 Hz,转速1 800次/min,2 min),4 ℃条件下,分别5 000 r/min和4 000 r/min离心5 min后,取上清液置于1.5 mL离心管,采用ELISA试剂盒,按说明书方法测定上清液中5-HT、NE、BDNF和CRH的含量.
1.5 统计分析
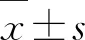
2 结果与分析
2.1 β-HgS与丙咪嗪联用对CRS小鼠体质量的影响
如图1-A所示,0天各组小鼠体质量均无明显差异.与对照组相比,模型组小鼠在慢性束缚刺激第7天、14天和21天时,体质量分别下降了12.02%、11.03%和13.44%.与模型组相比,β-HgS组小鼠第7天时体质量明显下降,14天与21天时体质量逐渐增加,丙咪嗪及β-HgS+丙咪嗪组的小鼠体质量均有增加.其中,β-HgS+丙咪嗪组的小鼠体质量增加最多,在第7天、14天和21天时分别比模型组小鼠体质量增加5.04%、3.03%和7.95%,且在第21天时存在显著性差异(P<0.01).
2.2 β-HgS与丙咪嗪联用对CRS小鼠开场试验中心停留时间和中心运动距离的影响
如图1-B所示,与对照组相比,模型组小鼠的中心停留时间百分比和中心运动距离百分比显著降低(P<0.001、P<0.01).与模型组相比,丙咪嗪组小鼠的中心停留时间百分比显著增加(P<0.05),β-HgS+丙咪嗪组小鼠的中心停留时间百分比和中心运动距离百分比均显著增加(P<0.01、P<0.01),而β-HgS组小鼠的中心停留时间百分比和中心运动距离百分比均无显著性差异.3个给药组中,β-HgS+丙咪嗪组小鼠的中心停留时间百分比和中心运动距离百分比最高,较模型组分别增加了122.41%和112.75%.如图1-C所示,与对照组小鼠相比,模型组小鼠的活动区域趋向于四周,而丙咪嗪组和β-HgS+丙咪嗪组小鼠的活动区域趋向于中心.
2.3 β-HgS与丙咪嗪联用对CRS小鼠糖水偏爱率的影响
如图1-D所示,与对照组比较,模型组小鼠糖水偏爱率显著降低(P<0.05);与模型组比较,β-HgS组、丙咪嗪组和β-HgS+丙咪嗪组小鼠糖水偏爱率均显著增高(P<0.001、P<0.001、P<0.001),其中β-HgS+丙咪嗪组小鼠糖水偏爱率最高,比模型组增高了47.35%.
2.4 β-HgS与丙咪嗪联用对CRS小鼠悬尾试验和强迫游泳试验中不动时间的影响
如图1-E所示,与对照组小鼠相比,模型组小鼠的悬尾试验和强迫游泳试验不动时间显著增加(P<0.001、P<0.05).与模型组相比,3个给药组小鼠的悬尾试验和强迫游泳试验不动时间均显著减少(P<0.01或P<0.001).其中,β-HgS+丙咪嗪组小鼠的悬尾试验和强迫游泳试验不动时间最少,较模型组分别减少了41.67%和57.77%,而且显著少于丙咪嗪组(P<0.05).
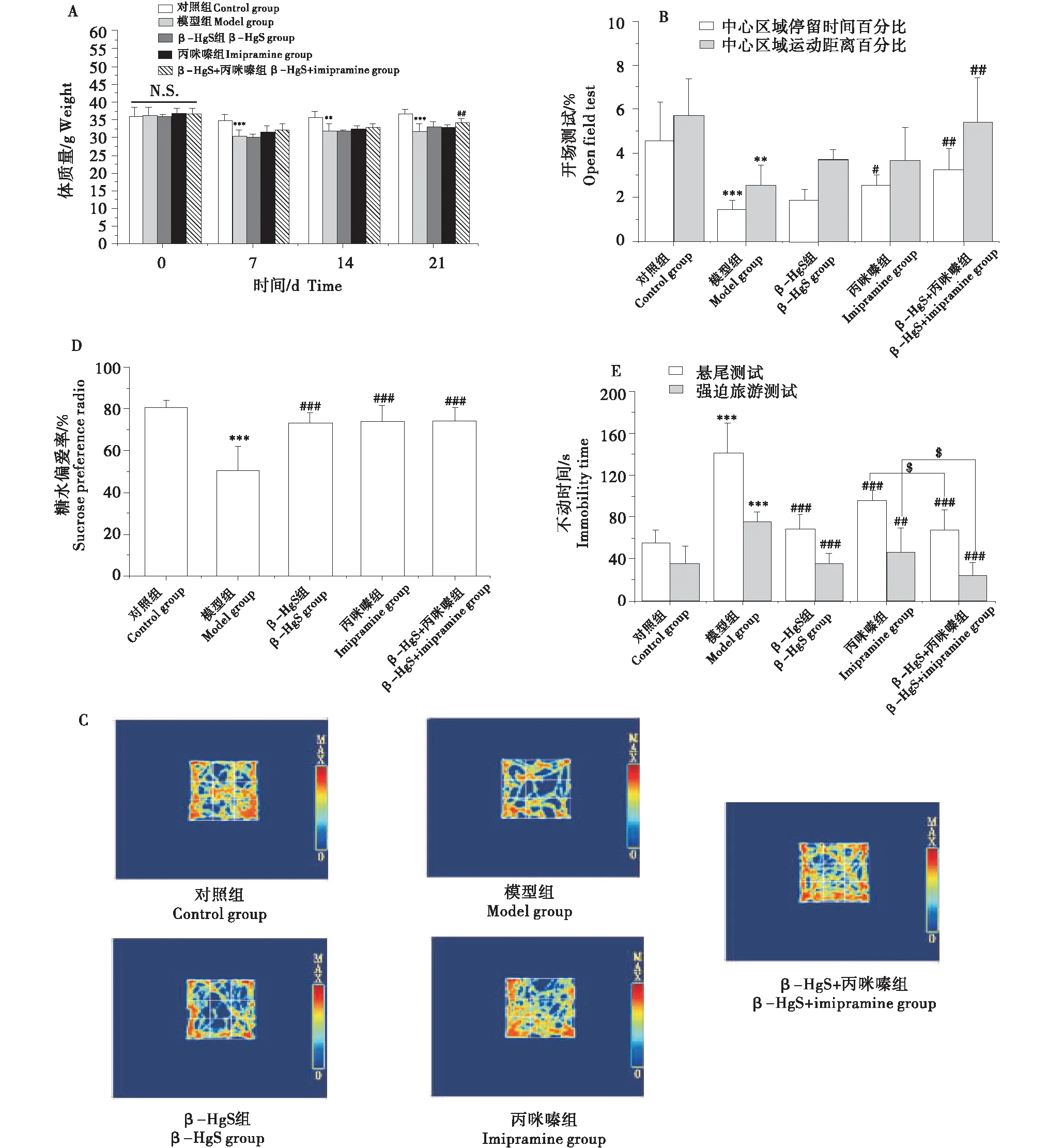
2.5 β-HgS与丙咪嗪联用对CRS小鼠海马组织结构的影响
如图2所示,对照组小鼠海马各亚区轮廓清晰,神经元排列整齐,形态正常,分布均匀.模型组与对照组相比,小鼠海马DG亚区轮廓开始出现模糊,部分神经元破裂浸润、固缩;CA3亚区部分可见神经元固缩、深染,神经元间排列疏松,界限模糊;CA1区无明显变化.与对照组比较,各给药组小鼠海马的CA1和CA3亚区未见明显差异;海马DG亚区部分可见神经元固缩、深染.其中β-HgS组DG区神经元固缩、深染较少.
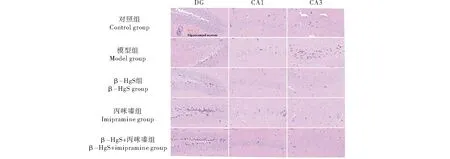
2.6 β-HgS与丙咪嗪联用对CRS小鼠大脑皮层中单胺神经递质含量的影响
如图3-A~6-B所示,慢性束缚应激刺激3周后,模型组小鼠大脑皮层中5-HT和NE含量显著低于对照组(P<0.01、P<0.001).与模型组相比,3个药物治疗组小鼠大脑皮层中5-HT和NE含量均有不同程度增加.其中,丙咪嗪组小鼠大脑皮层的5-HT含量最高,与模型组相比增加了13.73%(P<0.05),但与其他2个给药组无显著差异;β-HgS组小鼠大脑皮层的NE含量最高,与模型组相比增加了33.56%,且β-HgS组和β-HgS+丙咪嗪组小鼠的NE含量显著高于丙咪嗪组(P<0.05).
2.7 β-HgS与丙咪嗪联用对CRS小鼠海马脑源性神经营养因子含量的影响
如图3-C所示,应激刺激3周后,模型组小鼠海马中BDNF含量显著低于对照组(P<0.01).与模型组相比,3个给药组小鼠海马中BDNF含量均不同程度增加.其中,β-HgS组小鼠的BDNF含量最高,与模型组对比增加了10.03%,且β-HgS组和β-HgS+丙咪嗪组小鼠的BDNF含量显著高于丙咪嗪组(P<0.05).
A:体质量;B:开场试验中心区域停留时间和运动距离;C:开场试验运动轨迹;D:糖水偏爱率;E:悬尾试验和强迫游泳试验不动时间.*表示与对照组比较差异显著(** P<0.01、*** P<0.001);#表示与模型组比较差异显著(#P<0.05、##P<0.01、###P<0.001);$表示与丙咪嗪组比较差异显著($P<0.05).A: Weight;B: The percentages of central residence time and center movement distance in the open-field test (OFT);C:Motion trajectory map of each group of mice in the OFT;D:Sucrose preference ratio;E:Immobility time in the tail suspension test (TST) and forced swimming test (FST) of mice.Compared with the control group.* means significant difference (** P<0.01,*** P<0.001);Compared with the model group,# means significant difference (#P<0.05,##P<0.01,###P<0.001);compared with the IMI group,$ means significant difference ($P<0.05).图1 各处理对慢性束缚刺激小鼠的体质量和抑郁行为的影响Figure 1 Effects of different treatments on weight and depression behaviors of chronic restraint stress (CRS) stimulated mice
HE染色、放大倍数400倍.HE staining,magnification:400.图2 各处理对慢性束缚刺激小鼠的海马关键亚区结构的影响Figure 2 Effects of different treatments on structure of key hippocampal subregions of chronic restraint stress (CRS) stimulated mice
2.8 β-HgS与丙咪嗪联用对CRS小鼠海马促肾上腺皮质激素释放激素含量的影响
如图3-D所示,应激刺激3周后,模型组小鼠海马中CRH含量显著高于对照组(P<0.01).与模型组相比,β-HgS组小鼠海马中CRH含量升高,但无显著差异;丙咪嗪组和β-HgS+丙咪嗪组显著减少(P<0.001、P<0.001),但二者之间无显著差异.
3 讨论
随着社会的发展和生活节奏的加快,人们通常处于一种长期固定的压力刺激中,对于压力刺激,应激反应能够调动机体,重建机体的稳态[17].体质量变化是抑郁症发生、发展的一个重要特征,特别是与重度抑郁症(MDD)密切相关[18].本研究发现,在慢性束缚刺激过程中模型组小鼠体质量显著下降,然而第21天时β-HgS+丙咪嗪组小鼠体质量显著高于模型组.进一步研究发现,与模型组相比,β-HgS+丙咪嗪组小鼠的OFT中心运动距离和中心停留时间百分比显著减少,糖水偏爱率、FST和TST不动时间显著增加,表明β-HgS与丙咪嗪联用能够显著提高CRS小鼠的自主活动能力[19],显著改善其快感缺乏[20]和绝望状态[21],显示出良好的抗抑郁作用.与丙咪嗪组相比,β-HgS+丙咪嗪组小鼠的体质量更高,自主活动能力更强,绝望状态改善更明显,表明β-HgS对丙咪嗪缓解小鼠抑郁具有增效作用.
小鼠海马组织病理观察结果,进一步说明了β-HgS对丙咪嗪缓解小鼠抑郁具有增效作用.抑郁症会导致大脑组织实质性损害,与情绪、记忆密切相关的大脑组织,尤其是海马最易受到损害[22].抑郁症患者的海马结构存在萎缩,且海马萎缩程度与抑郁症病情正相关[23].小鼠海马组织病理切片分析结果表明,与对照组相比,模型组小鼠海马DG区和CA3区均有明显损伤.与模型组相比,各给药组小鼠海马DG区与CA3区结构损伤程度显著减轻,其中DG区结构:各给药组与对照组均无明显差别;CA3区结构:β-HgS组和β-HgS+丙咪嗪组的损伤程度均明显小于丙咪嗪组,推测β-HgS可以增强丙咪嗪对CRS小鼠海马DG区结构损伤的保护作用.
随着对抑郁症研究的不断深入,学者们提出了一系列关于抑郁症发病机制的假说,包括单胺类神经递质假说[24]、神经营养缺乏假说[25]、下丘脑-垂体-肾上腺皮质轴(HPA轴)功能障碍假说[26]等.其中,单胺类神经递质是一类与人的精神情感活动密切相关的神经递质,如5-HT不足可引起抑郁症及其相关症状,包括自杀、强迫、慢性疼痛和睡眠障碍等;NE水平低下,可引发嗜睡、精神运动性阻滞、认知障碍和快感缺失等抑郁症相关症状[4,27].BDNF能够影响突触结构的重塑,对维持神经元正常的生理功能起关键的作用,神经营养缺乏假说主要基于BDNF的3个现象:海马BDNF信号受损会诱发抑郁样行为;提高海马BDNF的蛋白水平会产生抗抑郁效果;BDNF作为神经递质调制器,在神经元生长和存活扮演主要角色,并导致神经可塑性[28].人类尸检显示,抑郁病人海马BDNF 表达水平显著降低[29].HPA轴控制着机体对应激的反应并调控体内多种生理过程,近年来的研究显示抑郁症与HPA轴功能失调之间存在一定的关系,主要表现为HPA轴功能的亢进,包括中枢CRH分泌增多,外周血ACTH和皮质酮CORT水平升高等[30].
A:5-羟色胺(5-HT);B:去甲肾上腺素(NE);C:脑源性神经营养因子(BDNF);D:促肾上腺皮质激素释放激素(CRH).*表示与对照组比较差异显著(**P<0.01、*** P<0.001);#表示与模型组比较差异显著(#P<0.05、##P<0.01、###P<0.001);$表示与丙咪嗪组比较差异显著($P<0.05).A:5-HT;B:NE;C:BDNF;D:CRH.Compared with the control group,* means significant difference (** P<0.01,*** P<0.001);compared with the model group,# means significant difference (#P<0.05,##P<0.01,###P<0.001);compared with the IMI group,$ means significant difference ($P<0.05).图3 各处理对慢性束缚刺激小鼠的大脑皮层单胺神经递质、海马脑源性神经营养因子和促肾上腺皮质激素释放激素含量的影响Figure 3 Effects of different treatments on monoamine neurotransmitter content in cortex,BDNF and CRH content in hippocampus of chronic restraint stress (CRS) stimulated mice
本研究结果显示,21 d的慢性束缚刺激显著降低小鼠大脑皮层5-HT、NE和海马BDNF含量,显著增加海马CRH含量,而β-HgS与丙咪嗪联用能够显著提高CRS小鼠大脑皮层5-HT、NE和海马BDNF含量,降低海马CRH含量(P<0.05或P<0.001).特别是,与丙咪嗪组相比,β-HgS+丙咪嗪组小鼠大脑皮层NE含量和海马BDNF含量更高(P<0.05).推测,β-HgS对丙咪嗪缓解小鼠抑郁的增效作用可能是通过单胺类神经递质和神经营养因子途径来实现的.
综上所述,β-HgS对丙咪嗪缓解小鼠抑郁具有增效作用,β-HgS能够增强丙咪嗪对CRS小鼠自主活动能力和绝望状态的改善作用,以及海马DG区结构损伤的保护作用.此外,其增效作用可能是通过提高CRS小鼠大脑NE和BDNE含量,即通过单胺类神经递质和神经营养因子途径来实现的.

