子宫自然杀伤/T细胞淋巴瘤合并噬血细胞综合征一例并文献复习
田笛,彭昊,韩丽英,徐慧
女性生殖系统原发性淋巴瘤(primary female genitalsystemlymphoma,PFGSL)是一种罕见的结外淋巴瘤,发生率仅占结外淋巴瘤的0.2%~1.1%,且大多数为侵袭性B细胞淋巴瘤,自然杀伤/T细胞淋巴瘤(natural killer/T-cell lymphoma,NKTCL)极为罕见[1]。子宫NKTCL侵袭性较高,早期诊断困难,误诊率高,预后难以预测[2]。噬血细胞综合征(hemophagocytic syndrome,HPS)又称噬血细胞性淋巴细胞增多症,是一种免疫介导的致死性高炎症反应性疾病,其特征为巨噬细胞的全面激活,广泛吞噬造血细胞[3]。HPS根据病因可分为原发性HPS和继发性HPS,其中继发性HPS可继发于炎性疾病、感染、恶性肿瘤等。淋巴瘤相关HPS约占继发性HPS的40%~50%,最常见于结外NKTCL[3-4]。现对1例子宫NKTCL合并HPS患者的病例资料进行回顾,并总结其临床和病理特征。
1 病例报告
患者 女,34岁,因不规则阴道出血2个月余,间断发热8 d,于2020年3月2日入院。患者近2个月无明显诱因出现阴道不规则出血,量较多,偶有下腹痛,半个月前于外院行诊刮术,术后病理回报:分泌样子宫内膜,部分圆形细胞(间质样细胞)密集增生,有一定异型性。刮宫后症状无明显缓解,于外院行盆腔磁共振成像(MRI)示:子宫肿块,考虑恶性肿瘤可能,肌层明显受累,盆腔及双侧腹股沟淋巴结增多,部分肿大。肺部计算机断层扫描(CT)未见明显异常。血常规检查示:白细胞计数(WBC)2.03×109/L,血红蛋白(Hb)73 g/L,肝酶轻度升高。治疗效果不佳,并出现寒战高热,遂转入我院。既往史:剖宫产2次,余个人史及家族史无特殊。查体:体温39.3℃,全身浅表淋巴结未触及肿大及压痛,脾大平脐上四横指。妇科检查:阴道内可见积血,无异味,子宫增大如妊娠3个月余,质软,压痛(±),双附件区未触及明显异常。妇科彩色超声检查示:子宫内实质占位性病变,为大小7.1cm×4.6cm×4.8cm的稍低回声,边界较清,内回声不均匀。腹部彩色超声检查示:脾大(厚5.5 cm,纵径19.1 cm)。血常规检查示:WBC 2.47×109/L,Hb 80 g/L。凝血功能大致正常。肝肾功能检查示:肝酶、胆红素及血清尿酸升高。肿瘤标志物检查示:甲胎蛋白(AFP)、癌胚抗原(CEA)、人绒毛膜促性腺激素β亚单位(βhCG)、CA125、CA19-9、CA153 无异常。抗核抗体谱均阴性。乙肝五项及术前四项(甲肝、丙肝、艾滋、梅毒)阴性。患者入院后反复高热,血培养及抗酸染色(痰)未见异常,复查肺部CT未见异常。因阴道出血病程较长,止血效果欠佳,遂开腹探查,术中见淡红色腹水约50 mL,留取送检。脾大(轻度),肝胆、大网膜、腹膜、肠管及阑尾表面光滑;子宫增大,质软,表面充血,子宫前壁与膀胱及腹膜致密粘连,子宫后壁光滑,双侧附件未见明显异常。行盆腔粘连松解、全子宫及双侧输卵管切除术,剖视子宫可见:子宫增大,前后肌壁肥厚,肌层结构完全消失,呈灰白色病变,宫腔宽大,未见正常子宫内膜,宫腔内壁呈脑回样改变,见图1(见封三)。术中送快速病理检查示:子宫黏膜小圆形细胞肿瘤,淋巴瘤待排除,涂片查见中-重度异型细胞。术中诊断:子宫肿瘤(淋巴瘤可能)。与患者家属沟通后,其要求不扩大手术范围,术毕,术中出血约400 mL。术后病理回报:子宫非霍奇金淋巴瘤(符合结外NKTCL),弥漫浸润内膜及肌壁,宫旁未见瘤组织;双侧输卵管轻度充血;腹腔冲洗液未见恶性瘤细胞,见图2和3(见封三)。免疫组织化学检查示:LCA(+),ACT(-),Des(-),CD34(-),CK(-),CD20(-),CD3(+),CD30(-),ALK(-),EMA(-),Bcl-2(+),Bcl-6(-),CD10(-),CyclinD1(-),GrB(+),CD56(+),CD43(-),CD45RO(+),TDT(-),CD21(-),CD5(-),PAX5(-),CD15(-),CD4(-),CD8(-),Ki-67 阳性细胞数60%,EBER CISH(+)。

图1 子宫大体标本
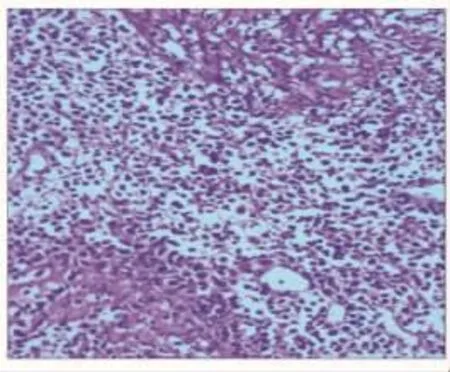
图2 HE染色镜检结果(×200)
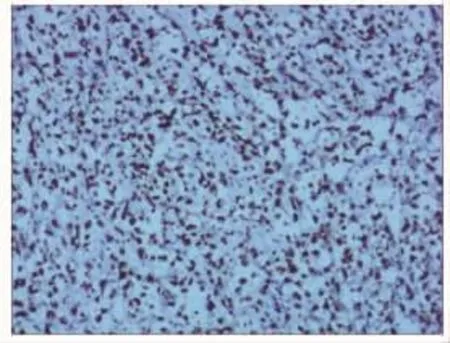
图3 EBER显色原位杂交结果(×200)
患者术后持续发热1周以上,日最高体温均超过38.5℃,并于术后1周出现全身皮肤散在皮疹。复查血常规三系进行性下降,凝血功能示血浆纤维蛋白原小于1.21 g/L,血清铁蛋白>865.6 μg/L,三酰甘油>3.65 mmol/L,肝功能检查示转氨酶及胆红素进行性增高,乳酸脱氢酶(LDH)显著升高,骨髓活检见噬血细胞,诊断:子宫NKTCL合并HPS。给予抗炎、升血小板、升白细胞、输血等对症治疗,因患者一般状态差,未立即给予化疗。病情无明显好转,患者要求转当地医院治疗,出院2周后死亡。
2 讨论
2.1 流行病学 NKTCL是少见的非霍奇金淋巴瘤亚型,主要是结外型,其发生与EB病毒(EBV)的感染有关[5]。在东亚及中南美洲的发病率明显高于世界其他地区[6],大多数NKTCL来源于NK细胞,通常发生在鼻腔和上呼吸道[7]。有研究显示,PFGSL最常见的部位是卵巢(37%,中位年龄48岁),其次是宫颈(21.4%,中位年龄49岁)、子宫(16.5%,中位年龄67岁)、阴道(11.8%,中位年龄57岁)和外阴(8.8%,中位年龄69岁)[8],另也有关于输卵管相关病例的报道[9]。子宫NKTCL的发生率约占子宫恶性肿瘤的0.05%[10],因其临床极为罕见,其流行病学相关信息多来自于个案和小样本文献报道,且与生殖系统的其他恶性肿瘤难以鉴别,误诊率高。
HPS是一种罕见的危及生命的疾病,在欧洲国家年发病率约为1/80万,可发生在各个年龄段,成人较多见,成人HPS中男女患病比例约为1∶7,平均发病年龄接近50岁[11],常累及多器官、多系统且进行性加重,伴免疫功能紊乱,其发病机制尚不明确,有研究显示可能与1型辅助性T细胞(Th1)反应引起的细胞因子风暴和严重炎症相关[12]。HPS主要分为原发性和继发性,遗传突变是儿童原发性HPS最常见的病因,成人通常因感染、自身免疫性疾病或恶性肿瘤而发生继发性HPS,其中病毒感染是最常见的诱因,在亚洲国家以EBV为主[11]。在恶性肿瘤引起的继发性HPS中,淋巴瘤相关噬血细胞综合征最为常见,且预后最差,常累及外周T细胞或NK细胞系[13]。HPS也可以由疫苗接种、手术(脾切除术、心脏手术、结肠切除术、肝切除术和产后)、严重烧伤和药物(包括生物制剂)等诱发。目前继发于淋巴瘤的HPS的发病机制尚不明确,有研究发现可能与Toll途径进化保守信号介导因子(evolutionarily conserved signaling intermediate in Toll pathways,ECSIT)基因V140A突变引起细胞因子风暴有关[4]。
2.2 临床表现及诊断 子宫NKTCL临床症状可表现为发热、腹痛、腹胀、盆腔包块或阴道出血,彩色超声、CT、MRI等影像学检查可提示病变累及范围,但由于其临床和影像学表现缺乏特异性,因此几乎所有患者都是通过手术或活检后行病理检查确诊。有研究认为相比于手术,穿刺活检更适合用于诊断,因为手术有大出血等一系列不确定风险,而穿刺活检能显著降低这些风险且更便捷[14],但穿刺获得的组织可能包含较多坏死区域,增加诊断难度,易造成漏诊、误诊,且穿刺路径是否增加肿瘤种植、转移风险仍需进一步研究,故对此仍存争议。目前子宫NKTCL的确诊主要依赖于组织学形态特征和免疫组织化学、分子检测等病理辅助检查,其主要病理特征为肿瘤细胞常以血管为中心的浸润性生长、破坏血管壁,伴有凝固性坏死和黏膜溃疡形成。免疫表型多以CD56阳性,且表达细胞毒性分子粒酶B、穿孔素或TIA-1,同时EBV阳性[15]。
HPS以持续发热、肝脾肿大、全血细胞减少以及骨髓、肝、脾、淋巴结组织发现噬血现象为主要临床表现,也可出现神经系统症状及皮疹等[13]。其诊断依据国际组织细胞学会于1991年提出2004年更新的HPS诊断指南,但应注意的是,该标准主要应用于儿童原发性HPS,并不能完全适用于继发性HPS[16]。目前没有任何一个特异性指标可以快速诊断HPS,在临床工作中,对于不明原因的持续高热和多器官受累为表现的患者应高度怀疑HPS。
2.3 治疗和预后 现阶段子宫NKTCL暂无标准化的治疗方案,临床以手术、化疗、放疗以及生物治疗等单个或多个治疗相结合的方式,治疗方式取决于患者的年龄、是否有生育要求、临床分期及病理类型。文献报道的大多数患者均接受了手术治疗,手术目的多为明确病理诊断或减轻肿瘤负荷,目前关于子宫NKTCL的手术范围尚无共识。对于子宫NKTCL的患者,多采用手术后化疗的治疗方式,NKTCL对传统的环磷酰胺+阿霉素+长春新碱+强的松(CHOP)方案不敏感,且存在多药耐药。随着相关研究证据和临床经验的不断积累,现培门冬酶+吉西他滨+奥沙利铂(P-GEMOX)方案被列为治疗结外NKTCL的一线方案,并列入美国国家综合癌症网络(NCCN)指南,其临床疗效、安全性较为可观,化疗疗程一般在4~6个周期为宜,完全缓解后宜再行2~3个疗程巩固疗效[17]。但其治疗效果存在个体差异,该方案的治疗效果有待进一步研究验证。
子宫NKTCL预后差,据相关个案报道,1例41岁的患者在行子宫切除术后54 d(0.15年)死亡[18],另1例在经穿刺活检确诊后,接受了6个周期的依托泊苷+环磷酰胺+阿霉素+长春新碱+强的松(ECHOP)方案化疗后死于疾病进展和淋巴瘤相关的HPS[19]。
HPS临床表现及相关辅助检查结果缺乏特异性,病因复杂,临床罕见,易误诊误治。2014年发表在《柳叶刀》杂志上的一项研究指出,在成人HPS的治疗上主要有3个重点:①根据具体情况应给予相应的对症支持治疗(重症监护、纠正全血细胞低、抗感染治疗等);②消除诱发HPS的诱因;③用免疫调节剂(如糖皮质激素药物、环孢素)和(或)细胞毒药物(依托泊苷)抑制炎症反应及肿瘤细胞增殖,以及生物治疗(利妥昔单抗、英夫利昔单抗、依那西普)等。在EBV感染相关的淋巴瘤相关HPS患者中,利妥昔单抗被认为可能是一种补救治疗选择,但对于潜在病因不明的HPS,不推荐单独应用生物抑制剂治疗[11]。此外,静脉注射免疫球蛋白也被证实对于不同原因引起的成人HPS治疗效果良好。继发于恶性肿瘤的HPS,特别是淋巴瘤相关的HPS预后尤为不良,有研究显示年龄>30岁、高血清铁蛋白、血小板重度减少、未接受依托泊苷治疗及低白蛋白血症也是HPS预后不良的危险因素[20]。
综上,子宫NKTCL合并HPS临床极为罕见,临床表现缺乏特异性,病情凶险,易误诊误治。对该类疾病应早期识别及诊治,以期改善预后。

