分泌性中耳炎患者手术前后血清和中耳积液中β2⁃M、S⁃IgA及炎性因子水平变化
王 玲,罗 伟,文 科,黄朝平
分泌性中耳炎(secretory otitis media, SOM)为耳鼻喉科常见病、多发病,表现为听力下降、鼓室积液,且近年发病率呈逐渐上升趋势[1]。 临床常采用鼓膜切开、鼓室穿刺抽液等多种手术方式或糖皮质激素等药物治疗[2⁃3],准确评估其治疗效果具有重要意义。 目前关于SOM 的发病机制尚未明确,作为典型炎性疾病,血清炎性因子[肿瘤坏死因子⁃α(TNF⁃α)、白细胞介素⁃6(IL⁃6)、白细胞介素⁃10(IL⁃10)]水平变化对疾病诊断具有重要参考价值[4]。 β2⁃微球蛋白(β2⁃M)、分泌型免疫球蛋白A(S⁃IgA)亦是反映免疫水平的指标,其中β2⁃M 作为一种小分子蛋白质,主要由免疫细胞产生[5⁃6],而免疫球蛋白A(IgA)为血清含量仅次于免疫球蛋白G(IgG)的免疫球蛋白类型,可分为血清型与分泌型[7]。 现文献关于SOM 患者手术前后β2⁃M、S⁃IgA变化研究较少。 因此,本文分析SOM 患者手术前后血清与中耳积液中β2⁃M、S⁃IgA 及炎性因子水平变化,现报告如下。
1 资料与方法
1.1一般资料 选取2017 年5 月—2019 年5 月我院收治的符合纳入及排除标准的88 例SOM 作为观察组,其中男47 例,女41 例;年龄23 ~54(38.45±3.96)岁;病程1~10(5.78±0.62)个月;阻塞后鼻孔程度51~75(63.13±6.45)%;体质量指数15 ~30(22.35±2.47)kg/m2。 纳入标准:①接受耳显微镜或内镜等检查,且符合SOM 诊断标准[8];②均行手术治疗;③患者听力下降或反复间断性耳痛、耳堵塞感,鼓膜内陷活动度下降,呈黄色或琥珀色,可见液平面或积液征;④声导抗测试鼓室导抗图为B 型,有传导性听力损失20 ~50 dB;⑤患者和(或)其家属对本研究知情同意,且签署知情同意书。 排除标准:①合并腺样体残留、鼻咽癌、慢性肥厚性鼻炎等五官占位性病变;②其他病变所致的中耳积液或鼓室积液;③合并严重心、肝、肾功能障碍或原发性高血压病等循环系统疾病;④合并糖尿病等内分泌系统、免疫系统、精神系统疾病;⑤近期未口服影响免疫抗体药物。 选择同期在我院体检的健康者60 例作为对照组,其中男32 例,女28 例;年龄25 ~52(38.52±3.89)岁。 两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。 本研究经医院医学伦理委员会批准执行。
1.2治疗方法 观察组行鼓膜切开置管术,于耳内镜下操作,先进行外耳道常规消毒,在骨膜前下象限穿刺抽取积液,常规予以地塞米松及α 糜蛋白酶冲洗鼓室,后进行置管操作。
1.3观察指标 比较观察组术前血清和中耳积液与对照组体检时血清β2⁃M、S⁃IgA 及 炎性 因 子(TNF⁃α、IL⁃6、IL⁃10)水平以及SOM 患者术前及术后3 d 血清和中耳积液β2⁃M、S⁃IgA 及炎性因子水平,分析SOM 患者血清和中耳积液β2⁃M、S⁃IgA 与中耳积液炎性因子的相关性。
采集观察组术前、术后3 d 中耳积液,即常规消毒外耳道,鼓膜表面麻醉后行鼓膜前下象限穿刺抽取积液0.1 ml,放于浸入冰水中的含50 μl 抑肽酶的塑料管中备用。 此外,观察组于术前和术后3 d、对照组于体检时采集空腹静脉血3 ml,以3000 r/min的速度离心10 min,取上清液保存于-80℃冰箱中备用。 采用放射免疫法测定β2⁃M 水平,试剂盒购自北京华清生化技术研究所,严格按照试剂盒说明书进行;采用美国库尔特-贝克曼公司提供的AU5800 型全自动生化分析仪测定S⁃IgA 水平;采用酶联免疫吸附试验法测定血清TNF⁃α、IL⁃6、IL⁃10水平,试剂盒购自上海恒远生物科技有限公司。
1.4统计学方法 采用SPSS 20.0 统计学软件处理数据,计量资料多组间比较采用单因素方差分析,两两比较采用Dunnet⁃t检验或配对样本t检验,以均数±标准差(±s)表示;采用Pearson 相关性分析观察SOM 患者血清和中耳积液β2⁃M、S⁃IgA 与中耳积液炎性因子的相关性,以α =0.05 为检验水准。
2 结果
2.1β2⁃M、S⁃IgA 水平比较 与对照组血清比较,观察组术前血清和中耳积液β2⁃M、S⁃IgA 水平升高,差异有统计学意义(P<0.05 或P<0.01),见表1。
表1 分泌性中耳炎患者术前血清和中耳积液及健康体检者体检时血清β2⁃M、S⁃IgA 水平比较(±s)

表1 分泌性中耳炎患者术前血清和中耳积液及健康体检者体检时血清β2⁃M、S⁃IgA 水平比较(±s)
注:观察组为分泌性中耳炎患者,对照组为健康体检者;β2⁃M 指β2⁃微球蛋白,S⁃IgA 指分泌型免疫球蛋白A;与对照组血清比较,aP<0.05,bP<0.01
组别 例数 β2⁃M(μg/ml) S⁃IgA(g/L)观察组 88 血清 2.34±0.26a 2.53±0.26b 中耳积液 7.01±0.74b 4.96±0.52b对照组血清 60 2.25±0.22 2.26±0.28 F 50.631 35.629 P<0.001 <0.001
SOM 患者术前和术后3 d 血清β2⁃M、S⁃IgA 水平均低于中耳积液水平,差异有统计学意义(P<0.01);与术前比较,SOM 患者术后3 d 血清和中耳积液β2⁃M、S⁃IgA 水平下降,差异有统计学意义(P<0.01)。 见表2。
表2 SOM 88 例手术前后β2⁃M、S⁃IgA 水平比较(±s)

表2 SOM 88 例手术前后β2⁃M、S⁃IgA 水平比较(±s)
注:SOM 指分泌性中耳炎,β2⁃M 指β2⁃微球蛋白,S⁃IgA 指分泌型免疫球蛋白A;与术前同一样本比较,bP<0.01
样本类型 β2⁃M(μg/ml)术前 术后3 d S⁃IgA(g/L)术前 术后3 d血清 2.34±0.26 1.98±0.24b 2.53±0.26 2.16±0.24b中耳积液 7.01±0.74 5.43±0.56b 4.96±0.52 3.41±0.35b t 55.853 53.120 39.209 27.631 P<0.001 <0.001 <0.001 <0.001
2.2炎性因子水平比较 与对照组血清比较,观察组术前血清和中耳积液TNF⁃α、IL⁃6、IL⁃10 升高,差异有统计学意义(P<0.01)。 见表3。
表3 分泌性中耳炎患者术前血清和中耳积液及健康体检者体检时血清炎性因子水平比较(±s)
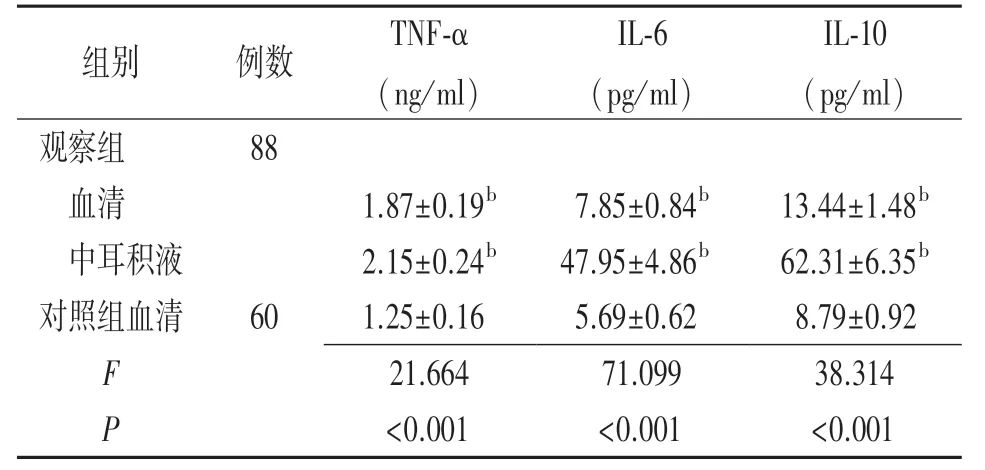
表3 分泌性中耳炎患者术前血清和中耳积液及健康体检者体检时血清炎性因子水平比较(±s)
注:观察组为分泌性中耳炎患者,对照组为健康体检者;TNF⁃α 指肿瘤坏死因子⁃α,IL⁃6 指白细胞介素⁃6,IL⁃10 指白细胞介素⁃10;与对照组血清比较,bP<0.01
组别 例数 TNF⁃α(ng/ml)IL⁃6(pg/ml)IL⁃10(pg/ml)观察组 88 血清 1.87±0.19b 7.85±0.84b 13.44±1.48b 中耳积液 2.15±0.24b 47.95±4.86b 62.31±6.35b对照组血清 60 1.25±0.16 5.69±0.62 8.79±0.92 F 21.664 71.099 38.314 P<0.001 <0.001 <0.001
SOM 患者观察组术前和术后3 d 血清TNF⁃α、IL⁃6、IL⁃10 水平均低于中耳积液水平,差异有统计学意义(P<0.01);与术前比较,SOM 患者术后3 d血清和中耳积液TNF⁃α、IL⁃6、IL⁃10 水平下降,差异有统计学意义(P<0.01)。 见表4。
表4 SOM 88 例手术前后炎性因子水平比较(±s)
注:SOM 指分泌性中耳炎,TNF⁃α 指肿瘤坏死因子⁃α,IL⁃6 指白细胞介素⁃6,IL⁃10 指白细胞介素⁃10;与术前同一样本比较,bP<0.01
样本类型 TNF⁃α(ng/ml)术前 术后3 d IL⁃6(pg/ml)术前 术后3 d IL⁃10(pg/ml)术前 术后3 d血清 1.87±0.19 1.65±0.18b 7.85±0.84 6.54±0.78b 13.44±1.48 9.42±0.99b中耳积液 2.15±0.24 1.86±0.19b 47.95±4.86 23.48±2.49b 62.31±6.35 43.12±4.43b t 8.851 7.527 76.271 60.902 70.311 69.644 P<0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2.3SOM 患者血清和中耳积液β2⁃M、S⁃IgA 与中耳积液炎性因子相关性分析 Pearson 相关性分析显示,SOM 患 者血 清β2⁃M、S⁃IgA 与 中耳 积 液TNF⁃α、IL⁃6 呈正相关,中耳积液β2⁃M、S⁃IgA 与中耳积液TNF⁃α、IL⁃6 也呈正相关(P<0.05 或P<0.01),见表5、表6、图1、图2。

表5 SOM 患者血清β2⁃M、S⁃IgA与中耳积液炎性因子相关性分析

表6 SOM 患者中耳积液β2⁃M、S⁃IgA与中耳积液炎性因子相关性分析
3 讨论
SOM 为临床常见的中耳非化脓性炎性疾病[9],患者咽鼓管黏膜肿胀闭塞导致中耳呈负压状态,黏膜血管于负压影响下发生充血、扩张,最终导致鼓室积液,若未及时治疗,可能导致鼓室粘连、听骨链坏死等情况,同时造成不同程度的传音性耳聋,严重影响患者生活质量,因而及早诊治具有重要意义[10⁃11]。 关于SOM 的发病机制目前尚未明确,多认为免疫功能低下、炎性因子水平变化是SOM 主要发病机制。 β2⁃M 在循环系统中不易与血浆蛋白形成复合物,且不受患者年龄、肾功能状态等影响,其水平变化可较好反映肾小球滤过功能,与肾小球肾炎等早期肾损伤关系密切[12]。 有研究发现,中枢神经系统发生感染时,组织器官会出现免疫应激细胞变性、坏死等症状,继而产生过量的β2⁃M[13]。 SOM 属于中枢性疾病,考虑β2⁃M 也会发生一定变化。S⁃IgA是由J 链连接形成的多聚体IgA 与分泌片段结合后形成的复合物,为黏膜免疫的主要抗体,可有效阻断病原体对深层组织的感染与入侵[14],故考虑S⁃IgA 在SOM 患者黏膜损伤中也有一定作用,但目前关于β2⁃M、S⁃IgA 在SOM 患者手术前后的变化研究较少。
本研究显示,观察组术前血清与中耳积液β2⁃M水平均明显高于对照组血清,且SOM 患者术前血清β2⁃M 水平低于中耳积液水平,表明SOM 患者体内β2⁃M 呈升高趋势,尤其是中耳积液β2⁃M 升高较明显,与汪晓雷等[15]研究结果相似。 中耳积液β2⁃M升高更明显可能是因为β2⁃M 主要为源自中耳黏膜的局部免疫应答物质,是由Ⅲ型变态反应引起中耳黏膜损伤导致毛细血管通透性增加而渗出所致[16]。免疫球蛋白为机体体液免疫功能的重要组成部分,由浆细胞分泌,是存在抗体活性与免疫调节作用的蛋白质,其中IgA 由鼻、肺等部位的黏膜分泌,属于防御病原体的第一道防线[17]。 张国龙和陶跃进[18]报道急性SOM 患者外周血T 淋巴细胞亚群及免疫球蛋白均有一定变化,其中IgA 经治疗后水平明显下降。 本文观察组术前血清与中耳积液S⁃IgA 水平均明显高于对照组,且SOM 患者术前血清S⁃IgA 水平低于中耳积液水平,表明SOM 患者血清或中耳积液S⁃IgA 水平呈升高趋势,尤其是中耳积液S⁃IgA 升高更明显,可能是因为S⁃IgA 为黏膜表面分泌最多的抗体,可在细胞内中和病原微生物,穿透上皮细胞而有效清除黏膜部位的免疫复合物、上皮细胞内抗原[19]。 若SOM 患者鼓室黏膜发生肿胀和闭塞[20],可检测到患者中耳积液较高水平的S⁃IgA。 本研究显示,SOM 患者术后3 d 血清与中耳积液β2⁃M、S⁃IgA水平低于术前,且血清与中耳积液同一时间β2⁃M、S⁃IgA 水平比较差异也有统计学意义,证实β2⁃M、S⁃IgA 对评估SOM 患者手术治疗效果也有一定价值。
SOM 患者在受到病原体感染、创伤等因素影响后,体内存在一定的炎性反应,而TNF⁃α 为淋巴细胞、单核巨噬细胞合成与分泌的炎性因子,可刺激内毒素而诱导炎性因子如IL⁃6、IL⁃10 等生成,加重炎症反应[21⁃22]。 本研究发现,观察组术前血清与中耳积液TNF⁃α、IL⁃6、IL⁃10 水平均较对照组升高,与更藏达杰和毛海明[23]报道的SOM 患者体内炎性因子及细胞或体液免疫状态均表现异常的结果一致。 本研究对比了SOM 患者手术前后炎性因子水平变化,发现SOM 患者术后3 d 血清与中耳积液TNF⁃α、IL⁃6、IL⁃10 较术前下降,且术前和术后3 d 血清与中耳积液TNF⁃α、IL⁃6、IL⁃10 水平比较差异均有统计学意义,表明监测炎性因子水平对评估SOM 治疗效果有积极意义。 马翔宇[24]研究证实,SOM 患者手术前后TNF⁃α、IL⁃6、IL⁃10 发生明显变化。
本研究Pearson 相关性分析显示,SOM 患者血清β2⁃M、S⁃IgA 与中耳积液TNF⁃α、IL⁃6 呈正相关,中耳积液β2⁃M、S⁃IgA 与中耳积液TNF⁃α、IL⁃6 也呈正相关,表明SOM 患者中耳黏膜损伤也可能与炎症反应水平有关,在治疗时可从减轻患者中耳黏膜损伤入手以提高整体治疗效果。
综上所述,SOM 患者手术前后血清及中耳积液β2⁃M、S⁃IgA 与炎性因子(TNF⁃α、IL⁃6、IL⁃10)发生一定变化,监测其水平变化有利于评估治疗效果。

