邻近标记方法表征细胞-细胞相互作用
马维绎,刘士博,陈 鹏
(1.北京大学元培学院;2.化学与分子工程学院,北京100871)
机体的稳态维持、免疫应答和发育等多种生理过程都离不开被精准调控的细胞-细胞相互作用,对于该相互作用的表征能够帮助揭示生物学原理[1,2],指导临床疗法的研发[3,4].以肿瘤免疫为例,从系统整体层面理解机体内各类型免疫细胞和非免疫细胞彼此复杂的细胞通讯和调控,并由此寻找新一代癌症药物靶点和新疗法备受关注[5].基于对T细胞与癌细胞相互作用的认识,已发展出鉴定T细胞受体与其特异识别的多肽-主要组织相容性复合体的方法[6,7],该方法有望帮助患者鉴定出个性化的肿瘤响应的T细胞亚群.基于巨噬细胞与肿瘤微环境中其它组分的相互作用,已制备出可以局部诱导、增强抗肿瘤免疫的嵌合抗原受体巨噬细胞(CAR-M)[8,9].
对于细胞-细胞相互作用,多样化的表征方法亟待开发.对于同一个生物问题可以在不同层面考察,从基本的分子特征,其构成的细胞生理活性,至细胞三维组装为组织或微环境,再至机体的全局调控和疾病发生.相应地,细胞-细胞相互作用的解析可以依据单个细胞转录组的高通量测序由算法来推断[10,11],也可以进一步比较翻译出的蛋白,由膜蛋白间相互作用的数据来推测[12].上升一个层次,可以利用显微镜成像等方法直接观察不同类细胞的分布和连接[13,14],结合组织透明化方法[15],三维和原位的细胞表型分析逐渐成为可能[16,17].再向上一个层次,则是临床观察到的复杂细胞-细胞相互作用的集成结果.酶介导的邻近标记方法,作为一种人为增加相互作用追踪标记的手段,与现有检测方法相辅相成,是很有发展潜力的化学生物学切入角度.
本文综合评述了基于邻近标记酶实现跨细胞标记的多种设计及其应用范围、优点和缺陷,包括用于检测已知的细胞对之间相互作用的Split酶方法[18,19]、分置酶和相应底物肽段的方法[20,21],以及用于检测已知细胞与未知细胞之间相互作用的低底物特异性标记酶的跨细胞标记方法[22~24],并对邻近标记方法在混合细胞群体中有时空分辨率的相互作用检测进行了展望.
1 邻近标记与邻近标记酶
1.1 邻近标记方法的基本原理
两个细胞彼此邻近可能是随机事件,可能是组织中有生物学意义的细胞空间组装需要,也可能是两个细胞正在发生相互作用.随机事件理论上可以根据已有的生物学原理和重复实验排除,后两者有时难以准确分开.例如,细胞的解剖学位置可能影响其生理功能,即影响着它的相互作用组学[25].一些邻近标记方法仅在确实存在细胞-细胞相互作用时才能检出信号.T细胞与表面呈递有相应抗原的靶细胞在相互作用时会发生细胞膜及膜蛋白的互换,属于胞啃作用的一种情况[26],这可以视为一种天然的邻近标记结果.Li等[7]利用相互作用后靶细胞表面残留的T细胞受体和T细胞膜蛋白,在表达各种抗原的癌细胞库中鉴定出特定T细胞可识别的对应抗原.而另一些邻近标记方法具有更强的普遍性,对一定距离内可能反应的底物均有标记.例如,Geri等[27]发展了μMap技术,利用蓝光照射下铱催化剂经Dexter能量转移机理促使卡宾生成,而卡宾作为易于淬灭的碳氢键插入试剂,可对微环境中蛋白实现小范围、高精度的标记.该技术被拓展到突触内跨细胞标记,证实了标记结果对相互作用蛋白对的高选择性(图1).此外,还有许多化学、生物方法可实现邻近标记,本文重点讨论酶介导的邻近标记反应.
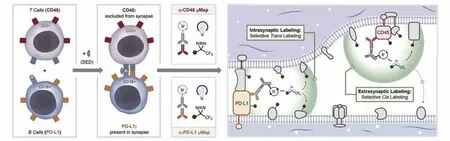
Fig.1 Non-enzymatic proximity labeling via Dexter energy transfer
1.2 邻近标记酶概述
酶介导的邻近标记的主要原理是,在一定的环境条件下,某些酶能够催化小分子底物,即标记探针,共价连接至酶附近一定半径内的内源蛋白[28~30].当这些酶被固定在特定细胞类别、亚细胞区域或特定蛋白的分布位点等,可以给周围较大概率参与相互作用的蛋白打上标记,供进一步进行生化或蛋白质组学鉴定.
目前,已有多种酶被进化或工程化以适用于邻近标记体系,其中一些酶对被标记的底物蛋白序列要求少,或其标记反应是基于活性物质的扩散,因此,常用于未知相互作用蛋白的捕捉.如,工程化的大豆抗坏血酸过氧化物酶(APEX2)在过氧化氢存在下,可氧化连有生物素的酚类底物为酚氧自由基,在几分钟内实现对哺乳动物活细胞内邻近蛋白的标记[31].辣根过氧化物酶(HRP)的生化检测应用极为广泛,其同样利用酚氧自由基扩散进行标记,近期被用于原位研究神经发育过程中时空分辨的表面蛋白质组[32].生物素邻近标记鉴定(BioID)方法不需要氧化剂辅助,底物生物素和腺苷三磷酸(ATP)在酶催化下可形成高活性中间体生物素-AMP,该中间体扩散并与周围一级胺反应,使蛋白带有生物素标记[33].TurboID和miniTurbo 2种酶与BioID中所用的酶同源,但邻近标记反应速率大幅提升[29].基于细菌Pup蛋白修饰的相互作用标记(PUP-IT)技术可用于研究膜受体的相互作用蛋白,其利用Pup蛋白连接酶(PafA)在附近蛋白的赖氨酸残基侧链上进行类泛素化修饰(Pupylation)[24].还有一些邻近标记酶识别特定的底物序列可用于检验是否发生特定相互作用,并追踪该相互作用发生的时间、空间和时空变化.如,BioID中所用生物素标记酶的野生型前身大肠杆菌生物素连接酶(BirA)需要至少14个氨基酸的特定肽段作为底物[34].大肠杆菌硫辛酸连接酶(LplA)经定向进化筛选,可以将硫辛酸或类似结构的探针高效且特异地连接到13肽底物序列[35].分选酶(Sortase)是一类半胱氨酸转肽酶,能识别蛋白C端Leu-Pro-Xxx-Thr-Gly(LPXTG)序列和N端寡聚甘氨酸,可标记生物素在内的多种探针分子[36].此外,还有多种类似的转肽酶被发现并工程化[37,38].
上述邻近标记酶大多并非来源于动物细胞,因而这些标记反应对哺乳动物细胞内源生化反应有较高的正交性,即标记结果的背景干扰较低.另外,从标记内容考虑,蛋白-蛋白相互作用不仅仅发生在细胞内部,当相互作用发生在细胞界面,即考虑细胞表面蛋白的相互作用组,可能包含细胞-细胞相互作用时彼此靠近的、来自2个不同细胞的配体-受体相互作用.将邻近标记酶置于此处,有望记录并推导出细胞-细胞相互作用的信息.
2 对已知细胞相互作用的标记
现有数据较为充实的跨细胞标记技术有着相近的思路:选定关注的相互作用两方,将酶本身或者酶和底物分别置于2个相互作用的细胞,在相互作用原位进行标记反应,有时可衔接下游的生理生化表征.
2.1 Split邻近标记酶
一种直截了当的设计是原位组合出可检测的信号分子,其中代表性的是Split绿色荧光蛋白(sGFP)的设计[39,40].虽然其并非原位生成邻近标记酶,但为后续设计提供了重要的基础和参照.Split蛋白的两部分重组并形成有生理功能蛋白的过程,也可以视为因底物靠近而发生的自催化反应.2007年,Feinberg等[39]发展了跨突触相互作用分子的GFP重构(GRASP),该方法将互补的2个sGFP片段分别融合表达在不同细胞跨膜蛋白的胞外区上,2个sGFP片段均无荧光,仅当它们所在的膜蛋白受体跨过细胞间隙彼此充分靠近时才能产生荧光信号[图2(A)].当体外混合培养分别表达2个sGFP片段的原代肌细胞和神经元时,可在细胞交界处检出GFP荧光.研究[39]还证实,在线虫中无论对于广泛分布的CD4蛋白,还是突触前膜定点分布的蛋白酪氨酸磷酸酶(PTP-3A)或突触后膜定点分布的神经胶质素蛋白(NLG),GRASP方法均可给出符合各组分位置特异性的荧光信号.该方法也有一些缺陷,如2个互补sGFP片段之间亲和力较高,其自发结合可能错误报告一些并未发生的相互作用;另外,一对相互作用蛋白仅组合生成1个GFP分子,其荧光亮度有限,限制了该方法的灵敏度.
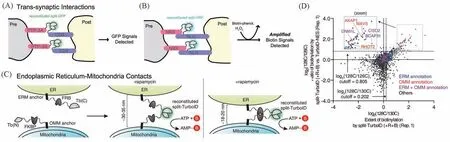
Fig.2 Sensitive visualization of cell-cell interactions with split proteins
为应对这些问题,Martell等[18]设想用具有信号扩增能力的酶代替GFP.他们选择可在胞外环境发挥作用、检测灵敏度极高的HRP,经进化筛选得到一对Split HRP片段(sHRP).它们表达在细胞表面时,彼此自发结合的趋势很低,而且需要血红素作为辅助因子介导其跨细胞重构.他们以神经细胞突触处膜蛋白(Neurexin,NRX)和NLG的相互作用验证这一邻近标记体系.与sGFP设计类似,sHRP片段分别融合表达在NRX和NLG末端,可在存在相互作用的细胞界面生成有活性的HRP;然后固定细胞,提供HRP标记反应条件,此时HRP快速将周围蛋白低选择性地标记大量生物素.因为有活性的HRP仅存在于跨细胞蛋白-蛋白相互作用处,所以抗生物素的荧光分子可以清晰地对细胞-细胞相互作用界面成像[图2(B)].若并列定量比较sHRP与sGFP设计在神经元突触间隙的标记效果,sHRP呈现更高的荧光强度和信噪比.他们还验证了sHRP片段可在活体动物内跨突触重构,经组织切片的标记和成像,可指示跨突触细胞接触位点.最近,Cho等[19]将Split TurboID方法用于研究内质网-线粒体接触位点的蛋白调控,实现了有条件的、空间特异的邻近标记.该工作主要研究的是胞内2个有膜细胞器之间的相互作用,同时,对质膜包被的细胞之间的相互作用的表征也有所启示.通过筛选找到全长TurboID分割的位点,引入小分子结合调控结构域,使得新的TurboID标记系统的活性控制需要如下条件:(1)两片段靠近;(2)体系中有雷帕霉素(Rapamycin).没有雷帕霉素时,体系有微弱活性;加入雷帕霉素后,标记量显著增加[图2(C)].与sHRP方法对固定后样品的显微镜成像相比,该方法中酶的重构和标记反应均发生在活细胞相互作用原位,除时空特异性的优势外,被标记的蛋白可以通过生物素标记富集并进行质谱鉴定.研究者根据多个对照组质谱定量结果比较,筛选得到内质网-线粒体接触时局部富集的多个蛋白[图2(D)].他们还实现了利用G蛋白偶联受体接受另一个细胞信号时Arrestin的胞内结合,重构有活性的TurboID,在一侧细胞内标记相互作用界面附近的蛋白.若设计Split TurboID片段在相互作用间隙重构并标记双方细胞,其面临的一个问题是Split TurboID片段重构后反应活性较全长TurboID显著降低(如上文用于质谱鉴定的样品标记时间是4 h).对于动态变化较快的细胞-细胞相互作用,其标记量可能较低.而对于位置相对恒定的细胞或组织,单侧细胞胞内标记的设计既指示了相互作用的双方和具体界面范围,也可能辅助胞内信号转导通路相关蛋白的鉴定,同时有望发展为无需编辑送信号细胞的一种跨细胞标记方法.另外,Split蛋白片段在重构后通常不能可逆地分开,这可能影响活细胞的生理活动并干扰相互作用检测.
2.2 分置酶和相应底物肽段
许多基于酶和特异性底物序列的跨细胞标记方法也被陆续发展出来,如生物素标记细胞间接触(BLINC)方法[20]中,生物素连接酶BirA及其相应15肽底物序列分别融合表达在突触处膜蛋白NRX和NLG上,当2个细胞靠近,这组膜蛋白的自发结合使酶附近底物序列浓度增加,BirA在底物序列上标记生物素[图3(A)].将BLINC方法从人胚胎肾细胞推广到神经细胞时,Ting等[20]通过改变体积较大的邻近标记酶(35000)在膜受体上插入的位置,使用更强的启动子增加标记酶的表达量及串联多个底物多肽序列等方法来增加标记效率,这些策略可以为发展邻近标记工具提供参考.酶介导的相互作用依赖性探针连接(ID-PRIME)方法最初被用于研究活细胞内时空分辨的蛋白-蛋白相互作用[30],然后拓展成为标记跨细胞蛋白-蛋白相互作用的工具[20].该方法的设定与BLINC十分相似,替换了其中的酶和底物,从而得到更稳定、可重复性高的标记效果[图3(B)~3(F)].同时,由于LplA可以识别与其天然底物类似的、带有生物正交反应官能团的小分子(叠氮甲基吡啶衍生物),与Click反应衔接,即可在相互作用细胞上共价连接报告荧光团[图3(B)].BLINC和ID-PRIME这2个方法标记反应均比较快(30 min以内),但灵敏度有待提升.现有文献报道通常依靠带有酶和底物肽段的膜蛋白的过表达[20],而这可能影响这些膜蛋白原本的生理功能.该工作中NRX和NLG的过表达使神经元有时在非突触位置形成2个细胞紧贴的结构[图3(C)星号处].同时,酶对对侧细胞上过表达的底物肽段的亲和力,可能影响2个细胞相互作用的动力学,降低检测结果的可信度.
Sortase作为邻近标记酶也有类似的使用方法.以细胞膜表面自然暴露的N端多个甘氨酸的膜蛋白作为底物,体系中游离的Sortase可以快捷地在细胞膜表面修饰小分子探针和纳米抗体[41].在细胞-细胞相互作用模型中,虽然Sortase被固定在一侧细胞膜,但原则上仍可以标记类型十分广泛的底物,而不受限于生物素(BirA及其衍生的酶)、酚类化合物(HRP、APEX2等过氧化物酶)和特定脂肪酸衍生物(LplA)等.2018年,Pasqual等[22]发展了通过细胞间接触处的Sortase反应标记相互作用的免疫细胞(LIPSTIC)技术,可以在活体动物内使用Sortase作为邻近标记酶捕捉T细胞和树突状细胞(DC)的相互作用.他们制备了CD40L上融合表达Sortase的OT-Ⅱ细胞(识别卵清蛋白抗原的CD4+T),所有CD40上融合表达G5(5个连续的甘氨酸,Sortase识别的底物序列)的转基因小鼠,以及从这些小鼠体外分离出的、被导入卵清蛋白抗原肽段的DC细胞.当T细胞与DC在淋巴结等位置相互作用时,CD40L与CD40结合,Sortase将外加的带有LPXTG多肽序列的生物素底物连接到对侧的抗原特异性的DC表面.他们比较了DC呈递的抗原种类(是否与T细胞识别的抗原相符)、相互作用的时间阶段及对DC被标记量的影响,其结果与现有其它手段观察到的相互作用进程相符.与通过原位标记荧光团来报告相互作用相比,利用该方法可以分离出参与相互作用的细胞,从而在下游的分析得到更多信息.例如,对小鼠中在不要求抗原特异的识别阶段被标记的内源DC,分别表征了标记量高低的2个亚群转录组的差异,从而辅助对此阶段相互作用机理的推测.该工作选取的相互作用对CD40-CD40L,是众所周知的参与T细胞和DC细胞作用的分子,对其相互作用的各阶段性质已有相对充分的了解,在这一体系的邻近标记更多是验证性结果.其后续可能的一个生长点是表征生物学原理尚不清晰的配体-受体对的跨细胞相互作用,阐释新的、有生理意义的相互作用的动态变化,甚至鉴定到新的相互作用对,这将更加充分地发挥酶介导的邻近标记方法的优势.无论是带有Sortase的膜蛋白,还是其相应受体,均需要被转基因编辑,使其带有酶和底物序列,天然地阻碍了该系统用于未知细胞-细胞相互作用的鉴定.
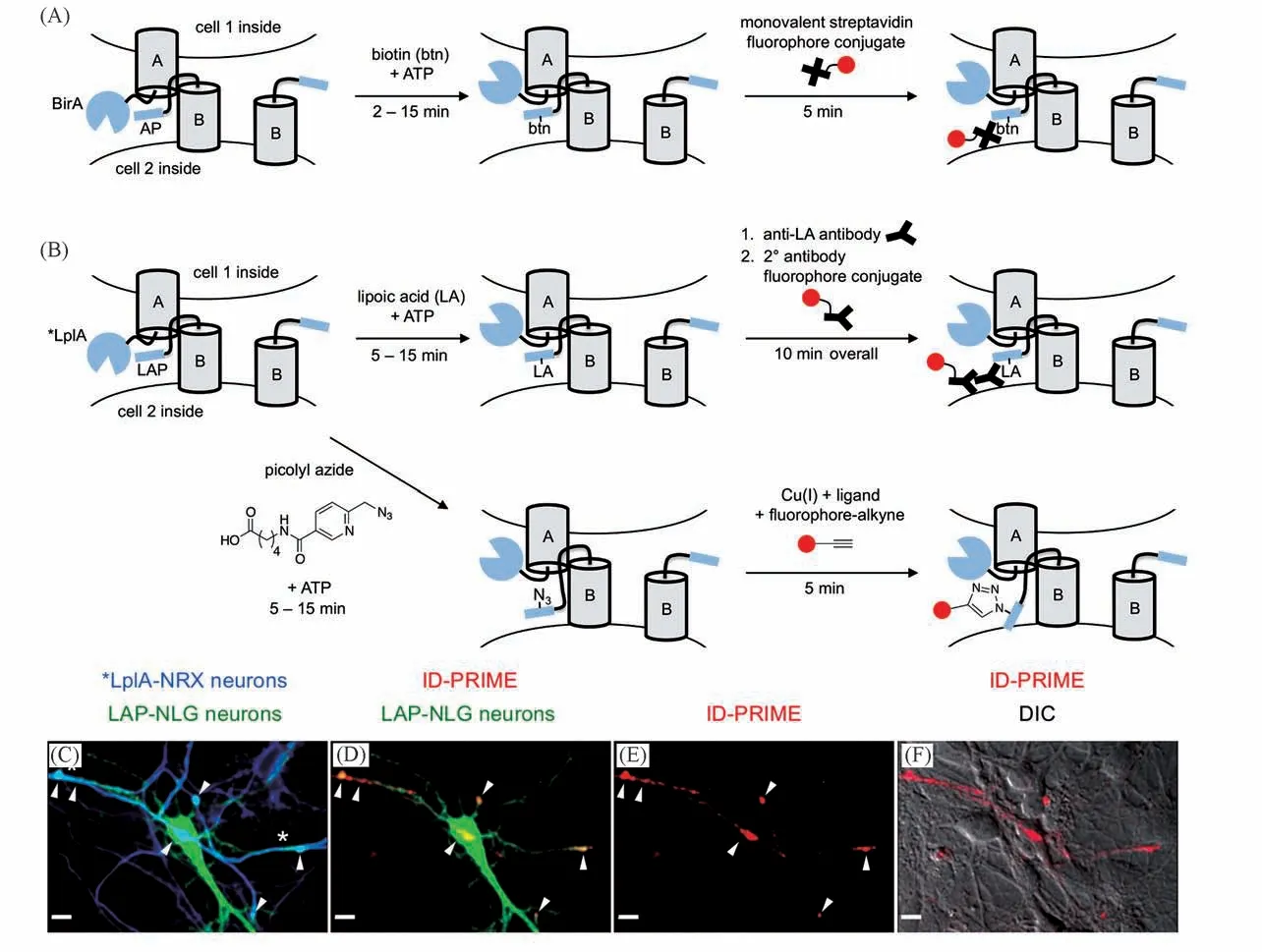
Fig.3 Trans-cellular labeling with BirA and LplA[20]
3 对未知细胞相互作用的标记
迄今,已有一些工作试图将邻近标记的对象拓展到未知细胞.原理上考虑,从标记已知细胞上的已知底物肽段到未知细胞的膜蛋白:或者放宽酶的底物范围,使用对底物序列特异性要求较低的邻近标记酶;或者让带有特异底物序列的细胞种类增多,如将底物序列融合表达在所分布细胞类型更普遍的膜蛋白上.流式细胞术中细胞被抗体染色的荧光强度指示细胞表面特定抗原的数量,可以为靶点选择提供指导[27].Chen等[23]发展了酶介导的细胞间邻近标记(EXCELL)技术,用于在活细胞中记录其未知相互作用细胞[图4(A)].野生型Sortase对3个以上的甘氨酸活性较高,而该工作筛选得到了对N端单个甘氨酸的蛋白底物识别效率更高的Sortase突变体mgSrtA,考虑到数据库中细胞表面膜蛋白中N端含有单个甘氨酸的蛋白数量远大于有多个甘氨酸的蛋白的数量[41],标记未知细胞时,mgSrtA理论上比野生型Sortase有更高的标记效率.Liu等[24]发展的PUP-IT技术也适用于胞外蛋白相互作用体系[图4(B)].他们利用Jurkat细胞系上CD28受体简略地实施了跨细胞标记实验,在显微镜下观察到与Jurkat相互作用的细胞上局部有明显的标记信号.该方法中PafA仅在赖氨酸侧链上修饰,与APEX2等可自由基标记多种氨基酸残基技术相比,在质谱数据上便于回溯.另一潜在优点是,所用的酶和底物均可以转基因并表达的方式处在标记位点附近,避开了动物模型中底物不易递送的问题(但可能有伴随的酶活控制的需要,而且PafA约为60 kDa,对被转基因系统压力较大).PUP-IT的标记时间约36 h,较Sortase的1 h长许多,且二者均长于一些变化较快的细胞接触的时间.这些未知细胞标记方法需要应对的另一个问题是,它们往往对载有酶的细胞自身有很大标记量,这是由于其自身细胞膜上的很多蛋白也是邻近的底物.如果要对对侧相互作用细胞被标记的蛋白进行生化和质谱分析,需要排除自我标记的信号,如预先根据细胞表面的特异抗原进行流式分选或抗体筛选.
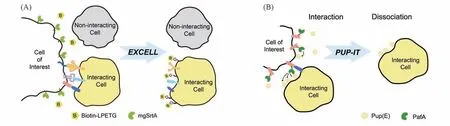
Fig.4 Trans-cellular labeling with sortase and PafA
目前,人们仍在不断开发新的跨细胞标记手段来表征细胞-细胞相互作用,其设计框架不局限于上述类别,同时这些方法的应用也将逐渐被拓展到活体动物层面,以标记有生理学意义的而非人为设置的相互作用.
4 邻近标记酶的活性调控
在邻近标记设计方法中,既使用酶活高、底物范围广(即可标记未知的相互作用细胞)的邻近标记酶,又不对酶的活性加以限制的设计尚少见报道,推测其标记结果会有极高的非特异背景,给数据分析带来较大困难.而对细胞-细胞相互作用的研究,其时空特异性信息对标记结果的生物学意义的解读至关重要.最直接的应对方法是控制酶能否接触到标记反应必需的某种底物.例如,在使用HRP时,利用HRP分泌上膜前无活性,设计无法渗透跨过细胞膜的生物素-酚类底物探针,从而确保胞内蛋白极少被标记;利用过氧化氢短暂存在于体系中,从而确保标记时间明确、标记量稳定[32].另外一些工作利用抗生素分子拉近了2个结合蛋白结构域而将邻近标记酶拉近细胞表面(即调整了接近细胞膜蛋白底物序列的概率[24]).对于体外培养的细胞和极薄的组织切片,添加和移除底物都较为方便.但若是考虑到三维结构的细胞组装体,小分子如过氧化氢可高效渗透,但多肽和蛋白探针的递送便困难许多[42],其扩散不均匀可能增加标记结果的偏倚程度.对于活性高而底物选择性很低的许多邻近标记酶,如HRP,APEX2和TurboID,它们都各自有Split的版本[18,19,43],有时还与小分子诱导靠近的方法联合以控制酶活.对于转基因表达的蛋白,一类通用的方法是调控启动子活性,可以与营养物质[44]、抗生素[45]和光[46]等相关联.但这类刺激响应需要经过转录和翻译过程,往往时间控制在几十小时的量级.对于活体动物层面的实验,前述可体内应用的邻近标记方法LIPSTIC[22]当且仅当细胞生理活动需要CD40L表达时,其标记酶才会被一并诱导表达在细胞膜表面,从而将标记的时间窗口与有生理意义的相互作用建立了一定的关联.Wang等[47]利用特定水解酶的组织特异性,人为设计化学保护基团,使非天然糖得以组织特异地代谢插入,即组织特异地引入了生物正交反应官能团,该方法可转化用于控制邻近标记酶的空间分布.更通用的生物正交蛋白活性控制方法[48]也可作为邻近标记酶活性控制的参考.
5 总结与展望
本文综述了目前多样化的邻近标记方法,并讨论了其应用范围、优势和缺陷.整体而言,高活性的邻近标记酶是邻近标记领域较常用的工具,在合理、精准的酶活性控制下,可作为细胞-细胞相互作用的报告手段.其中一些方法可应用于组织和活体动物,而组织中的邻近标记需要克服的主要困难之一是标记探针的递送.若被标记细胞自身带有可转化为标记物的底物,可能导致标记信号背景较高.若需要外加底物探针,活体动物中可通过体循环给药,其缺点是小分子探针可能很快被代谢排出,而大分子底物组织渗透性却有限.可针对已知细胞的迁移路径局部给药,如通过细胞间接触处的Sortase反应标记相互作用的免疫细胞(LIPSTIC)技术[22];或是将目标细胞诱导到特定位置并集中给药,如在活体树突状细胞代谢中插入非天然糖[49].
有空间分辨率的组织蛋白质组学分析可能是邻近标记的重要发展方向之一.邻近标记结果提供了细胞层面的空间组装信息,为相互作用事件引入可检测、可富集的分子特征,而提取和分析这些信息的方法也随着邻近标记方法的发展而发展.目前占主导的方法是显微镜成像[13,14,50~52]和基于单细胞的分析,如流式荧光染色表型分析[53]或通量更高的单细胞测序[10,11,54].蛋白由于其扩增难度高,翻译后修饰多样,往往难以在组织等非均一多细胞体系层面进行单细胞检测.邻近标记过程中,被标记蛋白多是精确空间范围的膜蛋白,在一定程度上排除了大量胞内蛋白的干扰,增强了质谱检测的可行性[27].不同于单细胞层面分析反映整个细胞平均化的性质,时空分辨率的蛋白质组学分析可反映单个细胞内局域不均匀的性质,提供相互作用界面局部的分子排布信息,如免疫突触处膜蛋白的组成和比例.
与现有的成像和测序技术相比,邻近标记方法有独特的应用价值.邻近标记方法可用于记录历史相互作用信息.若要研究细胞-细胞相互作用对细胞生理状态的影响,研究者不仅需要分析相互作用时的信息,也需要追踪后续发生的和互相作用导致的变化,如对于细胞的生理影响,不仅需要相互作用时刻的信息,也需要对相互作用带来的下游变化,如对于抗原激活后的抗原特异的T细胞表达特定细胞因子进行多重表型分析.若表征时刻不是相互作用仍然发生的时刻,成像则无法反映.类似地,可供推断相互作用的转录组信息也可能在相互作用后迅速衰减,并被别的生理调节所掩盖.相比之下,若相互作用伴随邻近标记,细胞便持续地带有可被检测的、指示相互作用对象的特征,这一特征与多种分析手段,如膜蛋白上调下调、细胞因子分泌、吞噬/杀伤作用等相结合,有助于研究者区分特定相互作用细胞对的生理效应.邻近标记方法还可用于记录特定范围内细胞群的相互作用.研究者人为选定的细胞群带有邻近标记工具,理想条件下仅有此群细胞的相互作用细胞可被标记,这对于研究生物标记物共享程度较高的细胞相互作用系统,如先天性免疫细胞的调控原理有重要意义.如在某类巨噬细胞上固定邻近标记酶再回输体内,那么被此类巨噬细胞激活的T细胞带标记,而被另一类巨噬细胞激活的T细胞无标记.若这两类T细胞在检测时均未与巨噬细胞黏附,且由于巨噬细胞极多的细分亚型,这两类T细胞在转录组上可能出现大多数位点的转录拷贝数接近,少数有差异.邻近标记的信息可以帮助将这少数差异与两类巨噬细胞作用关联起来,指示免疫调控机理方面的研究.

