一株乳源蜡样芽孢杆菌肠毒素基因克隆与序列分析
陈玉娟,赵瑶,马鲜平,高丽旭,姚婷,刘倩如,谢远兵,易华山
(1.西南大学动物医学院,重庆 402460;2.重庆市永川区动物疫病预防控制中心,重庆 402160)
奶牛乳房炎(Cow mastitis)的病原菌主要是一些条件性和传染性的致病菌。在伊朗,据Batavani[1]报道,引起乳房炎的前三大病原菌包括蜡样芽孢杆菌、凝固酶阴性葡萄球菌和金黄色葡萄球菌。蜡样芽孢杆菌(B.cereus)是一种革兰氏阳性菌,需氧,产孢子,是广泛分布于土壤、水、空气、饲料、食品和环境中的一种条件致病菌,存在于奶牛养殖环境之中,B.cereus甚至会以其他病原菌为依托,更加快速地定植和黏附在乳房上皮细胞之中,从而加快整个病程,且易导致奶牛死亡[2]。近年来,在我国新疆、宁夏等地B.cereus的检出率较以前明显增加[3],而且它产生的肠毒素有致吐和致泻作用,易导致人食物中毒;感染奶牛泌乳量下降,甚至失去泌乳能力,给全球畜牧业的经济发展带来了严重的损失[4,5]。B.cereus肠毒素可分为呕吐型和腹泻型两类[6],主要毒力因子分别为:与呕吐毒素相关的非核糖体多肽合成酶系(NRPS)基因[7];与腹泻毒素相关的溶血性BL基因(hb1A、hb1B、hb1C和hb1D)、非溶血性肠毒素Nhe基因(nheA、nheB和nheC)、肠毒素FM基因(entFM)、肠毒素T基因(bceT)和细胞毒素K基因(cytK)[8,9]。不同菌株中毒力基因的携带数目不相同,各毒力基因的携带率亦有差异。有研究测得菌株各毒力基因的携带率分别为非溶血性Nhe基因(89.19%)、entFM基因(79.88%)、bceT基因(49.85%)、溶血性BL基因(48.35%)、ctyK基因(47.75%)和呕吐毒素相关基因ces(1.50%)。呕吐型肠毒素又称为耐热的肠毒素,其对奶牛乳房炎有明显的致病作用[10],但是该毒素的致病机理及致病的具体作用尚不清楚;腹泻型肠毒素又称为不耐热的肠毒素,可导致奶牛流产[11]。本研究对耐药性奶牛乳房炎患牛乳液中分离的一株蜡样芽孢杆菌2018CQ-CMM01(B.cereus2018CQ-CMM01)肠毒素基因进行了克隆和序列分析,以期为耐药性奶牛乳房炎致病菌毒素相关基因的分子生物学研究及奶牛乳房炎的防治等提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
从荣昌某奶牛养殖场乳房炎患牛乳液中分离的蜡样芽孢杆菌2018CQ-CMM01株(B.cereus2018CQCMM01),70%甘油、-80℃保存菌液(由西南大学动物科学学院兽医科学研究中心保存)。
1.1.2 主要试剂
琼脂糖,购自华美生物工程公司;蛋白胨,购自Oxoid公司;EB溶液、50×TAE,购自北京博奥华医生物科技有限公司;10×Loading Buffer、DL2000 DNA Marker购自大连宝生物工程有限公司公司;动物基因组DNA快速抽提试剂盒,购自上海生工生物工程有限公司;AxyPrep DNA凝胶回收试剂盒,购自康宁生命科学有限公司。
1.1.3 引物设计
参照GeneBank收录的B.Cereus的基因序列(NZ_CP030982.1),利用引物设计软件Premer Primer5.0设计entFM基因引物F:5’-GTTCGTTCAGGTGCTGGTAC-3’,R: 5’-AGCTGGGCCTGTACGTACTT-3’。以上引物均由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 DNA的提取
取蜡样芽孢杆菌2018CQ-CMM01株细菌培养液5mL,10 000r/min(11 500×g)离心1min,尽量吸净上清,参照北京天根信息技术公司提供的细菌基因组DNA提取试剂盒(离心柱型)操作说明提取基因组DNA。
1.2.2 目的基因扩增及测序
以提取的细菌基因组DNA为模板,以entFM基因引物F和R进行PCR扩增,反应总体系为20μ L。反应条件:95℃ 5min,1个循环;95℃ 5min;94℃ 45s,55℃ 1min,72℃延伸30s,34个循环;最后72℃再延伸10min。PCR扩增产物于0.01g/mL的琼脂糖凝胶中进行电泳,电压、电流分别为150V、194mA,电泳结束后用凝胶成像系统观察结果。将PCR扩增产物送北京华大基因生物有限公司测序。
1.2.3 目的基因生物信息学分析
利用Expasy中的ProtParam程序(http://web.expasy.org/protparam/)计算蛋白质的理论分子量、等电点等特征数,并分析其稳定性、疏水性等理化特性;通过Protscale平台(http://web.expasy.org/protscale/)分析该蛋白的亲疏水性;应用SOPMA在线软件(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测Ent蛋白的二级结构;借助SignalP平台(http://www.cbs.dtu.dk/services/SignalP)检测其信号肽结构,用TargetP2.0(http://www.cbs.dtu.dk/services/TargetP)预测该蛋白是否含切割位点;利用CBS Prediction servers的TMHMM(http://www.cbs.dtu. dk/services/TMHMM/)预测Ent蛋白的跨膜区。
1.2.4 Ent基因系统进化分析
将测得的Ent核苷酸序列与NCBI中检索的22株相似序列进行核酸水平和蛋白水平的对比。利用NCBI的Blast Tree View Widget功能绘制Ent基因系统进化树;利用DNAMan软件对Ent基因核苷酸序列进行同源性比对。
1.2.5 Ent基因内一段小ORFs的序列分析
利用DNAStar中Editseq功能进一步分析Ent基因特性,并对得到的ORFs序列进行分析。用NCBI的Blastx功能分析这段ORFs的同源性和保守性结构域。
2 结果与分析
2.1 Ent基因PCR扩增
通过对蜡样芽孢杆菌2018CQ-CMM01株的活化培养,提取基因组DNA,利用EntF和EntR引物进行PCR扩增,PCR扩增产物经过0.01g/mL的琼脂糖凝胶电泳检测。结果显示,大约在1 100bp处有特异性条带,与预期结果一致(图1)。
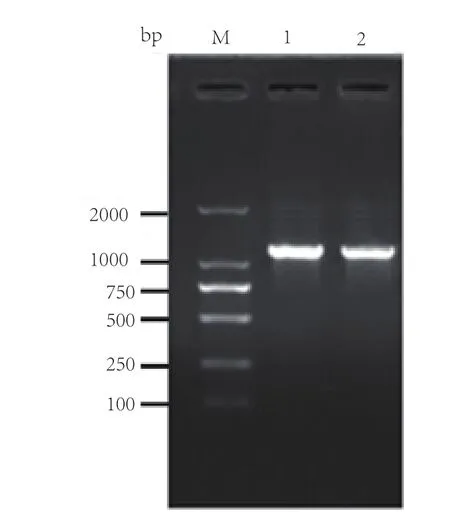
图1 Ent基因PCR产物琼脂糖凝胶电泳
2.2 Ent基因序列测定
经测序表明,Ent克隆基因片段长度为1 098bp,共编码349个氨基酸。
2.3 Ent基因生物信息学分析
2.3.1 Ent蛋白理化特性分析
通过ProtParam程序分析得到,Ent蛋白理论分子质量(MW)为40 324.06,分子式为C1844H2763N435O507S37,原子总数为5 586;理论等电点(pl)为8.52,为碱性氨基酸;在氨基酸组成上,Ser(S)49个,占14.0%,含量最高,其次Val(V)39个,占11.2%,Thr(T)36个,占10.3%;不稳定性指数(ⅱ)计算为42.11,因此将其归类为不稳定蛋白;脂溶指数为93.41,总平均亲水性(GRAVY)为0.705,属于疏水性蛋白。利用ProtScale在线软件计算疏水性图谱,发现整个蛋白质中疏水性最大值在第97位氨基酸,为4.367,最小值在第67位氨基酸,为-1.856,且Ent蛋白疏水区域大于亲水区域,为疏水性蛋白,与其预测结果一致(图2)。

图2 Ent蛋白的疏水性分析
2.3.2 Ent蛋白二级结构分析
通过SOPMA平台预测发现,Ent蛋白二级结构的主要组成元素为延伸链,含141个,占40%,其次为无规则卷曲97个,占27.79%,α-螺旋95个,占27.22%,β-转角16个,占4.58%(图3),几种结构均无规律散在分布。

图3 Ent蛋白二级结构预测
2.3.3 Ent蛋白信号肽和跨膜区分析
经SignalP数据分析,发现该蛋白在其N端27~28位有仅29.98%的可能存在信号肽;TargetP2.0分析结果表明该序列切割位点存在的可能极低,为16.91%,综合两种软件的分析结果,预测该Ent蛋白不存在信号肽或切割位点,是一种非分泌蛋白。利用TMHMM对Ent蛋白跨膜区进行预测,结果显示克隆片段编码蛋白存在5个明显的跨膜区,大概是在3~27位、78~102位、115~139位、273~297位、305~324位(图4),该蛋白为跨膜蛋白。
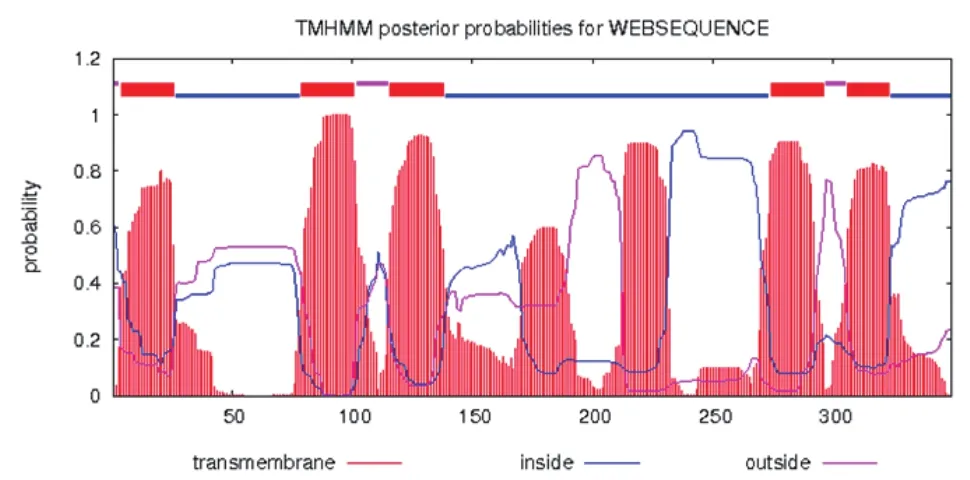
图4 Ent基因蛋白跨膜区
2.4 Ent基因序列分析结果
2.4.1 Ent基因核苷酸同源性比对结果及分析
本研究中,Ent克隆基因核苷酸序列与不同肠毒素同源性对比分析可得,与B.cereus克隆Pnc9肠毒素FM样基因部分序列(EF453659.1)相似度为96.45%,与B.cereus克隆Pnc10肠毒素FM基因部分cds(EF453660.1)相似度为95.54%,与B. cereus克隆Pnc6肠毒素FM基因部分cds(EF453657.1)相似度为95.36%,与B.cereus克隆Pnc1肠毒素FM基因部分cds(EF453652.1)相似度为95.29%,且通过与DNAMan软件分析核苷酸序列同源性,发现该基因与上述同源基因的同源性为95.22%,存在部分的缺失、插入及替换。将该Ent基因核苷酸序列与溶芽孢杆菌FJ部分序列(CP040336.1)、苏云金芽孢杆菌标准株ATCC10792部分序列(CP020754.1)、蜡样芽孢杆菌标准株ATCC10987部分序列(CP026375.1)作同源性对比,相似度分别为100%、96.63%和95.81%。
2.4.2 Ent基因序列系统进化分析
运用Blast Tree View Widget在线软件将测得Ent核苷酸序列与NCBI中检索的22株相似序列进行系统进化树分析,这些序列分别是中国菌株CP040336.1(2018-01-05)、CP011151.1(1979)、CP024655.1(2008-03)、CP040334.1(2017-12-27)、CP012483.1(2014-03-30)、CP022445.1(2003-07-10)、CP026607.1(2008-10)、CP010577.1(1987)、CP020002.1(2015-10-02);美国菌株CP020754.1(1946)、CP053972.1、CP001186.1、CP001177.1、CP003763.1;韩国菌株CP017060.1(2015-08-16)、CP029454.1(2016-01-01)、CP041981.1(2013-05-20);泰国菌株EF453659.1、EF453660.1、EF453657.1、EF453652.1;巴基斯坦B. cereus标准株CP026375.1。结果表明,Ent基因与中国菌株CP040336.1同源性最高,与巴基斯坦B. cereus标准株CP026375.1,泰国株EF453659.1、EF453660.1、EF453657.1等处于不同进化分支;而中国的CP011151.1、CP024655.1与美国的CP020754.1、CP053972.1等其他参考菌株位于不同的两个进化分支上,表明该基因与中国菌株CP040336.1的遗传距离最近,其次与亚洲的泰国菌株亲缘关系较近(图5)。

图5 基于 Ent基因的系统进化分析
2.5 Ent基因编码区内小ORFs
2.5.1 编码区内ORFs
利用DNAStar的Editseq功能进一步研究该基因特性,得到一段长为141bp的ORFs,序列如下:
ATGAATCCACTGCAGTCAAAACCAGCAGGTGT TGTACCAGCAGTTCTGTATGGTGAACCATTTAAAGA TCTAGCGAATCCAGCGATTGAAGATGTATTTCCACC TGTTGTTGGTTTTTGTACGTCTTTACCTGGTTGTTGA
2.5.2 ORFs(141bp)分子特征分析
用DNAstar软件包中的Editseq功能对141bp的ORFs进行了翻译,翻译结果为:MNPLQSKPAGVV PAVLYGEPFKDLANPAIEDVFPPVVGFCTSLPGC。通过分析可知,该蛋白含有46个氨基酸,理论分子量为4.7ku,等电点PI值为4.1。用NCBI的Blastx功能对ORFs(141bp)核苷酸序列到蛋白质数据库进行比对(表1),分析其同源性及保守性结构域,发现该蛋白与魏氏芽孢杆菌P60肽酶(PEM24067.1)的部分序列相似性为98%,与蜡样芽孢杆菌内肽酶(WP_074532117.1、PFW58890.1等)的相似性为100%,与蜡状芽孢杆菌ATCC 1087 的SH3结构域蛋白(KFL74150.1)的相似性为98%,与移动杆菌内肽酶(WP_120449857.1)的相似性为98%,与苏云金芽孢杆菌内肽酶(WP_103577936.1)部分序列的相似性为98%,表明该蛋白与蜡样芽孢杆菌内肽酶的同源性最高。由保守结构域分析可知,该结构域与Spr特异性位点、NLPC_P60非特异性位点和NLPC_P60家族有相似的保守性结构域(表2)。该结构域与Spr特异性位点、NLPC_P60非特异性位点对应的氨基酸序列对比详见图6,红色字体为相同的保守氨基酸位点。Spr特异性位点有细胞壁相关水解酶作用,而NLPC/P60家族存在于几种脂蛋白中,空间结构域为多聚体(图7)。根据蛋白数据库同源性对比及保守性分析,推测该ORFs为与蜡样芽孢杆菌组R309803(EEK79374.1)肠毒素相关的新基因或调控因子。

表1 蛋白质数据库同源性对比表

表2 ORFs保守性结构域

图6 ORFs保守性结构域与保守性氨基酸位点

图7 NLPC_P60家族结构域模式图
3 讨论
肠毒素被认为是引起食物中毒的一种重要因素,肠毒素在体内促使体液和电解质从肠道黏膜中流失,引起一系列的肠道病理变化从而出现腹泻症状。肠毒素还包括肠毒素T、肠毒素FM(EntFM)及肠毒素K(CytK),它们都为单一蛋白组分,分别由bceT、entS和cytK(entK)基因编码[12]。但是本研究中Ent基因在ORF的第137~277位,存在一个小的ORFs编码区,结构预测发现,该区编码的氨基序列与蜡样芽孢杆菌内肽酶表现出极高的同源性,且该区的结构域与Spr特异性位点、NLPC_P60非特异性位点和NLPC_P60家族有相似的保守性结构域,说明他们可能存在功能上的相关性和进化上的同源性。
本研究对Ent核苷酸序列与NCBI中检索的22株相似序列进行系统进化树分析,发现克隆的Ent基因与中国菌株CP040336.1同源性极高而与大部分其他中国参考菌株的亲缘关系相对较远,但是核苷酸序列一致性在95%以上,这可能与国内对蜡样芽孢杆菌的研究较少有关。将Ent基因克隆片段与不同肠毒素进行核苷酸同源性分析,发现它们的同源性高达95.22%,一定程度上说明肠毒素基因的高度保守性。Jeßberger等人的研究也证明肠毒素基因nheABC和hblCDA有强遗传保守性[13];同时,该Ent基因存在部分的缺失、插入及替换,由此推测,这些突变可能是毒株毒力发生变化的主要原因。该Ent基因核苷酸序列与溶芽孢杆菌FJ部分序列和苏云金芽孢杆菌标准株ATCC10792部分序列也表现出较高的同源性,说明肠毒素基因在进化上的多样性。
呕吐型肠毒素(Cereulide)是蜡样芽孢杆菌通过非核糖体途径合成的,其是一种环状十二肽,最适温度为12~22℃,受多种环境因素的调节影响,因其耐热性和稳定性,在巴氏杀菌、加热和胃内消化过程中难以被消灭而致病[14~17]。腹泻型毒素主要有Hbl、Nhe和CytK,其中Hbl和Nhe 都是由三个亚基组成的毒素[18~20],而CytK是一种可形成β-桶的溶血性毒素,该毒素可使细胞形成孔洞从而导致细胞坏死[21]。研究表明细菌毒素能在细胞膜上形成孔洞,这种孔洞会引起细胞内钠离子(Na+)和氯离子(Cl-)的流失,使细胞的电位失去平衡而导致腹泻[22,23]。本研究将蜡样芽孢杆菌肠毒素Ent基因上一个141bp的ORFs核苷酸序列到蛋白质数据库进行比较,发现该编码区能编码杆菌通道蛋白相关的内肽酶,可能成为与蜡样芽孢杆菌组R309803(EEK79374.1)肠毒素毒力相关的调控原件或调控因子。该小ORFs编码的通道蛋白及酶蛋白是否参与孔洞的形成机制尚不清楚,值得进一步研究。
本研究对乳源蜡样芽孢杆菌Ent基因的分析结果将为进一步探究其功能和表达机制提供基因材料,也为科学地预防奶牛乳房炎提供分子水平的依据。同时,蜡样芽孢杆菌作为一种常见的食源性条件致病菌,是市售食品污染来源的关键因素。因此加强对乳源及食品中蜡样芽孢杆菌污染的监控,建立一种简便可靠的检测方法及风险评估亟待研究。
4 结论
本研究克隆了奶牛乳源蜡样芽孢杆菌Ent基因ORF为1 098bp,编码349个氨基酸;该蛋白为碱性的疏水性蛋白,不稳定,无信号肽结构,存在5个跨膜区域,其二级结构主要由延伸链组成。在基因ORF内存在一个大小为141bp的小的ORFs编码区,对141bp小ORFs区结构预测发现,其编码杆菌通道蛋白相关的内肽酶,可能是毒力基因调控因子;系统进化分析表明Ent基因与中国菌株CP040336.1的遗传距离最近,与巴基斯坦B.cereus标准株CP026375.1,泰国株EF453659.1、EF453660.1等处于不同进化分支上。


