滩涂湿地中全程硝化菌随季节和深度变化的分布特性
戴 红, 蒋秋悦, 全哲学
(复旦大学 生命科学学院,上海 200438)
硝化作用作为连接固氮和反硝化作用的中间过程,是生态系统氮循环过程的重要环节[1]。传统的硝化作用分为2个过程[2],包括将氨氧化为亚硝酸盐的过程(由氨氧化菌来完成)和将亚硝酸盐氧化为硝酸盐的过程(由亚硝酸氧化菌来完成)。Costa等[4]提出了全程硝化菌(complete ammonia oxidizer, comammox)存在的可能性,即1个微生物可通过氨氧化和亚硝酸氧化单独完成原来由氨氧化菌和亚硝酸氧化细菌协同完成的过程,以获得更多的能量。全程硝化菌的发现[3]打破了之前硝化作用需要由两种不同的微生物来完成的理论,填补了生物地球化学氮循环中的关键过程,引起了社会的广泛关注。因此,研究全程硝化菌在生态系统中的多样性和贡献,是氮循环机制研究和硝化微生物研究的重要基础。目前,已经获得纯培养的全程硝化菌是在深层石油井地下水管内的生物膜上[4]发现的Nitrospirainopinata。在水产养殖系统的滴滤池[5]样品的厌氧除氮反应器中,也获得了2种全程硝化菌的富集培养物候选种Nitrospiranitrificans和候选种Nitrospiranitrosa,这些已报道的全程硝化菌在氨氧化过程的核心功能酶氨氧化单加氧酶基因amoA的系统发育树中形成一个簇(clade A)[4-5];在采自地下水样品的宏基因组中[5],检测到了形成另一个簇(clade B)的全程硝化菌。此外,在饮用水系统[6]、地下水快速砂滤器[7]和农业土壤[8]的宏基因组分析中也检测到了全程硝化菌。这些研究表明,全程硝化菌在人造环境和自然生态系统中广泛分布。目前,检测不同环境样品中全程硝化菌的方法有多种,包括利用宏基因组学方法研究全程硝化菌与其他氨氧化菌的分布比例[9],根据全程硝化菌的amoA序列设计新的特异性引物检测全程硝化菌[10],以及利用高简并引物两步PCR扩增方法[11]和部分巢式PCR扩增方法[12]分析环境样品中的全程硝化菌的群体结构和多样性。这些方法的建立为研究环境样品中全程硝化菌的多样性和分布奠定了重要基础。滩涂湿地作为连接陆地和海洋的生态系统,在全球物质循环中起着重要的作用[13]。每年大量营养物质通过长江涌入滩涂河口地区,其中除了硝酸盐还包括相当多的铵和有机氮等,这些营养物通常被认为是氮转化,尤其是硝化作用主要基质[14-16]。除了远海环境外,全程硝化菌在各种生态环境中都被检测到,在滩涂生态系统中的分布在前期研究中已有报道[12]。之前利用设计的高简并引物两步PCR扩增的方法,分析了4个季节中长江口不同深度的滩涂沉积物内全程硝化菌和氨氧化细菌的分布特点[17],结果表明,与氨氧化细菌相比,春季表层(0~1 cm)和浅表层沉积物(1~5 cm)以及秋季深层沉积物(5~10 cm)中的全程硝化菌的比例相对较高。但此分析的缺陷在于,设计的引物不能覆盖全程硝化菌的clade B类型,且高简并引物对clade A.2不能完全覆盖[12]。本次研究结合可覆盖环境中全程硝化菌的所有类型的部分巢式PCR扩增方法和高通量测序方法,分析了长江河口滩涂沉积物在不同季节和不同深度的全程硝化菌的群落结构,研究了全程硝化菌的生态分布特点与环境因子的关系,这对认识滩涂生态系统氮循环过程中全程硝化菌的贡献具有重要意义。
1 材料与方法
1.1 材料
1.1.1 样品采集 分别于2014年的1月、4月、8月和10月在长江河口的崇明东滩滩涂地区采集样品,以冬(W)、春(Sp)、夏(Su)、秋(A)代表不同月份。在相距50 m的区域内分别设立了3个重复样点(A、B和C),按照5点采样法,对每个样点的3个不同深度采样:表层(0~1 cm)、浅表层(1~5 cm)和深层(5~10 cm),以数字0、1和5分别命名。样品混匀,冰盒保存,用于理化性质测定和DNA的提取。
1.1.2 主要试剂 Axygen胶回收试剂盒(天根生化科技北京有限公司),PowerSoil DNA提取试剂盒(Mo Bio Laboratories,USA),Ex Taq premix酶(TaKaPa,Japan),牛血清蛋白(BSA)。
1.1.3 仪器与设备 多用途水平电泳仪(BG-subMIDI,南北仪器有限公司),PCR仪(MG96+,上海赛默生物科技发展有限公司),便携式pH计(Bante211,上海班特仪器有限公司),超净工作台(VD-850,苏州江东精密仪器有限公司),0.22 μm滤膜(生工生物工程(上海)股份有限公司),高速离心机(Pico17,上海凌仪生物科技有限公司),微量移液枪(EF100,赛默飞世尔科技(中国)有限公司),涡旋振荡器(Vortex-genie2,USA),离子色谱仪(ICS-1000,Dionex,Sunnyvale,CA),碳氮分析仪(Flash EA 1112Series,Thermo,Italy)。
1.2 方法
1.2.1 理化性质检测 样品的理化性质数据参考文献[17]。具体方法如下:样品50 ℃烘干过夜,加入2 mol/L KCl溶液30 ℃震荡孵育1 h[18],取上清0.22 μm滤膜过滤,滤液用于硝酸根离子检测,比色法检测铵浓度[19],使用Bante211便携式pH计测量上清液的pH值。烘干的样品经研磨过100目筛,取40 mg使用碳氮分析仪检测总碳(TC)和总氮(TN)含量。
1.2.2 DNA提取 样品的DNA提取按PowerSoil DNA提取试剂盒说明书进行,1%的凝胶电泳检测,-20 ℃冰箱保存。
1.2.3 部分巢式PCR扩增 利用部分巢式PCR[12]对全程硝化菌的amoA基因进行扩增。第一轮PCR使用的引物为A189Y和为区分不同样品在5′端包含8个碱基barcode 的C576r[12],扩增体系为50 μL,反应体系:无菌水20 μL,上下游引物(10 μmol/L)各1 μL,Ex Taq premix 25 μL,牛血清蛋白(20 mg/mL)2 μL,DNA模板1 μL。反应程序:95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火50 s,72 ℃延伸50 s,20个循环,72 ℃延伸10 min。第二轮PCR使用的引物为CA209和为区分不同样品在5′端包含8个碱基barcode 的C576r[12],扩增体系为50 μL,利用的DNA模板是第一轮的PCR产物,反应体系:无菌水15 μL,上下游引物(10 μmol/L)各2 μL,Ex Taq premix 25 μL,BSA(20 mg/mL)2 μL,DNA模板4 μL。反应程序:95 ℃预变性5 min;94 ℃变性1 min,50 ℃退火50 s,72 ℃延伸50 s,20个循环;72 ℃延伸10 min。
1.2.4 高通量测序 第二轮PCR扩增后的产物进行凝胶电泳检测,对目的长度片段(约400 bp)割胶回收,用Qubit 2.0荧光计浓度检测,均量混合不同样品,构建文库,在Illumia Miseq系统上进行高通量测序。
1.2.5 数据处理与分析 下机后的数据参照Xia等[12]的方法,使用QIIME软件[20]进行分析。处理过程如下:切除序列中的barcode序列,对测序序列进行质控和两端拼接,根据切下的8个碱基的barcode序列对样品进行区分,随后进行嵌合体的识别和去除。嵌合体识别参考修改后的铜结合单加氧酶家族(CuMMO)相关的数据库[11],以此数据库数据作为参考序列,对大于250 bp长度核苷酸序列以90%的相似度进行可分类操作单元(OTU)的分类,并用于不同环境样品中不同全程硝化菌的比例分析。去除总序列数小于4条的OTU,选择剩余的每个OTU的代表序列,利用FunGene数据库(http://Fungene.cme.msu.edu)中的FrameBot工具对其进行氨基酸翻译,通过MEGA 5.0软件[21]利用Neighbor-Joining方法构建系统发育树,参考序列选择Jiang等[17]文章中的序列,根据参考序列的分类信息,确定OTU的分类信息。根据理化性质,在CANOCO 5.0中进行冗余分析(RDA),以确定环境参数与全程硝化菌类型之间的相互关系。
2 结果与分析
2.1 全程硝化菌的amoA基因的OTU分类
基于高通量数据分析的结果,共获得79 532个全程硝化菌的amoA基因序列,将获得的amoA基因序列以90%的阈值划分OTU,选择占比大于1%的18个主要OTU,取其代表序列与已知的参考序列,使用Neighbor-Joining方法构建系统发育树[17]。如图1所示,环境样品中的全程硝化菌在系统发育树上可以明显分为clade A.1、clade A.2和clade B。clade A.1单独形成一簇,其bootstrap值为92%;clade A.2单独形成一簇,其bootstrap值为66%;clade A.1和clade A.2聚类为clade A,其bootstrap值为99%,表明clade A.1和clade A.2相对于clade B,其亲缘关系更为接近;clade B单独聚类,bootstrap值为99%。根据系统发育树结果,clade A.1主要以OTU1和OTU3为主,OTU1与之前报道的Candidatusnitrospiranitrosa相接近,OTU3则与scaffold HN-bin3[22]接近,clade A.1的其他几个OTU代表序列则与Candidatusnitrospiranitrificans接近。全程硝化菌clade A.2主要以OTU2、OTU4和OTU5为主,在系统发育树上都与scaffold HN-bin1[22]接近,全程硝化菌cladeB类型在系统发育树上只有1个OUT17(1.10%),占比较低。
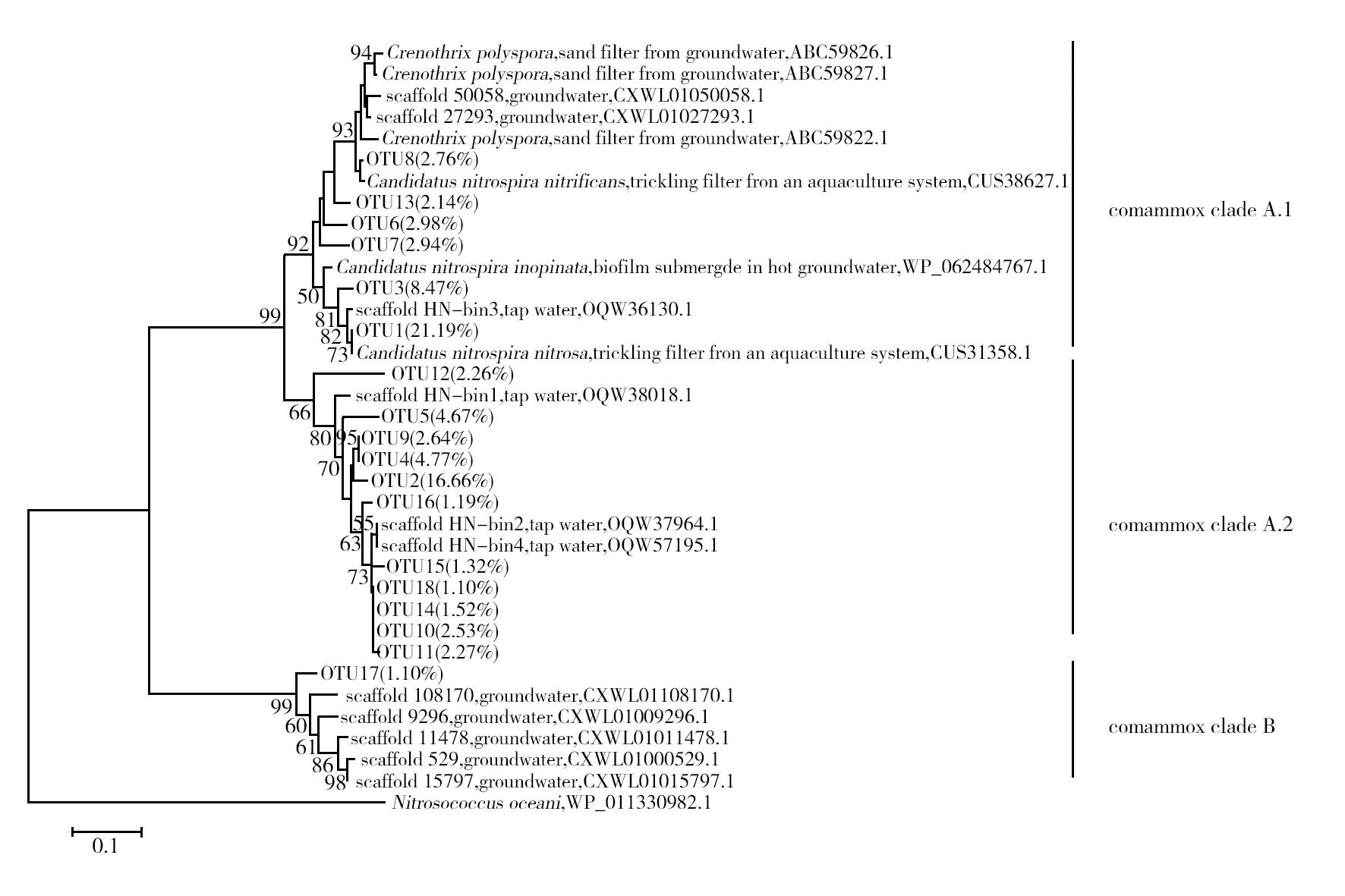
图1 全程硝化菌amoA基因的系统发育树Fig.1 Phylogenetic analysis of the comammox amoA geneOTU后括号中的百分比值表示每个OTU在所有样品的全程硝化菌amoA基因序列中所占比例。系统发育树中仅显示占比大于1%的18个主要OTU的代表序列,节点附近只显示> 50%的bootstrap值Percents in brackets of the operational taxono mic units (OTUs) indicate the proportion of each OTU in the representative comammox amoA gene sequences. Only 18 OTUs with a ratio greater than 1% of the total comammox amoA gene sequences are shown in the phylogenetic tree. Only>50% bootstrap values are displayed near the nodes
不同样品中OTU的分布比例如图2所示,选择占比大于1%的主要OTU进行分析,结果表明,在不同季节及深度的沉积物样品中, clade A的比例明显高于clade B。其中clade A.1和clade A.2的分布比例随季节及深度的变化而变化,OTU1作为clade A.1主要的OTU,除夏季表层(Su0,0~1 cm)样品以外,在其余季节和不同深度样品中均占主导。属于clade A.1的OTU7则在冬季浅表层(W1,1~5 cm)、春季深层(Sp5,5~10 cm)和夏季表层(Su0,0~1 cm)沉积物中有所分布。OTU7在夏季表层(Su0,0~1 cm)沉积物中分布最多,占该沉积物样品中所有amoA序列的31.97%。整体而言,clade A.1在夏季各沉积物样品中比例最高。
OTU2和OTU4作为clade A.2主要的OTU,OTU2在夏季浅表层(Su1, 1~5 cm)沉积物中的比例明显高于其他沉积物样品,而在夏季表层(Su0,0~1 cm)沉积物中比例相对偏低,OTU4则与其相反。整体而言,clade A.2在夏季沉积物样品中比例偏低,但在冬季浅表层沉积物(W1,1~5 cm)样品中比例最低,秋季深层沉积物(A5,5~10 cm)样品中比例次之。
不同季节及深度的沉积物样品中,全程硝化菌clade B比例很低,只有OTU17是clade B的主要OTU,OTU17在冬季各沉积物样品中比例最高,并随着“冬-秋-春-夏”季节变化其所占比例逐渐降低,冬季浅层(W0,0~1 cm)沉积物中OTU17的比例略高于浅表层和深层沉积物。
2.2 滩涂沉积物中全程硝化菌的分布
基于不同季节和不同深度的沉积物样品中获得的所有amoA基因序列形成柱状图,全程硝化菌不同类型的分布如图3所示,全程硝化菌clade A.1在冬季浅表层沉积物(W1,1~5 cm)中分布最多,占比61.94%;在春秋两季深层沉积物(5~10 cm)和夏季所有沉积物样品中比例均高于clade A.2和clade B;在浅表层沉积物(1~5 cm)中,冬夏两季clade A.1比例较高;在深层沉积物(5~10 cm)样品中,春秋两季clade A.1比例偏高,clade A.2则与其相反。
全程硝化菌clade B存在于秋冬两季沉积物中,在两季的不同深度沉积物中,clade B的比例有所差异。clade B在秋季浅表层和冬季浅层沉积物中比例偏高。
2.3 滩涂沉积物中全程硝化菌与环境因子的相关性研究
从测序结果中抽取全程硝化菌的序列,通过RDA分析研究全程硝化菌与各种环境因素的相关性。如图4所示,夏季沉积物样品都聚类在RDA图右上方,其余三季表层沉积物(0~1 cm)样品分布在RDA图下方,浅表层沉积物(1~5 cm)样品聚类在RDA图右下方,深层沉积物(5~10 cm)样品整体上分布在RDA图左上方,表明除夏季以外,全程硝化菌在其余季节不同深度的沉积物中的群落组成较为接近。RDA图显示了铵浓度、硝酸盐浓度、pH、总碳含量(TC)和总氮含量(TN)与不同季节和沉积物及其深度的全程硝化菌的群落结构相关性。夏季所有沉积物样品中全程硝化菌与总碳含量(TC)呈负相关,除夏季沉积物样品外,铵浓度与其余三季浅表层沉积物(1~5 cm)样品中全程硝化菌的群落呈负相关,硝酸盐浓度和pH与其余三季表层沉积物(0~1 cm)样品中全程硝化菌的群落呈负相关,而总氮含量(TN)则与其余三季深层沉积物(5~10 cm)全程硝化菌群落呈负相关。

图2 全程硝化菌amoA基因的代表性OTU在四个季节不同深度的沉积物中的分布Fig.2 Distribution of the representative operational taxonomic units (OTUs) of the comammox amoA gene in sediments of different depths in four seasons W、 Sp、 Su和 A分别代表冬、春、夏、秋四个季节;0、1和5分别代表沉积物的不同深度(分别为0~1、1~5和5~10 cm);该图仅显示占比大于1%的全程硝化菌amoA基因序列的代表性OTUW,Sp,Su and A represent the four seasons of winter, spring, summer and autumn, respectively;0, 1 and 5 represent the different depths of the sediments (0-1, 1-5 and 5-10 cm respectively); This figure only shows representative OTUs of the comammox amoA gene sequence with a ratio greater than 1%
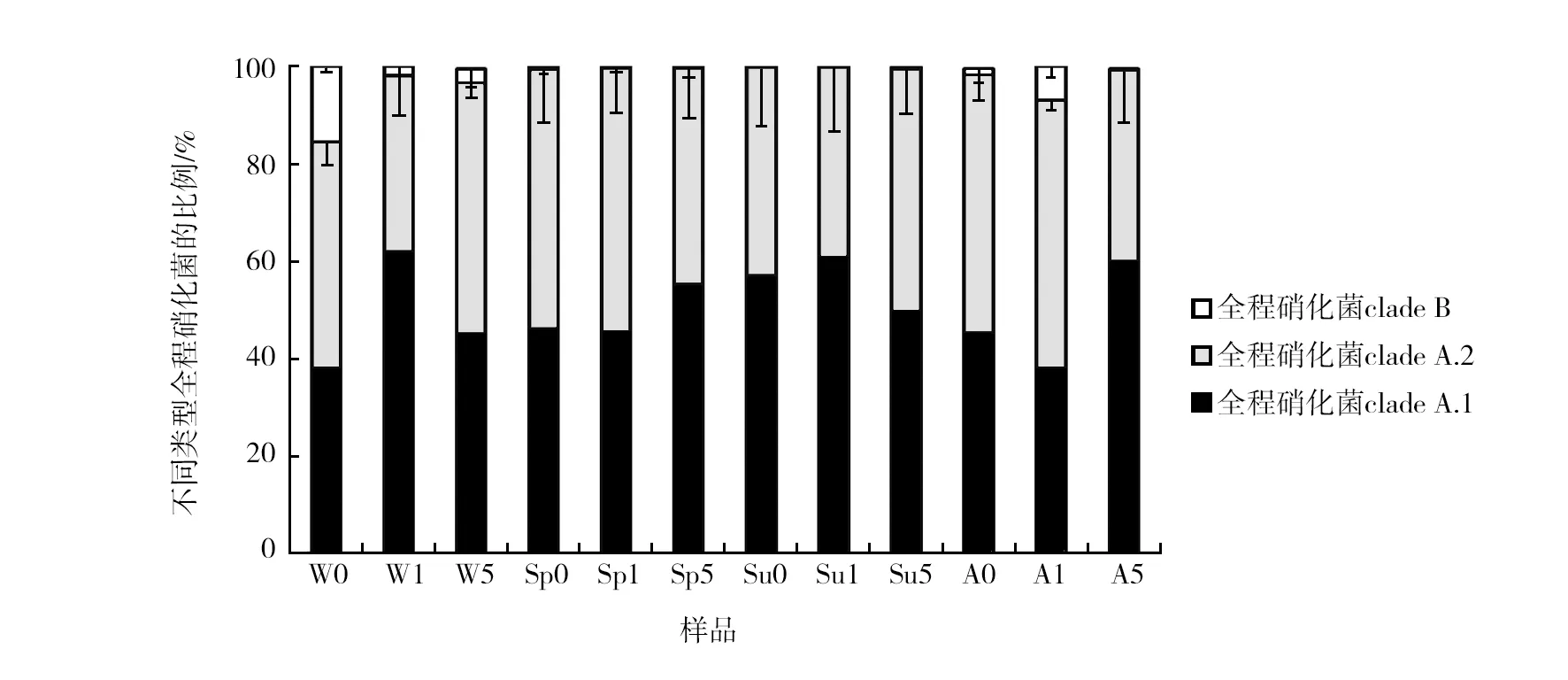
图3 四个季节不同深度的沉积物全程硝化菌的分布Fig.3 Distribution of the comammox in sediments at different depths in four seasons样品名称缩写参考图2,负误差线表示标准偏差(n=3)Refer to figure 2 for abbreviations of samples,negative error bars indicate the standard deviation (n=3)

图4 不同季节和深度的沉积物样品中全程硝化菌比例的RDA分析Fig.4 RDA analysis of the proportion of comammox in sediments from different seasons and depths样品名称缩写参考图2Refer to figure 2 for abbreviations of sample names
3 讨 论
全程硝化菌在不同的环境中广泛分布。在滩涂生态系统中,全程硝化菌不同类型的分布特点有利于进一步认识滩涂沉积物的氮循环过程。通过部分巢式PCR扩增的方法,检测到长江河口崇明东滩滩涂湿地沉积物中存在的不同类型的全程硝化菌,根据高通量测序结果以及系统发育树分析,发现不同类型的全程硝化菌的分布随不同季节及沉积物不同深度的变化而变化。
Jiang等[17]的研究表明,用高简并引物两步PCR方法可以扩增环境样品中的全程硝化菌amoA序列,但其局限在于设计的引物不能覆盖全程硝化菌clade B类型。本研究利用部分巢式PCR扩增方法[12],可以同时覆盖全程硝化菌的clade A和clade B两个分枝,有利于全面分析全程硝化菌在滩涂湿地的分布。在不同的环境中,全程硝化菌 clade A.1和clade A.2的比例不同。有研究报道全程硝化菌 clade A.1在潮滩沉积物、活性污泥、厌氧污泥和沿海水样中占主导地位,而clade A.2在煤矿土壤和自来水样本中占主导地位[12],clade B则在水稻田土壤及森林土壤中占比更高[23]。根据部分巢式PCR数据构建系统发育树,发现滩涂沉积物中全程硝化菌clade A占主导地位,clade B只占小部分比例,这个结果也进一步说明,在滩涂生态系统中,全程硝化菌clade A可能是主要的贡献者。
不同季节对全程硝化菌群落组成存在较大影响。在夏季样品中,全程硝化菌clade A.1比例高于clade A.2,而clade B则出现在秋冬两季沉积物样品中。推测不同季节的温度可能是影响不同类型全程硝化菌分布的原因之一,而clade B相比于clade A可能更适合于低温环境,clade A.1相比于clade A.2更适合于较高温度。除季节外,沉积物深度也影响滩涂生态系统内氨氧化微生物的群落结构[24],冬夏两季沉积物样品中,在浅表层沉积物(1~5 cm)样品中clade A.1比例明显高于clade A.2,但在深层沉积物(5~10 cm)样品中,clade A.2比例则明显高于clade A.1。随着沉积物深度增加溶氧会急剧下降[25-26],因此,相比于clade A.1, clade A.2可能更适合于低氧环境。
RDA数据显示了全程硝化菌群落结构与环境因子的相关性。沉积物中氨的分布特性对全程硝化菌的群落结构多样性具有重要作用[27-28]。总氮含量(TN)、pH和硝酸盐对全程硝化菌的生长也存在一定的相关性。相比于clade A.1, clade A.2与铵浓度呈负相关,表明clade A.2更倾向于在低铵浓度条件下生长;全程硝化菌clade B则与TC呈正相关,与硝酸盐浓度呈负相关;pH对陆地环境中氨氧化菌分布及其生长活性具有重要影响[29-31],本研究发现,全程硝化菌clade B与pH呈负相关,夏季滩涂沉积物中pH值较高,因此,除了温度,高pH值也可能是导致全程硝化菌clade B的比例降低的原因。
本研究通过部分巢式PCR扩增的方法研究滩涂样品中全程硝化菌的群落结构及其生态分布,了解季节和沉积物深度对不同类型全程硝化菌的影响,由于研究中样品数量有限且未检测微生物硝化活性,所以对于了解滩涂生态系统中影响全程硝化菌分布的因素,还存在一定的局限。为了解全程硝化菌在环境中的分布以及对其在不同滩涂生态系统中多样性的分析,还需要通过更广泛的滩涂样品,找出不同类型全程硝化菌的分布规律并进一步研究不同类型的全程硝化菌在滩涂系统中的贡献度。

