某院4株携带Ⅰ类整合酶基因的铜绿假单胞菌对碳青霉烯类抗菌药物的耐药机制研究*
何 蕾,阴 晴,周亚玲,吴 瑶
(江苏大学附属医院检验科,江苏镇江 212001)
铜绿假单胞菌(PA)是一种非发酵型革兰阴性杆菌,也是引起医院内获得性感染的主要条件致病菌之一,广泛分布于自然环境和医疗环境中。近年来,随着新型广谱β-内酰胺类抗菌药物在临床中的广泛使用,PA在抗菌药物的选择性压力下其耐药性发展迅速,多重耐药株及泛耐药株分离率逐年提高。目前β-内酰胺类、氨基糖苷类及喹诺酮类药物仍是治疗PA感染主要药物,其中碳青霉烯类抗菌药物在治疗革兰阴性杆菌感染中疗效显著,但由于PA对碳青霉烯类抗菌药物的耐药性上升迅速,其治疗效果并不令人满意,常导致临床出现无药可用的状况。PA的耐药机制复杂,主要有可移动性基因元件、β-内酰胺酶的水解作用、主动外排泵的高表达、外膜通透性降低及生物膜的形成等[1-3]。其中可移动性基因元件中的整合子具有强大的耐药基因捕获能力,在耐药基因的传播中起到至关重要的作用。通常情况下,PA耐药的形成是多种机制共同作用的结果。本研究选取本院4株不同耐药程度且携带Ⅰ类整合酶基因(IntⅠ)的PA菌株开展研究,分析4株IntⅠ阳性菌株的耐药机制之间的相互作用,为临床合理用药及控制院内感染提供依据。
1 资料与方法
1.1菌株 4株IntⅠ阳性的PA分离自江苏大学附属医院微生物室,编号为PA01和PA02是亚胺培南(IMP)耐药PA(IRPA),PA03和PA04是IMP敏感PA(ISPA)。标准质控菌株PA ATCC27853和大肠埃希菌ATCC25922购于原卫生部临床检验中心。
1.2主要仪器 VITEK-2 compact全自动微生物鉴定和药敏分析仪购自法国生物梅里埃公司;Real-Time PCR仪、普通PCR扩增仪和凝胶电泳成像分析系统均购自美国Bio-Rad公司;水平电泳套件购自上海天能生物公司;MULTISKAN GO全波长酶标分析仪、低温高速离心机、NanoDrop1000分析仪为美国Termo公司产品;96孔细胞培养板购自德国Eppendorf公司;GRANT-PCH-1干式加热/冷却器购自上海恒奇仪器仪表有限公司;恒温水浴锅购自嘉兴俊思电子有限公司。
1.3主要试剂 血琼脂平购自郑州安图生物公司;胰蛋白胨,酵母干粉购自英国OXOID公司;小量质粒提取试剂盒,胶回收试剂盒购自上海捷瑞生物有限公司;2×qPCR SYBR Green Mix、2×PCR Master Mix、QRT SuperMix for qPCR购自南京Vazyme公司;细菌总RNA快速抽提试剂盒购自上海生工生物公司;异丙醇、氯仿和无水乙醇等均为国产分析纯;DNA Marker购自大连宝生物公司;PCR引物由苏州泓讯生物技术公司合成;琼脂糖粉末购自西班牙Biowest公司;1%结晶紫染液购自珠海贝索公司;头孢他啶(CAZ)粉末1 g购自扬子江药业;IMP粉末500 mg购自杭州默沙东。
1.4方法
1.4.1细菌培养、菌种鉴定及药敏检测 所有菌株的分离和培养严格按照《全国临床检验操作规程(第4版)》操作。采用VITEK-2 compact微生物鉴定及药敏系统配套的鉴定卡及药敏卡对细菌进行鉴定,并检测其对抗菌药物的敏感性。
1.4.2细菌DNA模板的制备 采用煮沸裂解法制备细菌总DNA,操作步骤为从血平板上挑取3~5个菌落接种于300 μL灭菌蒸馏水中并振荡混匀,煮沸10 min以裂解细菌,经12 000 r/min离心10 min后收集上清液即为DNA模板。
1.4.3PA菌最低抑菌浓度(MIC)检测 以LB培养基倍比稀释一系列浓度的CAZ和IMP,96孔细菌培养板每孔加入100 μL不同浓度的CAZ和IMP,同时设置不加抗菌药物的对照组。新鲜菌落以生理盐水调节浓度至0.5 McF,再以LB培养基以1∶1 000比例稀释后每孔加入100 μL,同时设置未加菌的空白对照组,只加入相同体积的LB培养液。每组重复3次。细菌培养板于37 ℃中培养24 h,采用酶标仪读取吸光度600 nm处的数值(A600),当A600≤0.1时认定无细菌生长,记录无细菌生长孔对应的抗菌药物最低浓度。
1.4.4CAZ和IMP诱导细菌IntⅠ mRNA的表达 配制含抗菌药物浓度为10、5、1、0.1、0.01 μg/mL的LB培养基,同时设置不添加抗菌药物对照组。4株PA菌分别接种于上述含不同浓度抗菌药物的培养基,每组重复3管,试验重复3次。于37 ℃振荡培养8 h后,收集菌体,采用上海生工公司RNA快速抽提试剂盒提取细菌总RNA,以南京诺唯赞公司RT SuperMix反转录试剂盒合成cDNA,用于后续qPCR检测。qPCR检测引物参考刘蓉等[4]研究报道合成,qPCR检测体系包括cDNA模板2 μL,上、下游引物各0.4 μL,qPCR Mix预混液10 μL,最终以灭菌蒸馏水补足体系至20 μL。qPCR反应条件为,95 ℃预变性1 min,95 ℃变性30 s,55 ℃退火30 s,反应共40个循环,于退火阶段收集荧光信号。计算平均Ct值,采用2-ΔΔCt法计算获得被测基因的相对表达水平。
1.4.5β-内酰胺酶基因检测 参考闫玉兰[5]研究合成检测引物。PCR反应总体系为25 μL,其中2×PCR预混液 12.5 μL,上、下游引物(10 pmol/L)各0.5 μL,DNA模板2 μL,加灭菌蒸馏水至25 μL。PCR反应程序为94 ℃预变性4 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。通过1.2%琼脂糖凝胶检测PCR产物,并照相记录结果。
1.4.6主动外排泵和外膜蛋白基因检测 参考文献[5-6]合成外排泵和外膜蛋白引物。PCR反应总体系同1.4.5,PCR反应程序为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。通过1.2%琼脂糖凝胶检测PCR产物,并照相记录结果。参照1.4.4对OprM、OprD2进行qPCR检测。见表1。
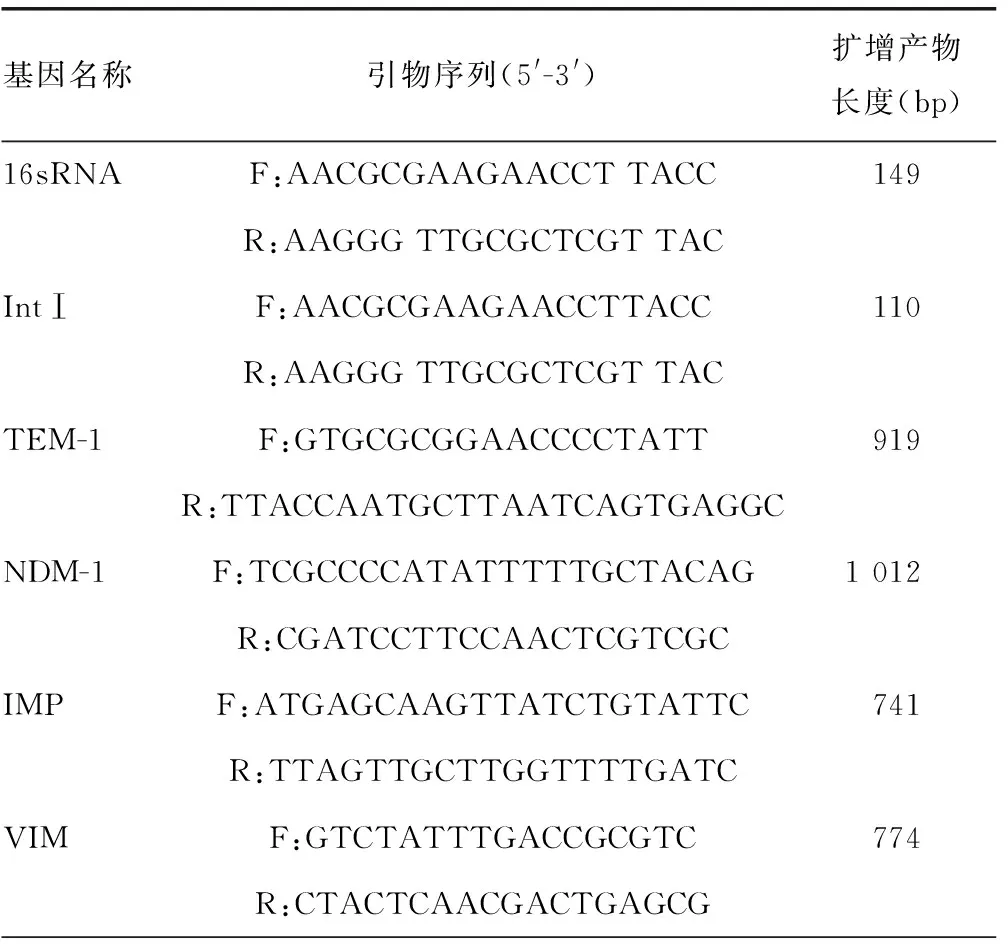
表1 目的基因引物序列

续表1 目的基因引物序列
1.4.7生物膜形成能力检测 采用结晶紫染色法体外检测PA生物膜形成能力。取出冻存的PA菌种接种于血平板上,35 ℃培养18 h,挑取单个菌落于无菌生理盐水中,调节比浊度为1 McF的菌悬液,在96孔板,每孔加入10 μL菌液和200 μL的LB培养液,每株菌做3个平行对照,同时设置阴性对照,35 ℃置于湿盒中连续培养48 h。48 h后取出96孔板,吸弃板内培养液,用磷酸盐缓冲液洗涤3次去除黏附菌(使用棉签将各孔外壁的结晶紫小心擦尽),每孔加入固定液(甲醇)200 μL固定20 min;固定完毕后,再用磷酸盐缓冲液洗涤2次;晾干后各孔加入200 μL 1%结晶紫染液,室温下染色10 min。染色完毕后蒸馏水洗涤2次,晾干,最后各孔加入95%乙醇200 μL,充分溶解。酶标仪读取570 nm处的吸光度值(A570)。试验菌株吸光度值大于阴性对照孔即为生物膜形成阳性。
1.5统计学处理 使用SPSS25.0统计学软件,采用one-way ANOVA及LSD-t检验分析一系列抗菌药物浓度下PA的IntⅠ的相对表达水平,采用独立样本t检验分析OprM、OprD2及生物膜在不同组间的差异。以上统计方法均以P<0.05为差异有统计学意义。
2 结 果
2.1CAZ、IMP的MIC检测结果 CAZ对PA01、PA02、PA03、PA04的MIC分别是64、64、2、4 μg/mL;IMP对PA01、PA02、PA03、PA04的MIC分别是16、16、0.5、0.5 μg/mL。
2.2PA在不同浓度CAZ、IMP诱导下IntⅠ mRNA的相对表达水平 PA01、PA02在CAZ(10 μg/mL)、IMP(10 μg/mL,5 μg/mL)培养基中,细菌生长受到抑制;PA03、PA04在CAZ(10 μg/mL,5 μg/mL)、IMP(10 μg/mL,5 μg/mL)培养基中,细菌生长受到抑制,故弃之不用。图1显示:PA01、PA02、PA04菌株的IntⅠ mRNA的相对表达水平均较对照组高(P<0.05),并且PA01、PA02的IntⅠ mRNA相对表达水平高于PA04;组间两两比较,差异均有统计学意义(P<0.05),并且在一定浓度范围内,IntⅠ的mRNA相对表达水平随着培养液中抗菌药物的浓度增加而呈上升趋势。但是PA03菌株的IntⅠ的mRNA相对表达水平比PA01、PA02、PA04低,且组间比较差异无统计学意义(P>0.05)。
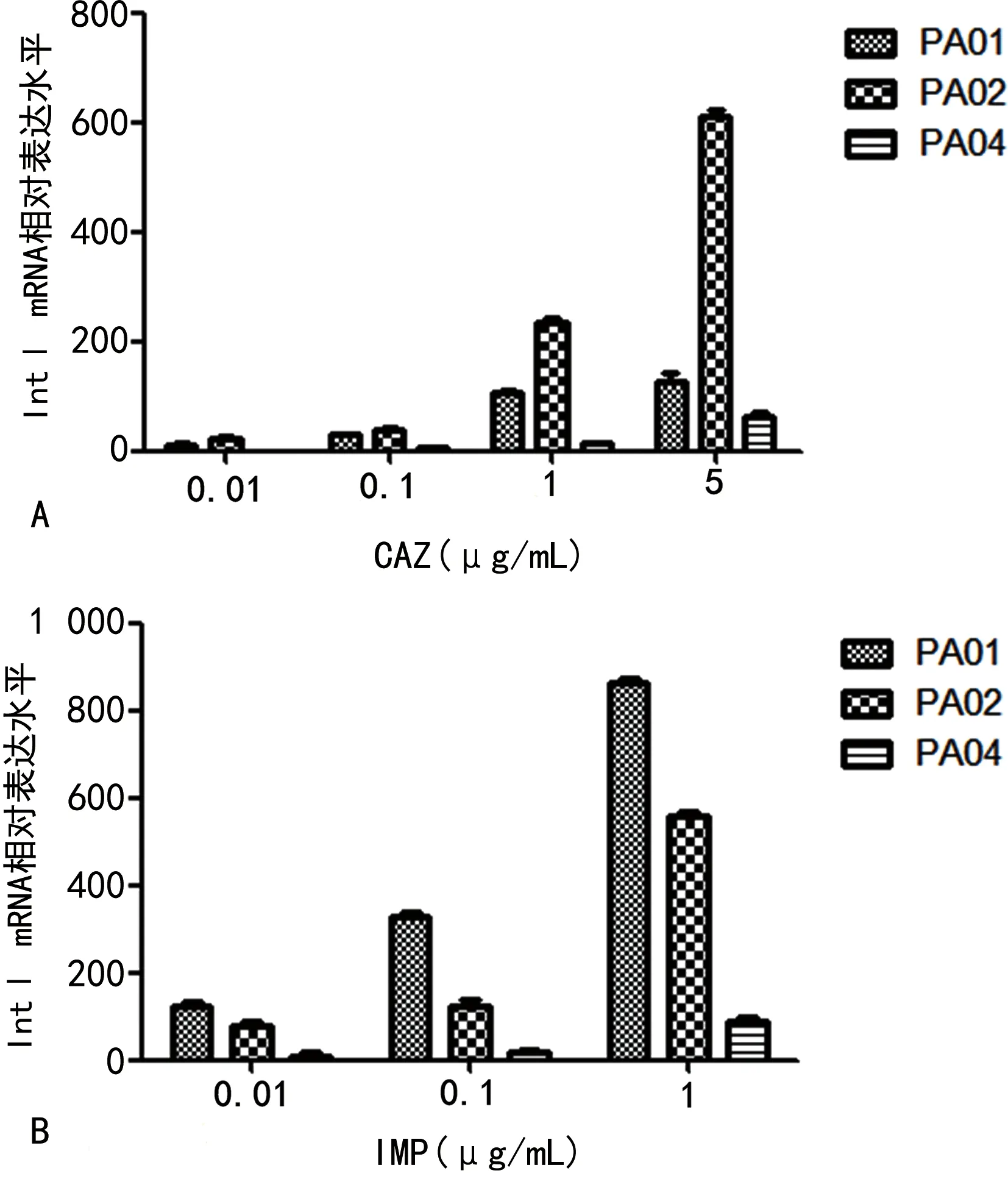
注:A为CAZ诱导下PA IntⅠ mRNA的相对表达水平;B为IMP诱导下PA IntⅠ mRNA的相对表达水平。
2.3PA的β-内酰胺类酶检测结果 PA01、PA02检测到blaTEM,所有菌株未检测到blaNDM-1、blaVIM和blaIMP。见图2。
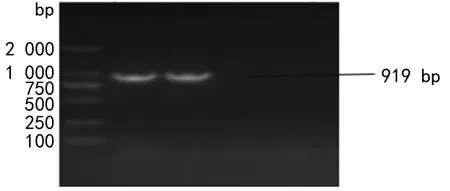
图2 PA TEM基因扩增电泳图
2.4PA的外排泵及外膜蛋白检测结果 外排泵的PCR结果显示PA01、PA02的MexA、MexB、OprM均阳性,PA03、PA04的MexA、MexB阳性,OprM阴性,并且PA01、PA02的外排基因OprM的mRNA相对表达水平是PA03、PA04的519倍,差异有统计学意义(P<0.05),见图3。4株PA的外膜蛋白基因OprD2均为阳性,并且PA01、PA02的OprD2的mRNA相对表达水平低于PA03、PA04,差异有统计学意义(P<0.05),见图4。
2.5生物膜形成能力体外测定结果 4株PA的生物膜形成能力均为阳性,分别为:0.20±0.02、0.32±0.05、3.81±0.12、0.85±0.03,结果显示PA01、PA02的生物膜形成能力弱于PA03、PA04,且PA03菌株的生物膜形成能力最强,差异有统计学意义(P<0.05)。
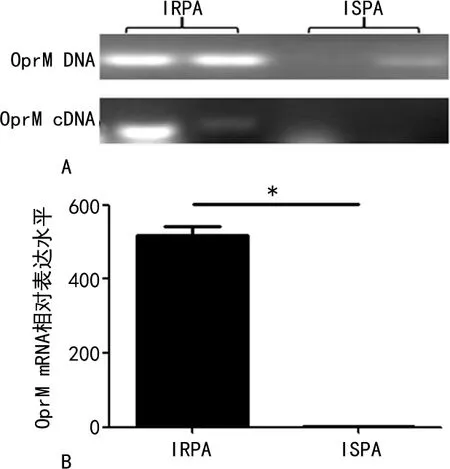
注:A为PA主动外排基因扩增电泳图;B为PA主动外排基因OprM mRNA的相对表达水平与细菌耐药的关系。IRPA(PA01、PA02)与ISPA(PA03、PA04)比较,*P<0.05。
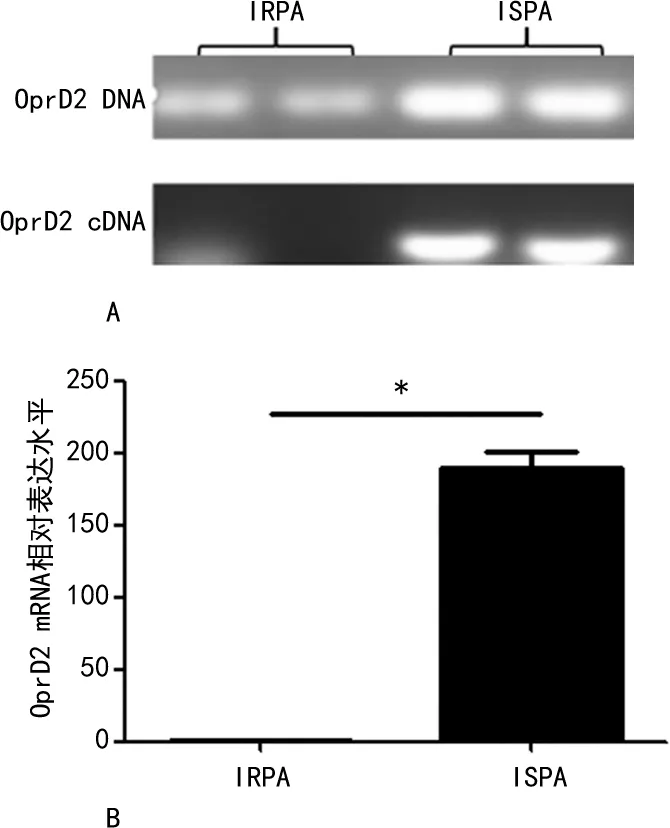
注:A为PA外膜蛋白基因扩增电泳图;B为PA外膜蛋白基因OprD2 mRNA相对表达水平与细菌耐药的关系。IRPA(PA01、PA02)与ISPA(PA03、PA04)比较,*P<0.05。
3 讨 论
近年来,随着广谱抗菌药物的广泛应用,PA在抗菌药物的选择性压力下,多重耐药菌株不断增加,甚至出现泛耐药菌株,但是其耐药的形成并非单一耐药机制介导,而是多种耐药机制相互作用结果,给临床的抗感染治疗带来了难题,应引起广泛重视[7]。
整合子是细菌重要的可移动性元件,通过位点特异性重组捕获外源耐药基因使之表达并在不同菌株之间广泛传播[8]。本研究主要探讨CAZ、IMP的不同浓度对PA菌株IntⅠ表达的影响,结果显示PA01、PA02、PA04菌株在CAZ、IMP的诱导下,随着抗菌药物浓度的升高,IntⅠ mRNA相对表达水平上升,且IRPA IntⅠ mRNA的相对表达水平更高,进一步说明IntⅠ基因在抗菌药物的压力下,会上调其表达,从而提高整合酶对耐药基因的捕获概率,有利于细菌多重耐药的形成,这与GUERIN[9]等的研究报道相符。但是PA03菌株的IntⅠ mRNA在抗菌药物诱导下,相对表达水平较低,且无统计学意义,考虑菌株个体差异或者该菌株的耐药并非是由整合子介导的,可能由其他耐药机制介导,将在后面进一步阐述。
PA中对抗菌药物有水解作用的β-内酰胺酶按Ambler结构分类分成A、B、C、D 4类。其中A类酶包括质粒介导的TEM、KPC-1酶和GES-2酶;B类酶主要是金属酶包括IMP、VIM、SPM、GIM、NDM-1型,C类酶主要是染色体编码的AmpC酶;D类酶大部分是苯唑西林水解酶,即OXA型-1[10-11]。本研究中,PA01、PA02检测到blaTEM,其余β-内酰胺酶(blaNDM-1、blaVIM、blaIMP)均未检测到,说明产酶因素在本院PA对碳青霉烯类药物耐药中的作用并不是主要的。
主动外排系统在PA耐药中起到重要作用,多药外排的存在可能是导致PA多重耐药形成的主要机制。MexAB-OprM是第一个发现的外排系统,也是PA对碳青霉烯类抗菌药物耐药最主要的外排系统[12]。有文献[13]报道MexAB-OprM外排泵由MexA、MexB和OprM 3种蛋白组成,操纵子MexO同时编码这3种蛋白,因此可利用定量检测其中一个基因的mRNA转录水平来反映外排泵MexAB-OprM的表达情况。本研究通过反转录外膜蛋白OprM基因的mRNA,观察MexAB-OprM mRNA的相对表达水平,结果显示IRPA菌株外排泵表达水平高于ISPA(P<0.05),表明主动外排的过量表达参与了PA对碳青霉烯类药物耐药的机制。
OprD2是以IMP为代表的碳青霉烯类抗菌药物(美罗培南除外)进入菌体的特异性通道,具有配体特异性,能形成IMP的特异性结合位点[12]。有学者认为PA对碳青霉烯类抗菌药物耐药主要是由于OprD2表达减少甚至缺失引起外膜通透性下降所致[12],也有研究认为单纯OprD2基因缺失仅表现对IMP低水平耐药,总是和其他因素(主动外排系统、β-内酰胺酶)一起作用才对碳青霉烯类药物产生明显耐药[13]。本研究中,IRPA菌株的OprD2 mRNA的相对表达水平低于ISPA菌株(P<0.05),进一步表明IRPA对碳青霉烯类耐药可能是由于外膜蛋白的表达减少,不能使抗菌药物进入细菌体内,从而介导耐药。
生物膜是细菌与其分泌的胞外基质相互粘连形成的具有特定结构和功能的细胞群体[14]。生物膜一旦形成,抗菌药物难以渗透入细胞膜内,无法发挥抑菌或杀菌作用,表现为细菌对抗菌药物的耐药性增加,所以细菌耐药与生物膜关系密切[15-16]。但是也有研究表明生物膜是细菌为了适应环境而存在的一种方式,与细菌耐药关系不大[14,17]。本研究中,ISPA的生物膜形成能力强于IRPA(P<0.05),且PA03菌株的生物膜形成能力最强,分析原因如下:(1)细菌生物膜形成与耐药性是细菌在恶劣条件下生存的两种能力。ISPA由于耐药率低,会形成更强的生物膜来适应环境的变化,逃避抗菌药物及机体免疫系统的攻击;IRPA一旦形成生物膜,将很难彻底清除,给临床抗感染治疗带来困难;(2)生物膜的体外测定需连续培养48 h,而抗菌药物敏感性试验所需时间为12~16 h(甚至更短),尚不足以形成成熟的生物膜;(3)考虑本试验菌株数量较少,课题组将进一步加大菌株数量来加以验证。
4 结 论
PA01、PA02、PA04的IntⅠ在抗菌药物的选择性压力下表达增强,意味着携带整合子的细菌捕获外源耐药基因的概率大大提高,有利于耐药性迅速形成及耐药范围扩大,严重威胁人类健康,应引起临床广泛重视。此外,IRPA的主动外排表达能力强于ISPA,细胞外膜通透性、生物膜形成能力低于ISPA,故PA01、PA02对碳青霉烯类耐药主要由整合酶基因高表达、外排泵过表达及膜通透性下降介导,与β-内酰胺酶及生物膜形成关系不大。PA03菌株IntⅠ mRNA相对表达水平低,生物膜形成能力最强,考虑其耐药机制主要由生物膜介导。

