ICU和EICU医务人员多重耐药菌定植监测及多指标分析*
田晓波,董宝坤,金 静,耿佳靖,鲁辛辛△
(首都医科大学附属北京同仁医院:1.检验科;2.感控科,北京 100176)
细菌定植是引起自身感染和院内感染的重要原因,重症监护室(ICU)和急诊监护室(EICU)医务人员的多重耐药菌(MDR)定植,已经成为院内感染的主要传播途径。MDR是指对3类或3类以上化学结构不同的抗菌药物耐药的细菌,临床常见的MDR主要是耐碳青霉烯肺炎克雷伯菌(CRKP)、泛耐药的鲍曼不动杆菌(PRAB)、产超广谱β-内酰胺酶(ESBLs)的大肠埃希菌(ESBLs-E.coli)和肺炎克雷伯菌(ESBLs-KP)、耐甲氧西林的金黄色葡萄球菌(MRSA)和溶血葡萄球菌(MRSH)、多重耐药铜绿假单胞菌(MDR-PAE)及多重耐药流感嗜血杆菌(MDR-HIB)等[1]。医务人员作为治疗者,因活动范围广,一旦定植MDR则引起交叉感染的可能性更大。尤其ICU和EICU接收的主要是重症患者,往往有严重的MDR感染,或者在治疗中因长期大量使用广谱抗菌药物而诱导MDR的产生,致使环境中甚至医务人员鼻、咽部及皮肤定植大量MDR[2]。因此定期评估医务人员MDR定植情况及感染率,是预防院内感染的重要措施[3]。鼻前庭和咽部是MDR主要的定植部位,定植菌的判定要依据临床症状、培养结果、胞内寄生,以及白细胞(WBC)、C-反应蛋白(CRP)和降钙素原(PCT)的水平综合判断[4]。
1 资料与方法
1.1一般资料 本院ICU和EICU医务人员设为观察组,非监护室医务人员设为对照组,依据不同细菌感染特点及潜伏期设3个监测时间点分别为初检组、1周复检组和2周复检组[5]。观察组87例医务人员有3例在首检后因发热使用抗菌药物退出监测,最终纳入分析84例,其中医生36例、护士48例,男性23例、女性61例,平均年龄(34.95±5.37)岁;对照组123例医务人员,首检后2例及1周复检后3例出现发热退出监测,最终纳入分析118例,其中医生43例、护士75例,男性26例、女性92例,平均年龄(36.19±5.02)岁。两组性别、年龄差异无统计学意义(P>0.05),具有可比性。所有人员进行鼻、咽部微生物培养。纳入标准:(1)无临床症状且近2周无抗菌药物使用史;(2)体温≤37.0 ℃;(3)在本科室工作半年以上。排除标准:监测前2周内,或监测过程中患病或使用抗菌药物者。
1.2定植菌认定 医务人员经3个时间点监测,鼻、咽部分离出同一MDR,且监测中未出现发热等感染症状,则该MDR可认定为定植菌[5]。
1.3仪器和试剂 血平皿、麦康凯平皿、巧克力平皿、沙保罗平皿和MH 平皿(英国OXOID);基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)仪(美国Bruker)、VITEK-2 Compact微生物分析系统、AST GP67药敏卡、AST GN13药敏卡(法国Biomerieux);KB药敏纸片(英国OXOID)。微生物培养箱(美国赛默飞Lab-Serv);无菌拭子(江苏天力);无菌生理盐水(双鹤药业),BC5390血液分析仪(深圳迈瑞),Cobas e601全自动分析仪(瑞士Roche);革兰染液(珠海贝索)。
1.4方法
1.4.1鼻咽部及对比监测取样 (1)鼻拭子取样:无菌拭子蘸取无菌生理盐水湿润后,经鼻孔依次伸入双侧鼻腔约1 cm处旋转3周。(2)咽拭子取样:无菌拭子蘸取无菌生理盐水湿润后,经口深入咽部在扁桃体周围半径0.5 cm范围内涂抹3周。(3)对比监测取样:无菌拭子蘸取无菌生理盐水湿润后,涂抹颈部皮肤、手背皮肤及接触物品(水杯和手机)分别取样。若至少一份对比监测与鼻、咽拭子分离MDR一致,即佐证定植菌可能性高。取样后1 h内接种于血平皿、麦康凯平皿、巧克力平皿(培养时间18~24 h)和沙保罗平皿(培养时间≥72 h)。取样在感控科人员指导下进行。
1.4.2微生物鉴定和MDR检测 使用MALDI-TOF MS仪对可疑菌落进行鉴定,VITEK-2 Compact和KB纸片行体外抗菌药物敏感性试验(简称药敏试验),判定ESBLs、CRKP、PRAB、MDR-PAE和MRSA等。改良碳青霉烯灭活试验(mCIM)确认耐碳青霉烯酶菌株。质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、肺炎克雷伯菌ATCC700603、鲍曼不动杆菌ATCC19606和金黄色葡萄球菌ATCC25923。
1.4.3WBC、CRP和PCT水平检测 鼻咽部采样后2 h内,采集静脉血2 mL,BC5390血液分析仪检测 WBC和CRP水平,Cobas e601全自动分析仪检测PCT水平;WBC参考区间(3.5~9.5)×109/L,CRP参考区间0~10 mg/L,PCT参考区间0~0.5 ng/mL。
1.4.4胞内菌检测 鼻、咽拭子涂片革兰染色,显微镜下观察WBC吞噬细菌现象,或细菌黏附于WBC上,则感染可能性高;否则为定植可能性高[6]。
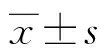
2 结 果
2.1两组医务人员定植菌及多指标检测结果 经3个时间点监测,84例观察组医护人员中最终认定为定植菌感染19例(22.6%),其中鼻前庭定植菌感染14例(16.7%),咽部感染5例(6.0%);118例对照组医护人员最终认定为定植菌感染6例(5.1%),均来源于鼻前庭,两组定植菌构成情况比较差异有统计学意义(P<0.05)。两组定植菌来源比较差异无统计学意义(P>0.05)。见表1、2。
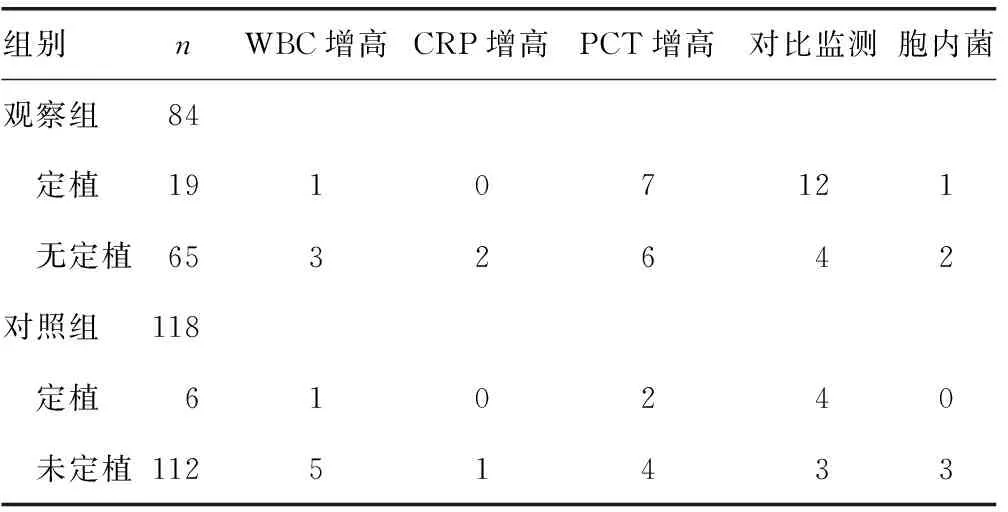
表1 两组医务人员WBC、CRP、PCT水平和对比监测及胞内菌检出情况(n)
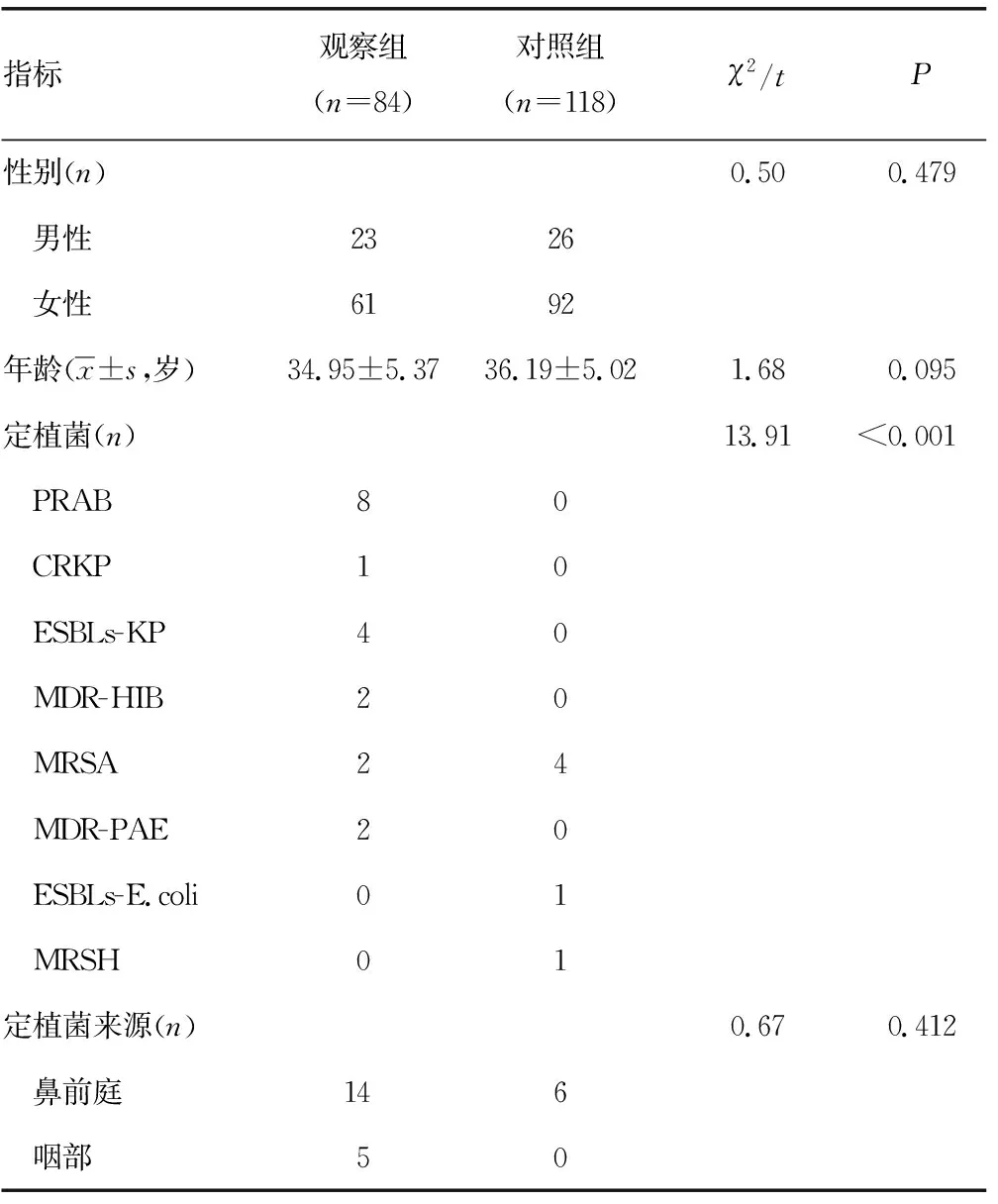
表2 两组医务人员临床资料和定植MDR检出情况比较
2.2两组医务人员WBC、CRP、PCT水平和对比监测结果比较 观察组内定植者与无定植者WBC水平比较差异无统计学意义(P>0.05),CRP、PCT水平比较差异有统计学意义(P<0.05)。对照组内定植者与无定植者WBC、CRP水平比较差异无统计学意义(P>0.05),PCT水平比较差异有统计学意义(P<0.05)。对比监测结果显示,鼻、咽部以外的其他部位监测到同一MDR,两组内定植者与无定植者对比监测结果比较差异均有统计学意义(P<0.05)。观察组与对照组之间比较,WBC水平差异无统计学意义(P>0.05),CRP、PCT水平差异有统计学意义(P<0.05)。见表3。
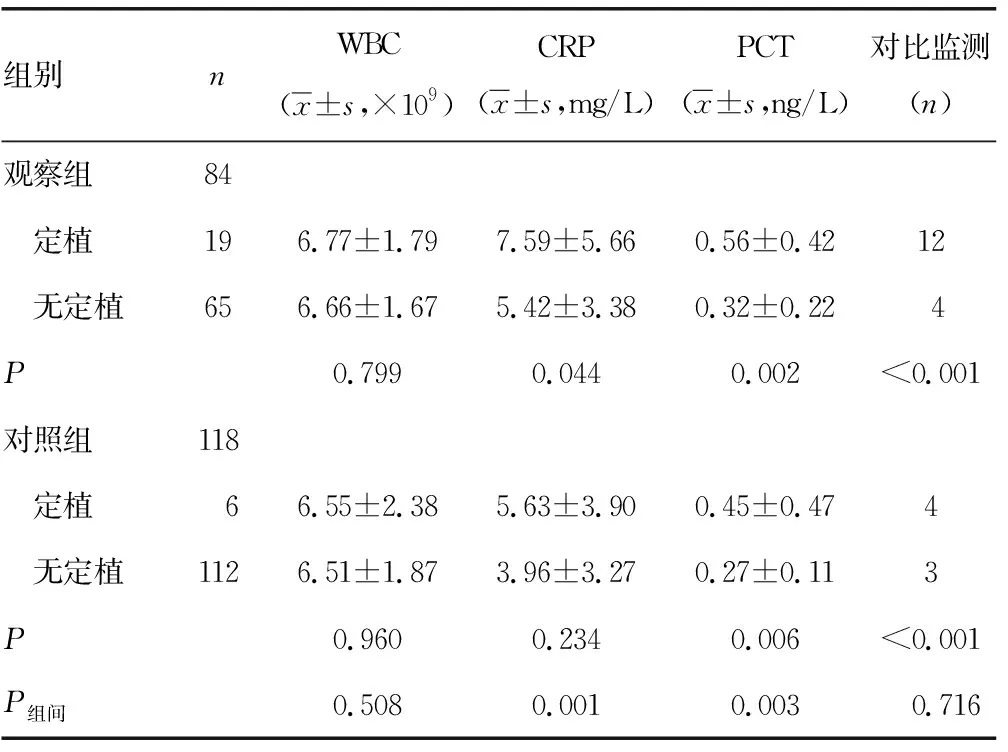
表3 WBC、CRP、PCT水平和对比监测结果比较
2.3两组定植MDR对常用抗菌药物耐药性分析 分离出5株以上的MDR有PRAB(8株)、MRSA(6株)、多重耐药的肺炎克雷伯菌5株(CRKP 1株,ESBLs-KP 4株)。25株MDR中耐3类抗菌药物的共10株,耐4类抗菌药物的共5株,耐5类及以上抗菌药物的共10株。6株MRSA对万古霉素均敏感,对青霉素G和左氧氟沙星的敏感率分别为16.7%(1/6)和66.7%(4/6)。革兰阴性杆菌对常用抗菌药物均表现出高耐药性,8株PRAB对头孢他啶、亚胺培南、左氧氟沙星的敏感率分别为37.5%(3/8)、50.0%(4/8)、25.0%(2/8);分离的5株多重耐药的肺炎克雷伯菌对头孢他啶、亚胺培南、左氧氟沙星的敏感率分别为60.0%(3/5)、80.0%(4/5)、40.0%(2/5)。见表4、5。

表4 定植MDR对常用抗菌药物耐药情况[ n(%)]

表5 分离5株以上定植MDR药敏试验结果(%)
3 讨 论
细菌定植是指细菌在人体与外界相通的部位如呼吸道(主要是鼻咽部)、消化道、泌尿生殖道等处的黏膜表面持续存在并生长,但未对机体产生损害。定植菌判定尚没有统一的标准,一般情况下患者标本培养阳性,但无发热、化脓等感染症状可作为参考标准[7]。临床下呼吸道标本(痰液、肺泡灌洗液等)留取过程中,即使严格漱口无菌留取标本,标本也很容易被上呼吸道其他细菌污染。单纯的实验室微生物鉴定很难区分是定植菌、致病菌或正常菌群,需要多种指标进行综合判定,包括是否出现感染症状、培养结果、胞内寄生,以及WBC、CRP和PCT水平是否异常。涂片革兰染色镜检,见到WBC吞噬细菌现象,或细菌黏附于WBC上,则感染的可能性大,相反则定植的可能性大[6]。本研究中观察组和对照组共202例医务人员,胞内菌仅6例,比例不足3.0%(6/202),而两组共25例定植病例中,胞内菌比例也仅仅4.0%(1/25),可见显微镜观察胞内菌对排除定植菌有一定的参考价值;观察组内定植者与无定植者之间,以及观察组与对照组之间CRP及PCT水平差异有统计学意义(P<0.05),可见监护室医护人员尤其是定植者的CRP及PCT水平高于非监护室医护人员,CRP、PCT水平对判定定植菌有一定的参考价值。从对比监测结果可以看出,观察组和对照组有MDR定植的医务人员中,从人体不同部位及日常接触物品中分离到同一定植菌比例均高于50.0%。本研究从1例非监护室医生的颈部皮肤、手背皮肤、手机和水杯同时分离到MRSA,在抵抗力降低时势必会引起自身感染,在治疗中也将增加患者感染的概率。
人体不同部位对定植菌的判定标准有所不同。无菌体液(血液、脑脊液、胸腔积液和腹水等)中分离到的微生物,首先考虑病原菌;非无菌部位(皮肤、黏膜、肠道、口腔或创面等)分离的微生物,需要同时结合有无临床症状、影像、生化和组织病理依据来综合判定,多倾向于定植菌或正常菌群。鼻前庭和咽部以黏膜为主,是微生物定植的重要场所。鼻前庭是鼻腔前下部较为阔大的部分,内面衬以皮肤,有过滤尘埃、净化空气的作用;咽部是呼吸道中联系鼻腔与喉腔之间的要道,是呼吸道与消化管相交叉的部分。研究鼻、咽部MDR的定植情况,并采用适当的措施预防定植菌扩散及去定植,不仅可以监测和保护医务人员的健康,还能加强院内感染的防控[8]。
目前多数学者研究方向倾向于环境或患者的细菌定植,如呼吸机、各种导管、患者皮肤和呼吸道等,尤其是患者呼吸道定植的研究较多,对于医务人员定植情况研究较少[9-10]。而在医疗机构中,往往是医务人员活动范围更广,在进行侵入性诊断和治疗过程中更容易引起定植菌入侵患者机体,造成患者局部或全身性感染,引起定植菌的院内传播。本研究中,ICU和EICU医务人员MDR定植率(22.6%)明显高于非监护室医务人员(5.1%),与GALLAHER等[11]对患者的研究不同。ICU和EICU医务人员以PRAB定植最多,非监护室医务人员定植菌主要为MRSA,与其他学者对患者定植菌研究类似[12]。MDR感染的重要危险因素是长期应用广谱抗菌药物,定植的MDR一旦引起院内感染,会给治疗带来很大的困难,同时,定植菌也是引起医务人员感染的重要因素[13-14]。
定植菌与正常菌群在耐药性上存在一定差异,正常菌群很少为MDR。流感嗜血杆菌往往寄生于鼻咽部,当机体抵抗力下降或者鼻咽部化脓、创伤或手术时,会引起下呼吸道或者神经系统感染,当无临床症状而分离到MDR-HIB时,应考虑是定植菌,不宜作为正常菌群对待。同样无临床症状者分离出MRSA、ESBLs肠杆菌及碳青霉烯耐药肠杆菌(CRE)等MDR都应考虑定植菌的可能性。本研究分离出多株多重耐药大肠埃希菌和肺炎克雷伯菌,肠杆菌科细菌多为肠道正常菌群,也可出现某些高毒力肠杆菌在肠道内定植的情况,但医务人员肠道定植菌引起院内感染的机会有限,而呼吸道飞沫和气溶胶等途径传播更为突出,故未做肠道内定植菌监测。未监测到真菌定植情况,可能与近期无真菌感染患者有关[15]。
细菌定植增加了治疗的难度,抗菌药物使用过程中应考虑定植菌的存在,避免增加定植菌的耐药性,引起定植菌感染。同时,还要考虑到侵入性治疗引起定植菌播散。对于定植菌是否需要进行干预,医学上有着不同的意见:若对耐药菌定植者进行抗感染治疗,可能会诱导耐药和引起毒性反应;若不干预,可能成为潜在传染源或者引起定植者自身感染。去定植一般通过抗菌药物或者正常菌群移植实现[16],当然多数患者或者医务人员经过长时间的自身调节和免疫力增强,也可自行清除定植菌[17]。然而,若去定植运用不当,会造成菌群失调,同时抗菌药物过度使用也会造成MDR的产生。
4 结 论
ICU和EICU的MDR定植较为严重,WBC、CRP、PCT水平和胞内菌及对比监测可以作为医务人员鼻咽部定植菌判定指标。在今后的研究中,要逐步增加其他部位定植菌的监测,才能更好的保证医务人员、患者和环境的健康。

