等离子体活化水对希瓦氏菌及鲈鱼品质的影响
刘舒彦 李海蓝 李湃 吴迪 吴雨晨 鉏晓艳


摘 要:研究等离子体活化水(plasma-activated water,PAW)对希瓦氏菌及染菌鲈鱼块品质的影响。利用比浊法、平板计数法研究PAW制备时间(0、15、30、45、60 min)对希瓦氏菌生长的抑制作用。根据质构、菌落总数、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量和感官评价指标,研究PAW浸泡时间(0、7.5、15.0、22.5、30.0 min)对染菌鲈鱼块腐败的抑制作用。结果表明:PAW对希瓦氏菌生长的抑制效果明显,其中制备时间60 min组的抑菌率高达99.9%,显著高于其他制备时间组(P<0.05);PAW60浸泡染菌鱼块30 min时,鱼肉菌落总数最低降至(3.01±0.02)(lg(CFU/g)),显著低于其他制备时间组(P<0.05);贮藏5 d时,PAW60处理组鱼肉TVB-N含量明显低于对照组,贮藏2 d时,PAW60组鱼肉的硬度和黏聚性以及感官指标评分与对照组相比均显著提高(P<0.05)。综上,PAW60浸泡处理30 min对希瓦氏菌的抑制作用良好,可降低鱼肉腐败,提高其感官和质构品质。
关键词:加州鲈;等离子体活化水;希瓦氏菌;抑制作用
Abstract: The aim of this study was to investigate the effects of plasma-activated water (PAW) on inhibiting Shewanella growth and on improving the quality of fish meat artificially contaminated with this bacterium. The turbidimetric and plate count methods were used to study the inhibition effect of PAWs prepared at different plasma discharge times (0, 15, 30, 45 and 60 min) on the growth of Shewanella. The inhibitory effect of different PAW immersion times (0, 7.5, 15.0, 22.5 and 30.0 min) on the spoilage of infected fish pieces was studied by monitoring the changes in texture, total number of colonies, total volatile basic nitrogen (TVB-N) content and sensory quality. Results showed that there was an obvious inhibitory effect of PAW on the growth of Shewanella. The inhibition rate of PAW at 60 min of plasma discharge time (PAW60) was up to 99.9%, significantly higher than that of the other groups (P < 0.05), and after being soaked in PAW60 for 30 min, the total number of colonies in fish meat reduced to the lowest value of (3.01 ± 0.02) (lg(CFU/g)), which was significantly lower than that of the other plasma discharge time groups (P < 0.05). After 5 days of storage, the TVB-N content of the PAW60 treatment group was significantly lower than that of the control group (P < 0.05). After 2 days of storage, the hardness, cohesiveness and sensory score of fish meat in the PAW60 group were improved compared with the control group (P < 0.05). In conclusion, PAW60 treatment for 30 min has a good inhibitory effect on Shewanella and can reduce fish meat spoilage and improve its sensory and texture quality.
Keywords: Micropterus salmoides; plasma-activated water; Shewanella; inhibitory effect
DOI:10.7506/rlyj1001-8123-20200805-186
中圖分类号:TS254.4 文献标志码:A 文章编号:1001-8123(2020)09-0025-06
引文格式:
刘舒彦, 李海蓝, 李湃, 等. 等离子活化水对希瓦氏菌及鲈鱼品质的影响[J]. 肉类研究, 2020, 34(9): 25-30. DOI:10.7506/rlyj1001-8123-20200805-186. http://www.rlyj.net.cn
LIU Shuyan, LI Hailan, LI Pai, et al. Effects of plasma-activated water on inhibiting Shewanella and improving the quality of Micropterus salmoides[J]. Meat Research, 2020, 34(9): 25-30. DOI:10.7506/rlyj1001-8123-20200805-186. http://www.rlyj.net.cn
加州鲈(Micropterus salmoides),又称花鲈、赛花、鲈板、四肋鱼等,与黄河鲤鱼、鳜鱼及黑龙江兴凯湖大白鱼并称为“中国四大淡水名鱼”[1]。近年来,鲈鱼养殖业快速发展,产量逐年递增,2019年我国鲈鱼养殖产量已达47.78 万t[2]。鲈鱼因其肉质鲜美,富含必需氨基酸、维生素等营养成分,深受消费者欢迎。鱼肉在冷藏过程中易受腐败微生物的影响,发生变质,其中优势腐败菌是鱼肉贮藏品质好坏的决定性因素[3]。冷藏鲈鱼中的优势腐败菌有希瓦氏菌属和假单胞菌属,其中希瓦氏菌的致腐能力大于假单胞菌[4]。
等离子体活化水(plasma-activated water,PAW)也称为等离子体处理水,是指通过在水中或水表面进行等离子体放电而得到的液体[5]。PAW具有良好的灭菌效果,水中积累的大量活性基团与细胞内活性氧协同作用可能是微生物细胞膜失活的主要原因[6]。在食品工业中,PAW对果蔬杀菌保鲜、细菌生物被膜的失活、肉制品的杀菌保鲜护色等均具有一定作用[7]。采用PAW处理方法可以有效降低马铃薯表面的微生物数量[8],有效抑制染菌三文鱼片表面单增李斯特菌生长并减缓总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量和pH值上升[9]。以上研究表明,PAW为农产品保鲜提供了一种新型绿色杀菌方式,对产业应用具有一定的参考和指导作用,但PAW在鲈鱼中的应用文献报道还很少。
本研究以鲈鱼肉为研究对象,通过研究PAW的物理性质,测定鱼肉菌落总数、TVB-N含量、质构特性和感官评价指标等,综合评价PAW对希瓦氏菌的抑制效果及对鲈鱼肉品质的影响,为PAW在鲈鱼保鲜中的应用提供技术支撑。
1 材料与方法
1.1 材料与试剂
鲈鱼购买于武汉市洪山区武商量贩(农科城店)。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基和马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基 青岛高科技工业园海博生物技术有限公司;无水乙醇、氯化钠、氢氧化钠、盐酸、无水碳酸钠、硼酸、硫酸铜、硫酸、酚酞、甲基红、溴甲酚绿、高氯酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FSH-2A可调高速均质机 常州越新仪器制造有限公司;3K-15冷冻离心机 德国希格玛实验室离心机公司;SW-CJ-K超净工作台 苏州华宏净化技术有限公司;JBQ-ZD全温振荡器 常州普天仪器制造有限公司;PG-3000等离子液体处理发生器 南京苏曼等离子科技有限公司;CRH-150生化培养箱 上海一恒科技有限公司;UH5300分光光度计 日本日立仪器有限公司;TA.XT Plus质构仪 英国SMS公司;JY/YP电子天平 上海舜宇恒平科学仪器有限公司;PB-10 pH计 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 PAW的制备
选取低温等离子体实验装置上数字0、1、3、5不同的电源档位(对应的功率分别为0、0.56、0.90、1.18 kW)处理娃哈哈纯净水,制备PAW。制备过程中每5 min测定1 次PAW的温度和pH值,共测定1 h,每次平行测定3 次,结果取平均值。根据测定结果确定PAW的最佳制备功率。
1.3.2 PAW对希瓦氏菌的影响
1.3.2.1 希瓦氏菌的培养
挑取1 环希瓦氏菌于7.5 mL无菌生理盐水试管中,用涡旋仪振荡混匀,取0.1 mL该菌液涂布于PDA平板上,37 ℃培养箱培养15~18 h。
1.3.2.2 原始菌液的制备
挑取1 环PDA平板上的菌落到7.5 mL PDB培养基中,37 ℃培养箱培养15~18 h后即为原始菌液。将该菌液进行梯度稀释,选取10-5、10-6、10-7 3 个梯度进行平板计数。
1.3.2.3 PAW对希瓦氏菌菌落生长的影响
在PAW最佳制备功率下,设置5 个放电时间:0、15、30、45、60 min(所得PAW分别记为PAW0、PAW15、PAW30、PAW45、PAW60)。吸取0.5 mL原始菌液与2 mL上述不同放电时间(即制备时间)PAW于10 mL离心管中,混合均匀。再吸取0.1 mL混合液至PDA平板,37 ℃培养箱培养18 h,观察菌落生长情况,拍照并计数[10]。
1.3.2.4 PAW制备时间对希瓦氏菌的抑制效果
將PDB液体培养基分装为50 mL/瓶,灭菌,按体积比1∶1分别加入PAW0、PAW15、PAW30、PAW45、PAW60后摇匀,再加入3 mL原始菌液,置于转速为90 r/min的恒温摇床上37 ℃培养18 h。观察是否有明显浑浊,在波长为410 nm条件下用分光光度计测定菌液的吸光度,并按式(1)计算抑菌率[11]。空白管为体积比1∶1的无菌PDB培养基和PAW。
式中:At为希瓦氏菌经不同制备时间PAW培养18 h后的吸光度;A0为空白管培养18 h后的吸光度。
1.3.3 PAW对鱼肉希瓦氏菌的抑制效果
将新鲜鲈鱼背部肌肉切成2 cm×2 cm×2 cm块状,分装入袋,4 kGy条件下辐照杀菌,放入4 ℃冰箱冷藏,待用。将希瓦氏菌原始菌液分装到50 mL离心管,5 000 r/min、4 ℃离心10 min,取沉淀,用生理盐水制成菌液,控制其菌体浓度为107 CFU/mL。把预处理后的鱼块(n=72)分批置于1 000 mL菌液中浸泡3 min,取出沥干,再分别放入PAW0、PAW15、PAW30、PAW45、PAW60中分别浸泡0、7.5、15.0、22.5、30.0 min。取出经PAW处理后的鱼块,沥干至不滴水状态,放入无菌袋中用10 mL生理盐水洗脱菌落,所得洗液梯度稀释至10-3,取0.1 mL涂布平板,放置于37 ℃培养箱培养18 h后观察菌落生长趋势,拍照并计数,确定最适的PAW浸泡时间[10]。菌落总数测定参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[12]。
1.3.4 PAW对染菌鱼块品质指标的影响
染菌鱼块的前处理同1.3.3节,PAW最适浸泡时间处理后进行加速腐败实验[13-14]。鱼块37 ℃贮藏0、1、2、3、4、5 d后,分别测定TVB-N含量、质构和感官指标。未经PAW处理的染菌鱼块作为对照组。
1.3.4.1 TVB-N含量测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[15],取鱼肉10 g,烧杯中加入0.6 mol/L高氯酸溶液90 mL,用均质机均质,装入50 mL离心管中,5 000 r/min、4 ℃离心10 min,用滤纸过滤取滤液备用。吸收瓶中加入10 mL 30 g/L硼酸,滴入5 滴甲基红-溴甲酚绿混合指示剂。反应室加入5 mL滤液、5 mL 30 g/L NaOH和2 滴酚酞指示剂,加水密封。吸收液用0.01 mol/L标准盐酸溶液滴定至淡粉色。同时做试剂空白,TVB-N含量按式(2)计算。
式中:V1为样品消耗盐酸体积/mL;V2为空白组消耗盐酸体积/mL;m为样品质量/g;c为盐酸浓度/(mol/L)。
1.3.4.2 质构测定
对鲈鱼块进行质地剖面分析,质构仪设定参数为:探头P/36R,测前、测中、测后速率均为1.00 mm/s,下压距离6 mm,触发力5 g,每个样品平行测定3 次。选取硬度、黏聚性、弹性、咀嚼性4 个指标进行分析。
1.3.4.3 感官评价
参照Barbosa等[16]的方法,依据鱼肉的色泽、气味、肌肉纹理和组织弹性进行感官评定,评定人员由6 名经过专门训练的人员组成,具体评定标准如表1所示。采用加权评分法,各指标的平均分乘以其权重后相加之和为总评分值,低于5 分则视为不可接受。
1.4 数据处理
采用Microsoft Excel 2010和SPSS 18.0软件进行数据处理和统计,结果以平均值±标准差表示。运用单因素方差分析的Duncans程序进行数据差异显著性分析,显著性水平α=0.05。
2 结果与分析
2.1 制备时间对PAW pH值和温度的影响
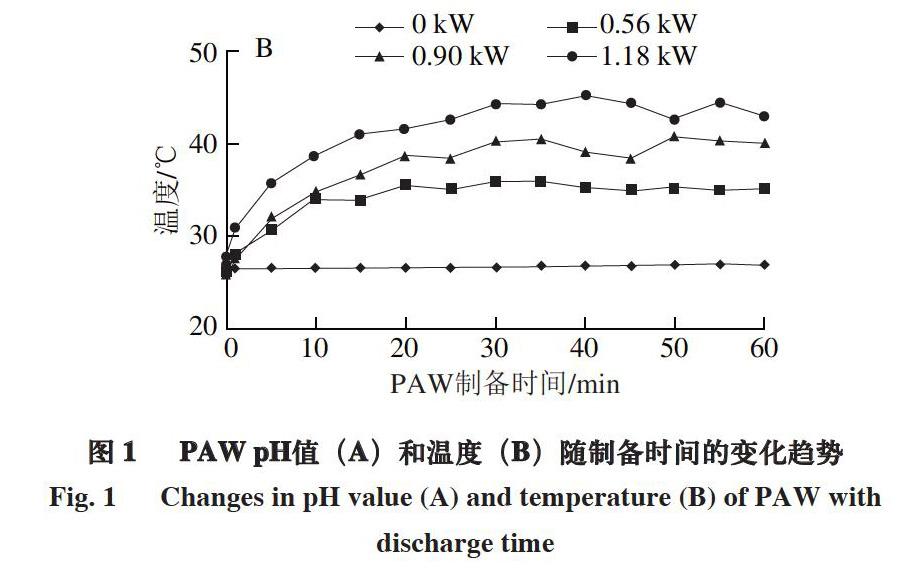
由圖1可知,功率越高,放电时间(即制备时间)越长,PAW的pH值越低。放电5 min时1.18 kW组pH值急剧下降至3.21±0.52,60 min时降至最低点2.04±0.33。原因可能是功率越高,放电时间越长,PAW的电离程度越强,溶液中含有的氢离子、酸根离子等越多,导致pH值越低[17]。
实验过程中对照组PAW温度保持在(26.6±0.4) ℃;不同功率制备的PAW温度在前20 min急剧上升,40~60 min时,各组均达到最高温度,其中1.18 kW组温度超过仪器使用上限40 ℃。考虑最佳灭菌效果和仪器使用上限,选择功率0.90 kW制备PAW,冷却至室温后进行抑菌实验。
2.2 PAW制备时间对希瓦氏菌的影响
菌落总数是反映食品品质的一个重要指标[18-19]。由表2和图2可知,PAW0(对照)组希瓦氏菌菌落总数多不可计,与其相比PAW组有明显抑菌作用,且随PAW制备时间延长,PAW组菌落总数降低,抑菌率显著上升(P<0.05),抑菌效果与PAW制备时间呈正相关。杀菌机理可能与PAW中含有的大量活性粒子(OH-、H2O2、O3和氮氧化物等)与细菌肽聚糖发生氧化作用、破坏微生物细胞壁[20],引起菌体表面蛋白的变性和核酸水解,破坏酶类的活性等[21-22]有关。其中PAW60的抑菌率高达99.9%,显著高于其他组(P<0.05),说明制备60 min的PAW对希瓦氏菌的抑菌效果最好。
2.3 PAW对染菌鱼块菌落总数的影响
由表3和图3可知,随着PAW制备时间和浸泡时间的延长,菌落总数均显著减少(P<0.05)。其中PAW制备时间为60 min、浸泡时间为30 min时,染菌鱼块的菌落总数为(3.01±0.02) (lg(CFU/g)),显著小于其他各组(P<0.05),与康超娣[23]的研究结果一致,说明此条件对染菌鱼块的抑菌效果最好。
因此,后续实验中以PAW60浸泡30 min为统一条件处理染菌鱼块,鱼块37 ℃贮藏0、1、2、3、4、5 d后进行指标测定。
2.4 PAW60对染菌鱼块TVB-N含量的影响
TVB-N含量是评价动物性食品腐败程度的重要指标之一[24]。由图4可知,鱼块TVB-N含量随着贮藏时间的延长而增加,贮藏第5天,PAW60浸泡处理30 min后染菌鱼块的TVB-N含量显著低于对照组(P<0.05),降幅达16.83%。TVB-N是蛋白质分解产生的氨及胺类等碱性含氮物质,与菌落总数呈正相关[25]。经PAW60浸泡处理30 min后染菌鱼块腐败程度比对照组低。
2.5 PAW60对染菌鱼块质构的影响
质构是检测肉制品新鲜程度的重要依据[26-27]。加速腐败实验过程中,贮藏第4天鱼肉完全腐败,质构数据无法采集,因此只统计贮藏前3 d的数据。由图5可知,随着贮藏时间延长,硬度、黏聚性、咀嚼性均先下降后上升,弹性先下降后上升再下降。可能由于微生物的作用,鱼肉腐败程度加深,导致硬度等质构指标数值下降,贮藏第3天由于鱼肉表面水分蒸发,鱼肉变干,硬度等上升。贮藏2 d时,染菌鱼块除弹性外各指标值均降至最低,其中PAW60处理组咀嚼性与对照组无明显差异,硬度和黏聚性明显高于对照组,说明PAW60浸泡处理30 min对染菌鱼块的腐败及质构劣变有缓解作用。
2.6 PAW60对染菌鱼块感官评分的影响
感官评价是一种直接通过嗅觉、味觉来感受肉品新鲜程度的重要指标,是目前消费者评价肉品新鲜程度的主要方式[28]。由表4可知,随着贮藏时间的延长,染菌鱼块的色泽、气味、肌肉纹理、组织弹性等感官指标评分均显著下降(P<0.05),加权计算后总评分也显著降低(P<0.05)。贮藏3 d后,PAW60处理组和对照组鱼块的感官总评分均低于5 分,判定为不可接受。贮藏0~1 d时,PAW60组总评分与对照组无显著差异。贮藏2 d时,PAW60组总评分显著高于对照组(P<0.05);与对照组相比,此时PAW60组鱼块色泽、气味、肌肉纹理、组织弹性分别提高10.00%、13.87%、6.38%和9.67%。总体来说,37 ℃贮藏条件下,PAW60浸泡处理30 min鱼块的感官评分优于对照组。
3 结 论
研究PAW对希瓦氏菌的抑制作用和对染菌鱼块品质的影响。结果表明:PAW的pH值随着放电反应时间的延长而降低,温度的变化趋势相反;功率为0.9 kW、放电60 min时,PAW的pH值接近于2,温度接近于40 ℃;放电时间越长,PAW对希瓦氏菌的抑制效果越好,放电反应60 min可抑制99.9%的希瓦氏菌,效果最佳;PAW60处理染菌鱼块30 min时,菌落总数相较于其他实验组显著降低(P<0.05);PAW60处理后染菌鱼块的TVB-N含量明显低于对照组,质构指标和感官指标优于对照组。以上结果说明,放电时间60 min制备的PAW浸泡鱼块30 min能有效抑制鲈鱼腐败并改善其贮藏品质。
参考文献:
[1] ALMEIDA D, ALMOD?VAR A, NICOLA G G, et al. Trophic plasticity of invasive juvenile largemouth bass Micropterus salmoides in Iberian streams[J]. Fisheries Research, 2012, 113(1): 153-158. DOI:10.1016/j.fishres.2011.11.002.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020: 33.
[3] 朱文广, 曹川, 郭云霞, 等. 草鱼微冻保鲜和冷却保鲜的比较研究[J]. 江苏农业科学, 2012, 40(11): 267-269. DOI:10.3969/j.issn.1002-1302.2012.11.107.
[4] 趙宏强, 蓝蔚青, 孙晓红, 等. 冷藏鲈鱼片优势腐败菌的分离鉴定及致腐能力分析[J]. 中国食品学报, 2019, 19(8): 208-215. DOI:10.16429/j.1009-7848.2019.08.024.
[5] ZHAO Y M, OJHA S, BURGESS C M, et al. Influence of various fish constituents on inactivation efficacy of plasma-activated water[J]. International Journal of Food Science and Technology, 2020, 55(6): 2630-2640. DOI:10.1111/ijfs.14516.
[6] 汪家权, 周小霞, 许子牧, 等. 等离子体活化水灭活金黄色葡萄球菌生物膜[J]. 环境工程学报, 2019, 13(7): 1766-1772.
[7] 沈超怡, 吴清燕, 饶景珊, 等. 等离子水处理对马铃薯杀菌保鲜效果的影响[J]. 包装工程, 2019, 40(19): 9-15.
[8] 焦浈, 朱育攀, 许航博, 等. 等离子体活化水冰对纯培养及三文鱼片表面单增李斯特菌杀菌效果研究[J]. 郑州大学学报(理学版), 2019, 51(3): 97-103. DOI:10.13705/j.issn.1671-6841.2019022.
[9] 康超娣, 相启森, 刘骁, 等. 等离子体活化水在食品工业中应用研究进展[J]. 食品工业科技, 2018, 39(7): 348-352. DOI:10.13386/j.issn1002-0306.2018.07.062.
[10] 郭俭. 低温等离子体杀菌机理与活性水杀菌作用研究[D]. 杭州: 浙江大学, 2016: 36.
[11] 杨转琴, 魏红, 曹雯, 等. 大蒜提取液及食醋抑菌作用的研究[J]. 食品科学, 2008, 29(1): 69-73.
[12] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016: 3-5.
[13] 夏秀东, 刘小莉, 王英, 等. 白鱼腐败细菌的分离与鉴定[J]. 食品科学, 2015, 36(21): 175-179. DOI:10.7506/spkx1002-6630-201521033.
[14] 刘舒彦, 熊光权, 李海蓝, 等. 加州鲈优势腐败菌的分离鉴定[J]. 现代食品科技, 2019, 35(11): 120-125; 230. DOI:10.13982/j.mfst.1673-9078.2019.11.017.
[15] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016: 1-3.
[16] BARBOSA A A T, MANTOVANI H C, JAIN S. Bacteriocins from lactic acid bacteria and their potential in the preservation of fruit products[J]. Critical Reviews in Biotechnology, 2017, 37(7): 258-263. DOI:10.1080/07388551.2016.1262323.
[17] LU Xinpei, YE Tao, CAO Yingguang, et al. The roles of the various plasma agents in the inactivation of bacteria[J]. Journal of Applied Physics, 2008, 104(5): 053309. DOI:10.1063/1.2977674.
[18] 靳玉龙. 冷鲜猪肉微生物污染现状及大肠杆菌污染预测模型的构建[D]. 杨凌: 西北农林科技大学, 2015: 7-8.
[19] 赵宏强, 吴金鑫, 张苑怡, 等. 超高压处理对冷藏鲈鱼片品质及组织结构变化的影响[J]. 高压物理学报, 2017, 31(4): 494-504. DOI:10.11858/gywlxb.2017.04.019.
[20] YUSUPOV M, BOGAERTS A, HUYGH S, et al. Plasma-induced destruction of bacterial cell wall components: a reactive molecular dynamics simulation[J]. Journal of Physical Chemistry C, 2013, 117(11): 5993-5998. DOI:10.1021/jp3128516.
[21] PRICE R E, LONGTUN M, SUMMER C, et al. Modeling buffer capacity and pH in acid and acidified foods[J]. Journal of Food Science, 2020, 85(4): 918-925. DOI:10.1111/1750-3841.15091.
[22] DENG Xutao, SHI Jianjun, KONG M G. Physical mechanisms of inactivation of Bacillus subtilis spores using cold atmospheric plasmas[J]. IEEE Transaction on Plasma Science, 2006, 34(4): 1310-1316. DOI:10.1109/TPS.2006.877739.
[23] 康超娣. 等离子体活化水对鸡肉源P. deceptionensis杀菌效果及机制研究[D]. 郑州: 郑州轻工业大学, 2019: 21-22.
[24] 唐森, 韋浪生, 覃逸明, 等. 壳聚糖-咖啡酸衍生物涂膜对鲈鱼的保鲜效果研究[J]. 安徽农业科学, 2019, 47(23): 207-209; 224.
[25] 闫春子. 超高压处理对淡水鱼冷藏保鲜效果的影响[D]. 无锡: 江南大学, 2016: 15-32.
[26] JONAS T G, BALTHAZAR C F, SILVA R, et al. Impact of probiotics and prebiotics on food texture[J]. Current Opinion in Food Science, 2020, 33: 38-44. DOI:10.1016/j.cofs.2019.12.002.
[27] 刘婧懿, 赵前程, 程少峰, 等. 鱼肉质构的影响因素及测定方法研究进展[J]. 食品安全质量检测学报, 2020, 11(9): 3035-3043. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.09.066.
[28] KOCK H L D, MAGANO N N. Sensory tools for the development of gluten-free bakery foods[J]. Journal of Cereal Science, 2020, 94: 10299. DOI:10.1016/j.jcs.2020.102990.

