云南省勐腊县部分猪场猪伪狂犬病病毒感染状况调查
钟顺平 杨贵伟 刘应华 杨贵树 高利波
摘 要:为了解云南省勐腊县部分猪场猪伪狂犬病(Pseudorabies,PR)的流行情况,用PCR对2019年从该地区部分猪场采集的811份猪血液样品进行了猪伪狂犬病病毒(Pseudorabies Virus,PRV)抗原检测。结果显示,811份样品中有337份检测结果为阳性,阳性率为41.55%,不同猪场PRV阳性率介于35.4%~63.8%;哺乳仔猪、保育猪、育肥猪、种公猪和母猪的血液样品分别为290 份、193 份、276份、10份和42份,阳性率分别为38.3%、28.6%、20%和33.3%。结果表明,PRV在云南省勐腊县猪场中广泛存在,不同年龄阶段的猪均易感染且感染率较高,应加强对该病的防控。
关键词:猪伪狂犬病病毒;PCR检测;感染状况;云南省
猪伪狂犬病病毒(Pseudorabies Virus,PRV)属于疱疹病毒科-疱疹病毒属成员,是一种有囊膜的线状双链DNA病毒,也是疱疹病毒科中抵抗力较强的一种。由PRV引起的猪伪狂犬病(Pseudorabies,PR)是多种哺乳动物共患的一种急性传染病[1]。除了猪以外,其他动物感染伪狂犬病病毒后,主要表现为发热、奇痒及脑脊髓炎,死亡率极高。猪是伪狂犬病病毒的贮存宿主,发病后临床症状因感染猪年龄不同而有差异。妊娠母猪会出现流产、产死胎及木乃伊胎等综合症候群;初生仔猪会出现神经症状,如运动失调和麻痹等,最终衰竭而亡;成年猪多呈隐性感染,但可以引起呼吸道症状[2]。
随着养猪业的不断发展,云南省的猪病也越加复杂,为更好地了解和监控云南省勐腊县PRV野毒株的感染流行情况,本研究利用PCR对2019年该地区送检的血液样品进行了相应的病原检测,为后续有效控制和净化PR及进一步研究提供基础依据。
1 材料与方法
1.1 材料
1.1.1样品
2019年云南省勐腊县各个地区猪场送检的811份血液样品,包括5个规模化猪场的725份样品和散户的86份样品。
1.1.2主要仪器
移液器(DRAGON公司,KA0052521)、超净工作台(苏州净化设备有限公司,SW-CJ-1FD)、高速冷冻离心机(Thermo Fisher Scientific公司,75005440)、凝胶成像系统(天能科技有限公司,Tanon-1600)、电泳仪(北京六一仪器厂,DYY-7C)、普通PCR仪(BIO-RAD公司,580BR 12007)和恒温水浴锅(上海一恒科学仪器有限公司,HWS12)。
1.1.3主要试剂
DNA提取试剂盒(百泰克生物技术有限公司),2×Transhifi Super Mix Ⅱ(含Tag DNA聚合酶,RNaase Inhibitor、dNTP和ddH2O,北京全式金公司),DNA Marker DL1000(大连宝生物公司),琼脂糖(GENE公司);其他试剂由云南农业大学动物传染病实验室提供,试剂均为分析纯。
1.1.4引物设计
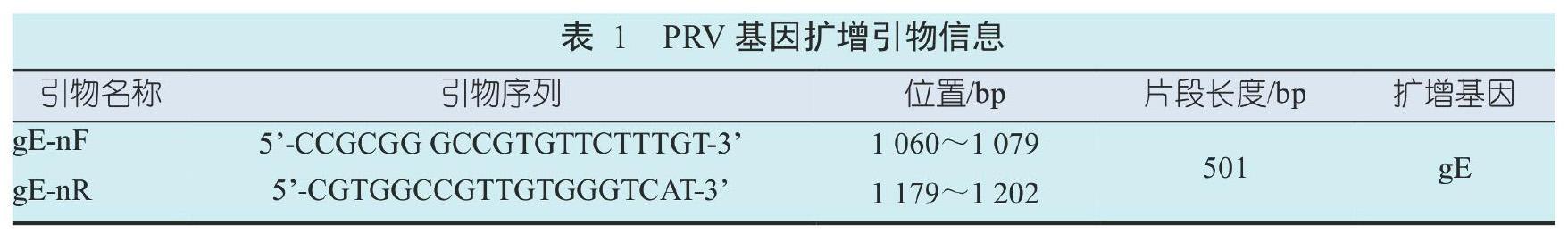
根据NCBI GenBank中公布的PRV基因序列(FJ797217、KJ717942和AY169694),设计一对特异性引物(表1)用于PCR检测。引物由昆明硕擎生物公司合成。
1.2 方法
1.2.1样品DNA提取
样品预处理和DNA提取均严格按照说明书进行,提取的DNA于-20 ℃下保存备用。
1.2.2 PCR扩增
将提取的DNA作為模板进行PCR扩增,反应体系为:2×Transhifi Super MixⅡ 12.5 μL、ddH2O 10.5 μL、上游引物 0.5 μL、下游引物0.5 μL和DNA 1.0 μL, 总的反应体系为25 μL。反应程序为: 94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火40 s,72 ℃延伸40 s,共35个循环。取10 μL PCR扩增产物配制成体系后加样到1.5%琼脂糖凝胶孔中,120 V电压下电泳 30 min,在凝胶成像系统上观察结果,并拍照。
2 结果与分析
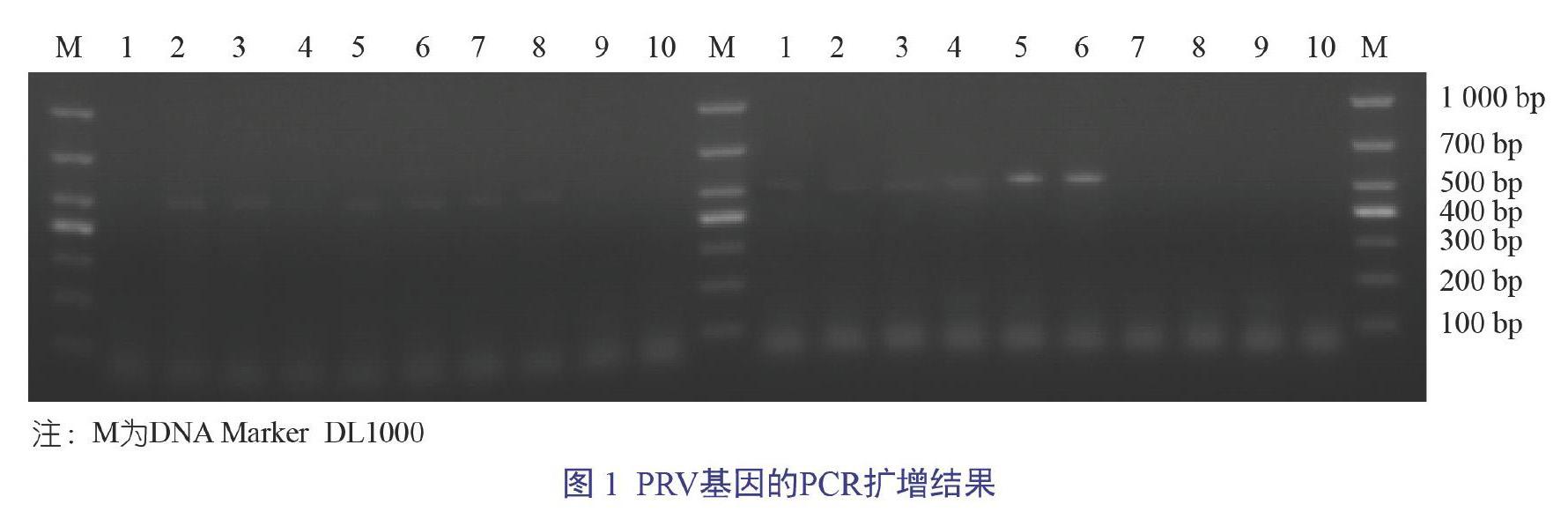
2.1 PRV基因的PCR扩增结果
PRV基因的扩增结果同预期目的片段501 bp大小相符(图1),表明部分样品呈PRV阳性。在811份血液样品中,337份样品检测为PRV阳性,阳性率为41.55%(337/811)。
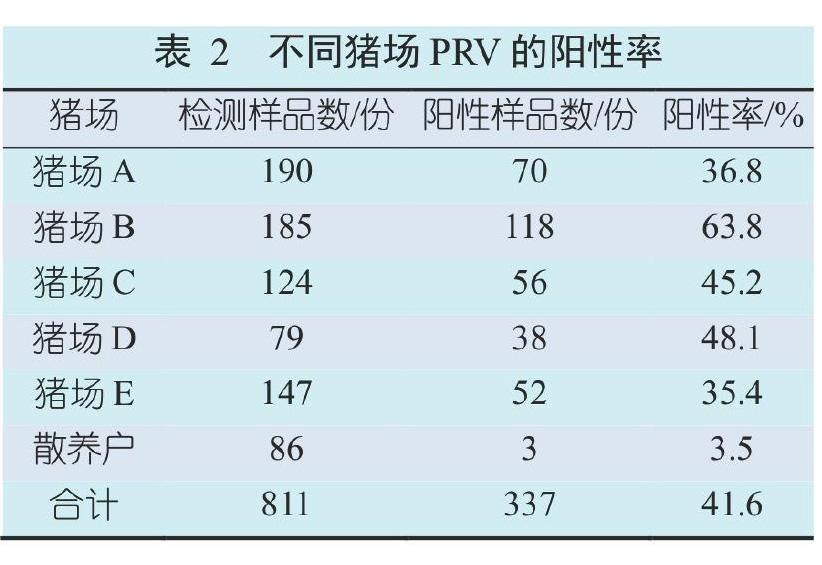
2.2 不同猪场PRV的阳性率
在规模化猪场的725份血液样品中,334份呈PRV阳性,阳性率为46.1%(334/725),各猪场间的阳性率差别较大,从35.4%~63.8%不等。散养户猪群的PRV阳性率为3.5%(3/86)。见表2。
2.3 不同生长阶段猪群PRV的阳性率
不同生长阶段猪群(哺乳仔猪、保育猪和育肥猪)的血液样品共759份,采集自哺乳仔猪、保育猪和育肥猪的血液样品分别为290份、193份和776份,阳性率分别为57.9 %(168/290)、38.3% (74/193)和28.6%(79/276)。各生长阶段猪群的阳性率差异较大,介于28.6%~57.9%,见表3。
2.4 不同性别猪群PRV的阳性率
公猪和母猪的血液样品分别为10份和42份,阳性率分别为20%(2/10)和33.3%(14/42),表明种公猪和母猪均有感染,见表4。
3 讨论
我国自1948年首次报道PR以来,已有多个地区报道了该病的流行,给无数猪场带来了很大的经济损失。吴美芹等在对2010-2017年21个省市的猪血清样品进行猪伪狂犬病病毒野毒株gE抗体检测后,发现阳性率在7.90%~45.4%[3]。中国动物疫病预防控制中心从2011-2016年的检测数据发现gE的阳性率在13.0%~64.3%[4]。中科基因公司2017年的PRV gE抗体检测结果显示猪场的阳性率为77.0%,个体平均阳性率为43.3%[5]。
本文用PCR共检测了云南省勐腊县5个规模化猪场的725份猪血液样品和散养户的86份猪血液样品,发现PRV野毒株平均阳性率为41.6%,说明PR在云南省勐腊县的猪场中已有一定程度的流行。各猪场的PRV阳性率差别较大,猪场E的阳性率最低,为35.4%,猪场B的阳性率达63.8%,这可能与送检血液样品及各猪场的饲养管理和免疫程序等具体情况不同有关。据我们后续的调查发现,猪场B没有接种过猪伪狂犬病疫苗,这应该是该猪场阳性率比其他猪场高很多的缘故。除猪场E外,4个接种过猪伪狂犬病疫苗的规模化猪场PRV阳性率平均为48.8%。结合之前的报道,发现阳性率有上升趋势,郑旺华等报道云南省西双版纳州两个规模化猪场PRV抗原阳性率仅为11.9%[6]。这可能与2011年以来我国猪群中相继出现了致病性更强的猪伪狂犬病病毒变异毒株有关,变异毒株的抗原性发生变化使现有的gE基因缺失疫苗提供的保护作用不能发挥应有的保护作用。
本次检测散养户猪群PRV的阳性率仅为3.5%,远远低于规模化猪场的阳性率(46.1%)。本次采样的散养户猪群均未接种过猪伪狂犬病疫苗,和之前的一些报道相比[7],勐腊县的散养户猪群PRV阳性率较低,这可能是因为与其他地区相比,勐腊县散养户的规模较小,养殖密度较低。从生长阶段看,勐腊县不同生长阶段猪群都感染了PRV,但感染率不同,感染率由高到低依次为哺乳仔猪、保育猪、母猪、育肥猪和公猪,与国内一些调查结果基本一致[5,8-9]。哺乳仔猪感染率高的原因主要是一些猪场忽视了对哺乳仔猪的免疫,随着母源抗体的消失,哺乳仔猪及保育猪的易感性增加。
从不同性别猪群看,母猪的阳性率为33.3%,高于公猪的阳性率(20%),这在一定程度上说明了这一时期不同性别的猪对PRV的易感性存在差异。黄晓慧等应用ELISA对安徽地区不同规模化猪场 2012-2015年采集的猪血清样品进行猪伪狂犬病病毒野毒株抗体检测,结果显示母猪的阳性率为27.46%,公猪的阳性率为22.22%[8]。总之,勐腊县猪群存在携带PRV的情况,且阳性率相对较高,在当前猪病防控的严峻形势下,有必要加强对种猪群的疫病检测,推行种猪场主要疫病的控制与净化工作势在必行。
参考文献:
[1] 田克恭,人与动物共患病[M].北京:中国农业出版社,2013.
[2] 杨汉春. 2014 年猪病流行情况与2015 年流行趋势及防控对策[J].猪业科学,2015,32(2): 38-40.
[3] 吴美芹,吕翠,马小明,等. 2017年猪伪狂犬的抗体检测分析与防控建议[J].兽医实验室,2018,(2): 73-76.
[4] Bai Xiaofei, Wang Yuzhou, Xu Xin et al. Commercial vaccines provide limited protectionto NADC3 0 - like PRRSV infection[J]. Vaccine, 2017, 34 (46): 5540-5545.
[5] 孫哲,晋春霞,刘守川,等. 2017年中科基因对我国猪群常发疫病检测结果统计与分析[J].中国动物保健,2018,(2):5-8.
[6]郑旺华,郑兰芬,张劲松,等. 版纳小耳猪伪狂犬病感染状况调查研究[J].现代农业科技,2014,(6):274-284.
[7] 段文学,普琼波.4年两地猪伪狂犬病血清流行病学调查报告[J].中国畜禽种业,2014,(2):7-8.
[8] 黄晓慧,吴华健,华耀,等. 安徽部分地区规模化猪场伪狂犬病血清流行病学调查[J].动物医学进展,2017,38(8):126-130.

