特发性肺纤维化血清生物指示物的研究
朱明慧 万汝燕 李飞 王晓博 于洪涛 王兰 余国营
1河南省胸科医院门诊部/院士工作站,郑州450003;2河南省与科技部共建细胞分化与调控国家重点实验室 河南师范大学生命科学学院,新乡453007;3河南省肺纤维化杰出外籍科学家工作室 河南师范大学生命科学学院,新乡453007;4河南省肺纤维化国际联合实验室 河南师范大学生命科学学院,新乡453007
特发性肺纤维化 (idiopathic pulmonary fibrosis,IPF)是一种慢性进行性肺部疾病,其特征是肺实质中纤维化组织异常积累,肺部瘢痕形成,肺泡结构被破坏,从而导致肺顺应性下降,气体交换中断,最终导致呼吸衰竭和死亡[1]。IPF影响全世界约300万人,并且在很大程度上不受当前可用药物的影响,其发病率和病死率不断增加[2]。确诊后的IPF 患者的平均生存期比较短,一般为2~3年[3]。由于IPF 的发病机制尚不明了,早期的漏诊率也比较高。因此,提高IPF 的早期诊断,并且尽早的采取治疗手段,对于改善IPF 患者的预后具有重要意义。
外周血生物标志物的鉴定有助于诊断、估计预后、选择和评估治疗方法以及开发新的治疗干预措施。目前也已经研究了许多IPF 候选血液生物标志物,包括细胞因子、趋化因子、酶、胶原相关产物和Ⅱ型上皮细胞产物,以确定它们的诊断和预测价值[4]。Human Napsin-A (NASPA)是一种天冬氨酸蛋白酶,在正常的肺和肾组织中大量表达,被认为是原发性肺腺癌的良好诊断标记[5]。肺表面活性物质相关蛋白 A (pulmonary surfactant protein A,SP-A)和肺表面活性物质相关蛋白D(pulmonary surfactant protein D,SP-D)由Ⅱ型肺泡上皮细胞和Clara细胞产生,属于C型凝集素超家族的成员,在肺的先天免疫系统中也起着重要作用[6]。Micro RNAs(miRNAs)是一类小的非编码RNA 分子,可以通过靶向信使RNA (mRNA)并触发mRNA 裂解或翻译抑制来调节基因的表达。研究表明,某些特定的miRNA 与癌症有关,并可以视为治疗目标[7-8]。之前我们的研究也发现miR-29家族因其在组织纤维化中通过调节细胞外基质的产生和沉积以及上皮-间质转化而具有抗纤维化的作用[7]。miR-21和miR-30家族通过控制关键的信号通路和相关的癌基因在不同类型肿瘤的转化中起着关键作用[9-10],但是与IPF的关系不得而知,是否是更好的IPF 早期诊断指标呢? 基于此,本研究主要对IPF 患者血浆中NASPA、SP-A 和SP-D,血清外泌体中hsa-miR-21-5p(人-miR-21-5p)及血清中hsa-miR-29b-3和hsa-miR-30c-5p水平进行分析,旨在为IPF 早期诊断、治疗及临床病情的监测提供新的理论基础。
1 对象与方法
1.1 研究对象 选取2015年2月至2019年8月河南省胸科医院呼吸科收治的50 例IPF 患者(IPF组)资料进行回顾性研究,其中男40例,女10例,年龄(63.06±8.46)岁,年龄范围为48~83岁。纳入标准: (1)符合 《ATS/ERS/JRS/ALAT 官方声明:IPF 诊断和管理指南》诊断标准[11];(2)无精神疾病; (3)无心肺、自身免疫性疾病; (4)依从性比较强,能够积极配合的患者;(5)临床资料完整者。排除标准:(1)患有其他严重器官疾病者;(2)长期使用激素类药物疾病者;(3)伴有其他肺部感染的患者;(4)拒绝本次实验研究者。同时选取来河南省胸科医院体检的健康者20名为对照组,其中男15名,女5名,年龄(54.53±2.86)岁,年龄范围为50~80 岁。与IPF组在性别、年龄分布等基本情况上,差异无统计学意义(P >0.05),具有可比性。本研究已获得河南省胸科医院伦理委员会的批准 (2015-07-001),且所有参与研究的患者和健康者均已签署知情同意书。
1.2 主要仪器与试剂 PCR 仪C1000 Touch及定量PCR 仪CFX96 (美国Bio-Rad公司);洁净工作台(苏净安泰公司);紫外分光光度计K5500 (北京凯奥公司)。NAPSA (CSB-EL015452 HU)、SP-A (CSB-E08683h)及SP-D (ab213827)酶联免疫吸附试验 (enzyme linked immunosorbent assay,ELISA)试剂盒 (广州市锐博生物科技有限公司),RT 引物,上游引物,mimic,小RNA荧光定量PCR 启动试剂盒及RiboTM外泌体分离试剂(广州市锐博生物科技有限公司);MagenTM(广州美基生物)。
1.3 方法
1.3.1 组织标本采集 收集IPF患者和健康体检者空腹状态下的外周血7 ml,3 000 r/min,离心10 min,离心半径为12.4 cm,分离血清和血浆,-80 ℃冰箱保存,待测。
1.3.2 检测方法 应用ELISA 检测血浆中NAPSA、SP-A 和SP-D 水平,根据ELISA 试剂盒说明书操作进行实验。外泌体hsa-miR-21-5p、血清hsa-miR-29b-3 和hsa-miR-30c-5p 表达采用Trizol法和Magzol试剂,提取IPF 患者和对照组血清中的总RNA,适当稀释后利用紫外分光光度计K5500进行浓度和OD 值的测定。反转录后使用Bulge-LoopTMmiRNA q RT-PCR Starter Kit并按照试剂盒说明书进行q RT-PCR 反应。
1.4 统计学分析 采用PRISM 7.0统计软件进行数据的整理与分析,结果以±s 表示,各项指标组间比较采用t 检验,P <0.05为差异有统计学意义。
2 结果
2.1 IPF患者的生存率 从确诊为IPF时日算起,随访时间截至2019年8月6日,对所有患者的生存率进行了统计分析,结果显示大多数IPF 患者的生存期为2~3年。见图1。
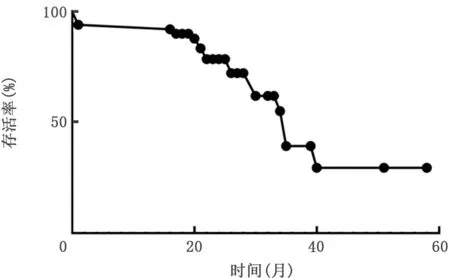
图1 IPF患者的存活率统计图
2.2 2 组间NAPSA、SP-A 和SP-D 水平的比较 IPF患者血浆中NAPSA 和SP-D 水平均明显高于对照组,差异均有统计学意义 (t=2.35、2.61,P 值均<0.05)。然而,IPF 患者血浆中SP-A水平却明显低于对照组,差异有统计学意义(t=6.42,P <0.01)。见表1。
2.3 IPF 组与对照组外泌体has-miR-21-5p 的表达量比较 由于血液样本处理时,血小板凝血过程中会分泌大量的外泌体到血清中。为了更加精确的检测IPF患者与健康对照组外泌体中miRNA 的表达情况,我们检测了血浆中外泌体has-miR-21-5p的表达变化。结果显示IPF患者血浆中外泌体hasmiR-21-5p的表达量(7.913±0.980)明显高于对照组(1.138±0.143),差异有统计学意义 (t=4.347,P <0.001)。
表1 2组血浆中NASPA、SP-A 和SP-D 的水平比较 (±s)
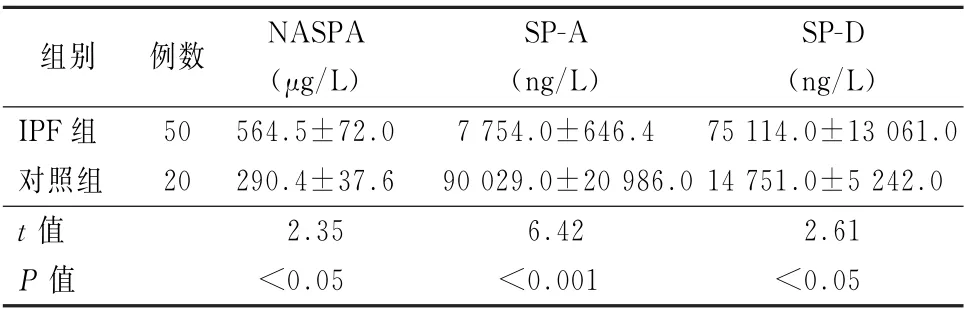
表1 2组血浆中NASPA、SP-A 和SP-D 的水平比较 (±s)
注:NASPA 为Human Napsin-A;SP-A 为肺表面活性物质相关蛋白A;SP-D为肺表面活性物质相关蛋白D;IPF 为特发性肺纤维化
组别例数NASPA(μg/L)SP-A(ng/L)SP-D(ng/L)IPF组50 564.5±72.0 7 754.0±646.4 75 114.0±13 061.0对照组20 290.4±37.6 90 029.0±20 986.0 14 751.0±5 242.0 t 值2.35 6.42 2.61 P 值<0.05<0.001<0.05
2.4 IPF 组与对照组血清中hsa-miR-29b-3p 和hsa-miR-30c-5p的表达量比较 IPF 患者血清中hsa-miR-29b-3p的表达量明显低于对照组,差异有统计学意义 (t=2.838,P <0.01)。IPF 患者血清中hsa-miR-30c-5p 的表达量与对照组比较,差异无统计学意义 (t=0.841,P >0.05)。见表2。
表2 2组血清中hsa-miR-29b-3p和hsa-miR-30c-5p的表达量比较 (±s)
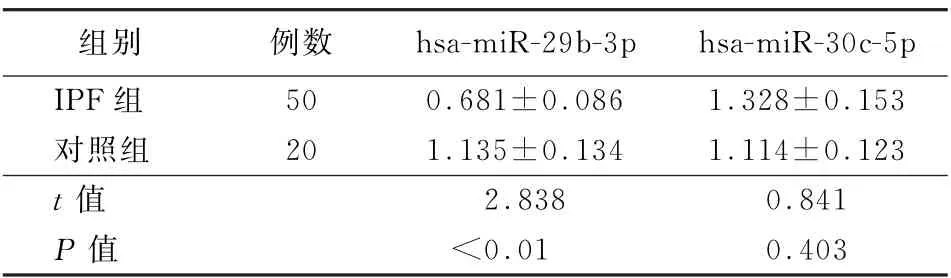
表2 2组血清中hsa-miR-29b-3p和hsa-miR-30c-5p的表达量比较 (±s)
注:IPF为特发性肺纤维化
组别例数hsa-miR-29b-3p hsa-miR-30c-5p IPF组50 0.681±0.086 1.328±0.153对照组20 1.135±0.134 1.114±0.123 t值2.838 0.841 P 值<0.01 0.403
3 讨论
IPF是一种病因不明的进行性纤维化肺部疾病。临床上通常采用高分辨率计算机断层扫描技术、手术肺活检和支气管镜检查等方法对IPF 病情进行诊断和评估。其中肺部高分辨率计算机断层扫描技术是最受信任的的方法,也无法始终准确地预测IPF中疾病活动的性质。肺活检又存在有潜在的手术风险,实际操作率较低,且增加了诊断的难度。因此,使用具有诊断和预后作用的非侵入性生物标志物在IPF 的临床诊断中显得尤为重要,尤其是在医疗资源有限的情况下,它有助于识别易感患者[12]。
NASPA 是一种相对分子质量接近38 000的天冬氨酸蛋白酶,主要表达于Ⅱ型肺泡上皮细胞,在肺泡巨噬细胞和肾小管中也有少量表达。它参与了疏水性SP-B 和SP-C 前体蛋白的水解过程,并起到诱导蛋白前体成熟、维持肺的正常功能和形态的作用[4,13]。本研究结果显示,IPF 患者血浆中NASPA 表达水平较对照组显著升高(P <0.05)。这可能是由于IPF患者Ⅱ型肺泡上皮细胞增生和/或上皮屏障完整性破坏所引起的。
SP-A 和SP-D 由Ⅱ型肺泡上皮细胞和Clara细胞产生,是疏水性的、含胶原的钙依赖性凝集素,在肺和心肺部位具有一系列非特异性免疫功能。SP-D 在维持肺表面张力方面很重要,并参与肺实质的组织、稳定和代谢[14]。故而,SP-D 蛋白在IPF的发展中具有重要作用。本研究使用ELISA法检测SP-D 的水平,其数据经统计学处理后发现IPF患者血浆中SP-D的水平显著高于对照组(P <0.05)。这些结果也与之前的一些研究类似[15-16],进一步支持了SP-D 是公认的IPF 标志物这一结论。我们推测IPF患者的SP-D 升高可能是由于肺泡腔的血管渗漏增多,而这可能是由于肺泡上皮细胞的脱离,基底膜损伤和毛细血管脆性改变引起的。而SP-A 在IPF 患者中的水平明显低于对照组,这与先前的一些研究结果不一致。出现这一现象的原因可能是由于环境的影响,不同地区的患者之间的差异所造成的。由此看来,SP-A 并不适合作为IPF肺部疾病诊断的潜在生物标志物。
miRNA 是一类长度约为22 nt 的内源性RNA,可调节蛋白质编码RNA 的表达和功能。大量证据表明miRNA 通过靶向m RNA 促进肿瘤生长、侵袭、血管生成和免疫逃逸,由此可以看出它们是细胞的关键分子成分。由于miRNA 可在组织和体液样本中稳定存在,并能被分离出来进行进一步的研究。临床上通过抽血检测一些物质的改变从而指示患者的健康情况是一种可以减轻患者痛苦的微创方法。因此检测IPF患者外周血中miRNA 的含量可以作为一种比较好的检测手段[17-18]。之前的研究报道肺泡Ⅱ型上皮细胞过表达miRNA-21-5p基因可明显降低肺泡Ⅱ型上皮细胞凋亡率,上调抗凋亡基因的表达。这表明miRNA-21-5p可有效拮抗肺泡Ⅱ型上皮细胞的凋亡[19]。此外,有文献表明miR-21参与转化生长因子β介导的肾纤维化,并且其水平与纤维化程度呈正相关[20]。在本研究中,qRT-PCR 结果显示IPF患者中hsa-miR-21-5p的表达水平显示高于对照组 (P <0.001)。说明IPF患者可能通过上调hsa-miR-21-5p的表达从而减少肺泡Ⅱ型上皮细胞的凋亡,进一步通过转化生长因子β诱导肺纤维化。有文献显示在肺成纤维细胞中miR-29b可以通过下调PI3K-Akt信号通路来逆转纤维化表型[21]。在本研究中IPF 患者中hsamiR-29b-3的表达水平显示低于对照组 (P <0.001),这与我们之前的研究结果一致[7],出现这一现象的原因可能是由于IPF 患者中减少的hsamiR-29b-3会导致胶原蛋白的过量生产以及细胞外基质相关基因和重塑基因的上调。
综上所述,我们的结果进一步支持了SP-D 可以作为IPF 肺部疾病诊断的潜在生物标志物的结论。此外,可以将IPF患者血浆中NASPA、外泌体hsa-miR-21-5p、血清中hsa-miR-29b-3作为IPF肺部疾病诊断的候选标志物。
利益冲突所有作者均声明不存在利益冲突

