miR-3a通过CHD1L的负调控抑制肝癌的增殖、迁移和侵袭
张晓雪,吴孝雄(海军军医大学第三附属医院放疗科,上海 00000;上海市中医药大学附属第七人民医院肿瘤二科;通信作者,E-mail:beary999@63.com)
肝癌是亚洲地区最常见的癌症之一[1,2],手术是首选的治疗策略,但患者大多死于肿瘤转移。肿瘤转移是一个复杂的过程,细胞从原发器官部位扩散到远处的器官部位形成肿瘤[3]。相当多的肝癌患者初诊即被诊断为不可切除、局部晚期或转移性疾病[4]。肝癌的发生发展不仅与p53、Rb和Ras等癌症相关蛋白的表达密切相关,而且还受约100个microRNA(miRNA)调节。miRNA是一类内源性非编码RNA,长约20-25个核苷酸,在真核生物中广泛表达,主要通过与3′-非翻译区中靶mRNA的碱基配对抑制转录后水平的基因表达,导致mRNA切割或翻译抑制[5]。miRNA在细胞增殖和分化、肿瘤发生和凋亡中起作用。染色质解旋酶DNA结合蛋白(chromodomain helicase/ATPase DNA binding protein 1-like gene,CHD1L)是一种单链糖基磷酸肌醇锚定的类免疫球蛋白,通过整合素受体介导同型和异型细胞与其他CHD1L家族分子的相互作用[6,7],CHD1L参与了肿瘤细胞的黏附、迁移、侵袭和转移[7]。miR-3a诱导G1期细胞周期停滞并抑制致肿瘤性,在RCC中起肿瘤抑制剂的作用。在肝癌中,miR-3a基因定位于纯合缺失区域,表明miR-3a可能在肿瘤发生和癌症进展中起关键作用[8-10]。本研究通过检测miR-3a在肝癌组织中的表达,并评估miR-3a对人肝癌细胞A549的影响,阐明miR-3a通过CHD1L的负调控抑制肝癌的增殖、迁移和侵袭,为临床诊疗提供新的思路和治疗靶点。
1 资料与方法
1.1 研究对象
人肝癌细胞株A549细胞(购自美国Science Cell公司)维持在Dulbecco改良的Eagle培养基(DMEM;Invitrogen,Carlsbad,CA,USA)中,用含2 mmol L-丙氨酰-L-谷氨酰胺,1%青霉素/链霉素和10%胎牛血清(Invitrogen)的RPMI-1640细胞培养液,每种培养基置于37 ℃和5% CO2中培养,待单层细胞生长达到80%融合时,用胰蛋白酶消化细胞,收集细胞,PBS冲洗1次后备用。
1.2 研究分组
应用随机数字法将人肝癌细胞株A549细胞分为:阴性对照组、空白对照组、miR-3a类似物组,每组纳入10个培养皿。将细胞接种于3孔板内,细胞融合约50%-60%时进行转染,每孔板加入25 pmol的类似物和10 μl转染试剂。miR-3a类似物组:使模拟物类似物的浓度达到10 pmol/ml,转染后5 h进行一次换液。阴性对照组:使空质粒的浓度达到10 pmol/ml,转染后5 h进行一次换液。空白对照组:仅进行换液,不转染质粒。
1.3 方法
1.3.1 茎环常规逆转录聚合酶链反应(RT-PCR)分析CHD1L的转录水平 根据制造商的说明书,使用TRIzol试剂(Invitrogen公司,美国)分离总RNA。使用Prime-Script RT试剂盒(宝日医生物技术(北京)有限公司)合成逆转录的互补DNA。常规PCR用于使用特异性正向引物测定miRNA表达,并且使用小核RNA互补的通用反向引物作为内部对照。CHD1L的PCR引物设计见表1。PCR循环通过在95 ℃下初始变性5 min,在95 ℃下完成40个循环10 s,在60 ℃下完成1 min。

表1 RT-PCR引物序列
1.3.2 蛋白质印迹分析(WB)检测E-钙黏蛋白、N-钙黏蛋白、γ-连环蛋白、胰岛素样生长因子1受体的蛋白表达水平 将各组培养基中转染的A549细胞(每组约5×103个细胞)加3 ml 4 ℃预冷的PBS(0.01 mol/L,pH7.2-7.3),平放轻轻摇动1 min洗涤细胞,然后弃去洗液,重复以上操作2次,共洗细胞3次以洗去培养液,将培养液洗净后,培养瓶至于冰上;按1 ml裂解液加10 μl PMSF(100 mmol/L)摇匀至冰上,每瓶细胞加400 μl含PMSF的裂解液,于冰上裂解30 min,裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧,然后用枪将细胞碎片和裂解液移至1.5 ml离心管中,于4 ℃下12 000 r/min离心5 min,将离心后的上清液分装转移到0.5 ml离心管中放于-20 ℃保存。使用时融化至室温,通过10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质提取物(50 μg),并电泳转移到聚偏二氟乙烯膜上。将膜在室温下用5%脱脂奶粉封闭30 min,并将抗E-钙黏蛋白(sc-8426,小鼠,IgG1)、N-钙黏蛋白(sc-7939,兔,IgG)、γ-连环蛋白(sc-30997,山羊,IgG)、胰岛素样生长因子1受体(IGF-1R;sc-sc462,小鼠,IgG1)或β-肌动蛋白(sc-1616,山羊,IgG)(圣克鲁斯生物技术公司,美国)的抗体稀释。抗E-钙黏蛋白、N-钙黏蛋白和γ-连环蛋白的抗体稀释度为1 ∶1 000,抗β-肌动蛋白的抗体稀释度为1 ∶5 000。用PBS-T(10 mmol/L PBS,0.05%Tween-20,pH7.4)洗涤后,将膜与第二HRP连接的多克隆山羊抗兔抗体(sc-2004)孵育1 h。用PBS-T再次洗涤膜,并使用ECL化学发光使蛋白质可视化并暴露于X射线胶片。
1.3.3 测定肝癌细胞的存活率 将各转染组的A549细胞(每组约5×103个细胞)置于含有10%FBS的RPMI-1640培养基的6孔板中3周。将菌落用甲醇固定,并用0.1%结晶紫(生工生物工程(上海)股份有限公司)在20%甲醇中染色30 min。并用荧光激活细胞分选流式细胞仪(BD公司,美国)检查。每个测试一式三份进行。
1.3.4 细胞增殖试验(MTT)检测肝癌细胞的增殖能力 使用3-(4,5-二甲基二唑-2-基)-2,5-二苯基溴化四唑测定法检测细胞增殖。将细胞接种到24孔板(1.2×104细胞/孔)中并使其附着过夜。在24,48,72,96 h采用MTT测定评估细胞活力。在分光光度计上读取每个孔在490 nm处的吸光度。一式三份进行3次独立实验。
1.3.5 Transwell法测定肝癌细胞的侵袭能力 采用划痕试验检测瞬时转移细胞和批量选择的A549细胞的迁移和侵入潜力。在6孔板孔内接种各实验组细胞(每组约5×103个细胞),第2天用移液管尖端刮擦细胞,并进一步用新鲜培养基培养。媒介每2 d更换一次。在刮擦(0 h)之后立即以×40放大率捕获图像,并且在刮擦12,24 h捕获图像。使用预先涂有Matrigel基底膜基质并且浓度为1 mg/ml的Transwell板(8 μm孔径;6.5 mm直径;康宁生命科学公司,美国)细胞侵袭测定根据制造商的说明(Biosciences公司,美国)进行。将0.2 ml培养基中含有2%FBS的2×104个细胞接种到0.6 ml含有10%FBS的培养基接种。将板置于37 ℃,5%CO2中温育。48 h后,取出室,用棉签从室的上侧除去非侵入细胞。将室下的细胞在甲醇中固定10 min,并用0.1%结晶紫在20%甲醇中染色30 min。
1.4 统计学方法
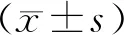
2 结果
2.1 RT-PCR检测miR-3a转染后肝癌细胞中CHD1L mRNA相对表达
实时定量PCR检测A549细胞中CHD1L mRNA的表达水平,结果显示,与阴性对照组及空白对照组相比,miR-3a类似物组A549细胞CHD1L mRNA的表达水平降低(P<0.05,见图1、表2)。

图1 RT-PCR检测miR-3a转染后A549细胞中CHD1L mRNA相对表达Figure 1 The relative expression of CHD1L mRNA in A549 cells transfected with miR-3a by RT-PCR

表2 RT-PCR检测miR-3a转染后A549细胞中CHD1L mRNA相对表达量
2.2 Western blot检测miR-3a转染后肝癌细胞中CHD1L蛋白的表达
与阴性对照组和空白对照组相比,miR-3a类似物组A549细胞的CHD1L蛋白表达水平降低(P<0.05,见图2和表3)。

图2 Western blot检测miR-3a转染后A549细胞中CHD1L基因蛋白含量的表达水平Figure 2 The expression level of CHD1L protein in A549 cells transfected with miR-3a by Western blot
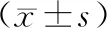
表3 Western blot检测miR-3a转染后A549细胞中CHD1L蛋白相对表达水平
2.3 细胞流式细胞仪检测miR-3a转染后肝癌细胞的存活
与阴性对照组相比和空白对照组相比,miR-3a类似物组A549细胞存活数降低,差异有统计学意义(P<0.05,见表4)。
2.4 MTT测定miR-3a转染后肝癌细胞的增殖能力
MTT结果显示,与空白组及阴性对照组相比,miR-3a组A549细胞增殖能力降低(P<0.05,见表5)。
2.5 Transwell检测miR-3a转染后肝癌细胞的侵袭能力
为了检测miR-3a转染对肝癌细胞系迁移和侵袭中的影响,我们采用Transwell对A549细胞侵袭能力进行检测。结果显示,与阴性对照组及空白对照组相比,miR-3a类似物转染组细胞侵袭能力降低(P<0.05,见图3,表6)。
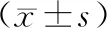
表4 细胞流式细胞仪检测miR-3a转染后A549细胞存活数

表5 MTT测定miR-3a转染后A549细胞的增殖能力

图3 Transwell检测miR-3a转染后A549细胞的侵袭能力Figure 3 The invasive ability of A549 cells transfected with miR-3a by Transwell
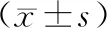
表6 miR-3a转染对A549细胞侵袭能力的影响
3 讨论
肝癌仍然是世界范围内男性第五大最常见的恶性肿瘤和女性第八大恶性肿瘤。据估计,肝癌每年新增病例66.4万例,其中男性49.8万例,女性16.6万例。尽管在早期诊断和治疗方面取得进步,但肝癌患者的预后仍然很差,其5年生存率仅为8%-14%[11]。其中侵袭转移是肝细胞肝癌进展过程中患者死亡的主要原因。侵袭是指癌细胞能够穿透将其与健康组织和血管分离的细胞膜,转移是指癌细胞扩散到身体其他部位[12]。诸多细胞黏附分子作为这些过程的关键调节器发挥作用,其中,miRNA的失调或突变有助于癌症的发生和发展[13]。
在细胞活动中,miRNA能够作为肿瘤抑制因子或癌基因发挥作用,miRNA的组织和疾病特异性表达模式表明它们作为诊断和预后癌症生物标志物和治疗工具的潜力,其在包括肝癌、胰腺癌、结肠癌、乳腺癌、胃癌在内的多种癌症中均有过表达[14,15],如21q21区域转录的miR-3a在肾细胞癌(RCC)中失调[16]。肝癌表达的调控因子,如microRNAs(miRNAs),一种内源性小分子(长度约为22个核苷酸)非编码和功能RNA,可调控许多基因的表达,可能对肝细胞肝癌进展有深远影响[17]。有证据表明[18-20],miRNAs的异常表达存在于多种癌症中,且作为抑癌基因或癌基因发挥作用,对肿瘤细胞增殖和侵袭性转移有影响。本研究利用miR-3a转染肝癌细胞系A549细胞,在miR-3a转染后,实时定量PCR和免疫印迹分析结果表明CHD1L mRNA和蛋白表达水平降低,细胞流式细胞仪测定结果表明肝癌细胞的存活率降低,MTT及Transwell检测结果表明肝癌细胞增殖和侵袭能力下降,说明miR-3a转染在体外可能通过CHD1L的负调控抑制肝癌细胞的生长增殖、迁移和侵袭。
综上所述,miR-3a可能通过靶向CHD1L抑制肝癌细胞的生长增殖、迁移和侵袭,从而在肝癌的发生发展中发挥关键作用。miR-3a可能是一种新的且极具有潜在的治疗价值的治疗肝癌的候选策略。本研究为了解肝细胞肝癌的发病机制及治疗策略提供了新的视角。

