三棱饮片薄层色谱鉴别及其总黄酮的含量测定
蒋立勇 董学 钟方晓 李克明 张会敏


【摘 要】 目的:提高三棱饮片薄层鉴别的专属性和可靠性,建立三棱饮片总黄酮的含量测定方法。方法:运用系列薄层色谱法和紫外可见分光光度法分别对不同产地的三棱饮片进行薄层色谱和总黄酮含量的研究。结果:在2015版《药典》的薄层展开条件下,三棱饮片在紫外光下仅能观察到一组荧光斑点,且这些斑点由于各自产地的不同,强弱有明显不同,难以对其质量真伪优劣进行定性鉴别,而使用优化后的薄层展开方法,可显现多组与对照药材溶液相同的斑点,且这些斑点更为清晰,更具有代表性,能够更好地鉴别三棱饮片。同时通过紫外可见分光光度法建立了三棱饮片的总黄酮含量的测定方法。结论:使用优化后的薄层展开方法能够更好地鉴别三棱饮片;运用紫外可见分光光度法可以快速测定三棱饮片中总黄酮的含量。
【关键词】 三棱饮片;总黄酮;薄层色谱;紫外分光光度法;含量测定
【中图分类号】R284.1 【文献标志码】A 【文章编号】1007-8517(2020)19-0056-06
Abstract:Objective To improve the specificity of the identification of Sparganii Rhizoma, and establish a method for its content determination.Method The thin-layer Chromatography (TLC) and the total flavone content of RHIZOMA SPARGANII from different producing areas were studied by serial Thin layer chromatography and uv-visible Spectrophotometer respectively.Results Only one group of fluorescent spots could be observed in the 2015 edition of Pharmacopoeia under the condition of thin-layer deployment, and the spots were obviously different in strength due to their different producing areas, it is difficult to qualitatively distinguish the quality of the crude drug from its adulterant, and the optimized thin layer deployment method can show the same spots in many groups as in the control solution, and these spots are clearer and more representative, can Be better identification of Trigonella decoction pieces. Meanwhile, a method for the determination of total flavonoids in Rhizoma SPARGANII was established by ultraviolet-visible Spectrophotometer.Conclusion The optimized TLC expansion method can be used to identify Radix Sylvestris, and the content of total flavonoids can be determined quickly by UV-vis spectrophotometry.
Key words: Sparganii Rhizoma; Total Flavonoids; Thin-layer Chromatography; Ultraviolet-visible Spectrophotometry; Content Determination
三棱為黑三棱科黑三棱属植物黑三棱Sparganium stoloniferum(Graebn.)Buch.的干燥块茎[1],主要分布于我国东北、黄河、长江中下游流域,野生资源较为丰富。其味苦、性平,入肝、脾经,具有破血行气、消积止痛等功效,用于癥瘕痞块、瘀血经闭、食积胀痛。三棱中含有的化学成分有黄酮类、挥发油类、皂苷类[2-4]等。现代药理研究表明三棱总黄酮具有较强的抗血小板聚集[5]、抗血栓和镇痛[6]作用并且具有抑制肿瘤细胞A549、MCF-7、宫颈癌Hela细胞的细胞增殖活性等作用[7]。目前,2015版《中国药典》仅仅规定了三棱饮片的性状,对薄层鉴别、水分和浸出物进行了考察,没有进行含量测定研究。在国内外研究报道中,张建中等[8-9]对三棱饮片的薄层色谱和总黄酮含量也展开了一定的研究,但研究内容还不够完善,薄层展开方法以及结论还不够详实。因此,本研究在此基础上运用系列薄层色谱法对16批不同产地的三棱饮片进行研究,优化三棱饮片的薄层鉴别方法,完善和提高三棱饮片薄层鉴别的准确性与可靠性,同时运用紫外可见分光光度法分别对三棱饮片中的总黄酮含量进行研究,建立三棱饮片总黄酮的含量测定方法。
1 仪器与材料
1.1 实验仪器 939薄层制板器(重庆市南岸贝尔德仪器技术厂), ZX-002紫外分光光度计(日本岛津),FW177型粉碎机(天津市泰斯特仪器有限公司)
1.2 实验材料 芦丁对照品(中国食品药品生物制品检定研究院,批号100080-200306),三棱对照药材(中国食品药品生物制品检定研究院,批号121521-201504),乙醇(分析纯,天津市富宇精细化工有限公司),亚硝酸钠(分析纯,天津市博迪化工有限公司),硝酸铝(分析纯,天津市博迪化工有限公司),氢氧化钠(分析纯,国营山东单县有机化工厂)。
三棱饮片来自于各大药店和药材市场。经钟方晓研究员鉴定为黑三棱科黑三棱属植物黑三棱Sparganium stoloniferum(Graebn.)Buch.的干燥块茎,其饮片如图1所示,具体来源见表1。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 供试品溶液及对照药材溶液的制备 取本品粉末(过60目筛)1.0 g,加甲醇3 mL,浸泡过夜,取上清液作为供试品溶液。另取三棱对照药材1.0 g,同法制备对照药材溶液。
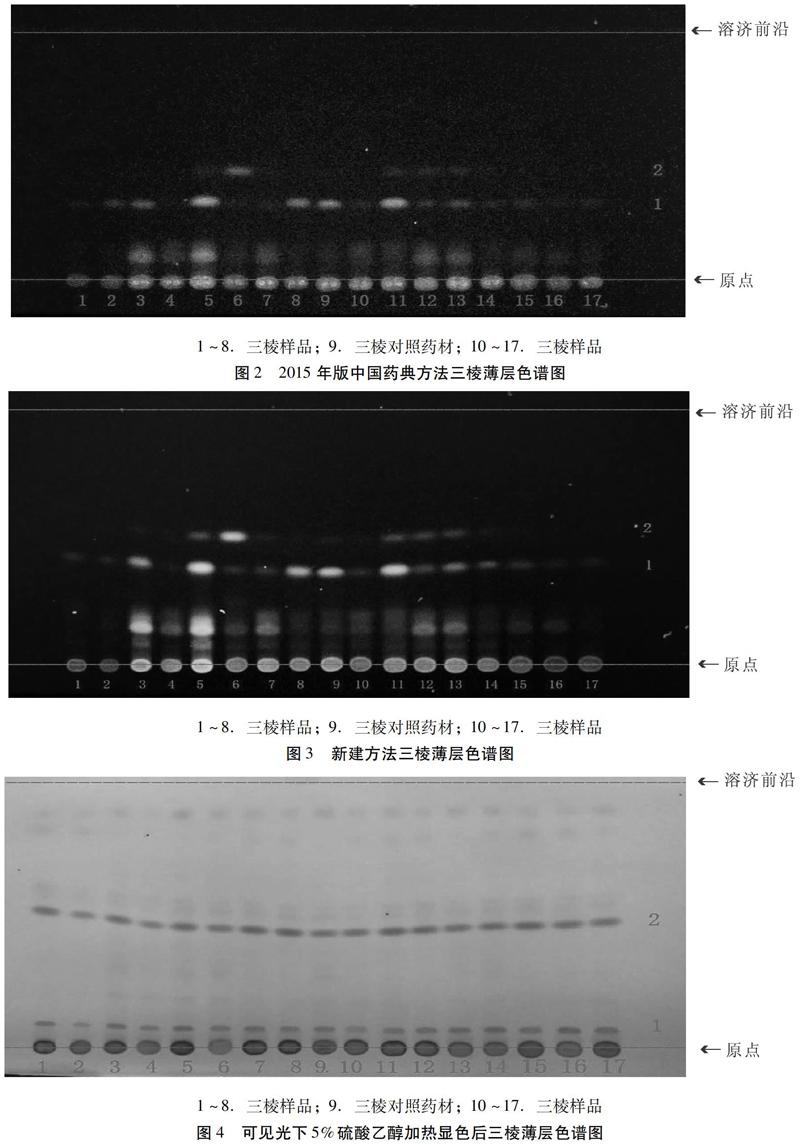
2.1.2 药典薄层鉴别方法 吸取供试品溶液及对照药材溶液各5 μL,以样品1~8、9(三棱对照药材)、10~17为点样顺序,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以石油醚:乙酸乙酯(v∶v=4∶1, 60~90 ℃)为展开剂,饱和30 min,展开,取出,晾干。置紫外光灯下(365 nm)检视,如图2所示。
由圖2可知,15个样品溶液(4号样品溶液除外)在与对照药材溶液相同位置均有一组相同的蓝色荧光斑点1(Rf值0.33),这些斑点强弱差异较大,1、2、6、7、10、12~17斑点较弱,4号样品未发现该荧光斑点,按照药典的展开条件这些样品可能鉴别为劣药甚至假药,为了提高鉴别的准确度,有必要对三棱饮片进行系列薄层色谱研究,来寻找更优的三棱饮片薄层鉴别方法。
2.2.3 优化后的薄层色谱方法 吸取供试品溶液及对照药材溶液各5 μL,以1~8、9(三棱对照药材)、10~17为点样顺序,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上,以石油醚:乙酸乙酯:甲酸(v∶v∶v=3∶1∶0.1,60~90 ℃)为展开剂,饱和30 min,展开,取出,晾干。置紫外光灯下(365 nm)下检视,如图3所示。再喷以5%硫酸乙醇,热风吹至斑点清晰,在可见光下观察,如图4所示。再次置紫外光灯下(365 nm)检视,如图5所示。
由图3可知,在石油醚:乙酸乙酯:甲酸(v∶v∶v=3∶1∶0.1,60~90 ℃)展开条件下,紫外灯下直接观察,除4号样品溶液外,其余15个样品溶液在与对照药材溶液相同位置均有相同的蓝色荧光斑点,但斑点颜色强弱差异较大;由图4可知,在可见光下,16个样品溶液与对照药材溶液在相同位置有两个相同的红色斑点1(Rf值0.05)和2(Rf值0.46),且斑点强度相近;由图4可知,1(Rf值0.05)、3(Rf值0.46)、4(Rf值0.50)、5(Rf值0.52)、7号斑点(Rf值0.90)为16个样品溶液和对照药材溶液的共有斑点,且荧光强度接近;2号斑点(Rf值0.38)为药典条件下所观察的荧光斑点,样品溶液与对照药材溶液荧光斑点颜色强弱差异较大;6号斑点(Rf值0.85)为15个样品溶液的共有斑点(4号样品溶液除外),但对照药材溶液没有。
由上述研究可见,按照药典薄层方法得到的信息量较少,无法准确的鉴别出三棱饮片的质量真伪优劣,可能会得出错误的结论,而采用改良后的薄层展开方法后,至少存在5个以上共有斑点,可以通过这些共有斑点快速准确的综合评价三棱饮片的真伪优劣。
2.2 三棱饮片总黄酮的含量测定[10]2.2.1 对照品溶液的制备 精密称取在120 ℃干燥至恒重的芦丁标准品5.22 mg,置 50 mL容量瓶中,加60%乙醇适量,采用超声处理,使其溶解,放冷,加60%的乙醇至刻度,摇匀,即得(每1 mL中含芦丁0.1044 mg)。
2.2.2 测定波长的确定 精密量取6 mL芦丁对照品溶液,置于25 mL容量瓶中,加水6 mL,加5%亚硝酸钠溶液1.0 mL,摇匀,放置6 min;加入10%硝酸铝溶液1.0 mL,摇匀,放置6 min;加入4%氢氧化钠试液5 mL,再加至刻度,摇匀,放置15 min。以不加芦丁对照品同上法平行操作的相应溶液为空白对照,进行240~600 nm全波段扫描。结果显示,在500 nm 处有最大吸收波长,故选择波长500 nm 处进行含量测定。
[JP+1]2.2.3 标准曲线的制备 精密量取芦丁对照品溶液2 、4 、6 、8 、10 、12 mL,分别置25 mL量瓶中,后按2.2.2的方法制备样品,以不加芦丁对照品同上法平行操作的相应溶液为空白对照,在最大吸收波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,再用最小二乘法进行线性回归,以吸光值对浓度进行线性回归分析, 求得回归方程为A=0.1062C-0.0053(R2=0.9995),表明芦丁对照品溶液浓度在0.008~0.050 mg·mL-1范围内与吸光度呈良好的线性关系。
2.2.4 提取条件的选择
2.2.4.1 乙醇浓度的选择 精密称取三棱粉末(5号样品)1.0 g,平行称定3份,分别置于100 mL锥形瓶中,精密加入25 mL不同浓度的乙醇(第1份40%乙醇,第2份60%乙醇,第3份80%乙醇),后按2.2.2的方法制备样品,在最大吸收波长处测定吸光度。 由表2可见,用60%乙醇提取后总黄酮含量最高,故选用60%乙醇溶液提取。
2.2.4.2 提取时间及提取方法的选择 精密称取三棱粉末(5号样品)1.0g,平行称定4份,分别置于100 mL锥形瓶中,精密加入25 mL的60%乙醇,称重,其中两份样品溶液超声提取,另两份加热回流提取,测定吸光度。由表3可见,回流提取的总黄酮含量高于超声提取的,但回流1 h与回流1.5 h差距不大,故选加热回流1h为提取方法。结果表明,以60%乙醇溶液,加热回流提取1 h为最佳提取工艺。
2.2.5 供试品溶液的制备 精密称取三棱粉末(3号样品)1.0 g,置于100 mL锥形瓶中,精密量取60%乙醇25 mL,称重,加热回流提取1h,放冷后,用60%乙醇溶液补足损失的重量,过滤,滤液为供试品溶液。
2.2.6 精密度试验 精密量取芦丁对照品溶液6 mL,置25 mL量瓶中,按照2.2.3的方法,自“各加水6 mL”起依法测定吸光度,连续测6次,按吸光度计算标准偏差(SD)为0.000471,相对标准偏差(RSD)为0.173%。
2.2.7 稳定性试验 精密量取供试品溶液5 mL,置25 mL量瓶中,按照2.2.3的方法,自“各加水6 mL”起依法测定吸光度,分别测定显色后放置10、20、30、40、50、60 min 供试品溶液的吸光度,按吸光度算得其在1 h内标准偏差(SD)为0.005,相对标准偏差(RSD)为3.00%。
2.2.8 重复性试验 精密称取6份同一袋样品各1.0 g,按照2.2.5的方法平行操作制备6份供试品溶液,分别精密吸取6份供试品溶液各5 ml,置25 mL量瓶中,按照2.2.3的方法,自“各加水6 mL”起依法测定吸光度,按含量计算相对标准偏差(RSD)为2.49%。
2.2.9 加样回收率试验 称取已知含量的样品约0.50 g,精密称定,平行6份,分别加入一定量的芦丁对照品,按2.2.5制得供试品溶液。精密量取供试品溶液5 mL,置于25 mL锥形瓶中,按照2.2.3的方法,自“各加水6 mL”起依法测定吸光度。用实值除以理论值计算回收率,再计算平均回收率与相对标准偏差(RSD)。算得平均回收率为98.9%,RSD为1.49%。表明该含量测定方法的误差以及操作过程的损失较小,可靠性较高。
2.2.10 三棱中总黄酮的含量测定 精密称取本品粉末1.0 g,置100 mL锥形瓶中,精密加入60%乙醇25 mL,浸泡,称重,加热回流提取1 h,放冷,60%乙醇补足损失重量,摇匀,滤过,滤液为供试品溶液。精密量取供试品溶液5 mL,置25 mL容量瓶中,按照2.2.3的方法,测定吸光度,计算供试品中总黄酮的含量(mg·g-1),再按含量计算均值,结果表4。
16批三棱药材总黄酮的平均含量为3.75 mg·g-1。最低含量为2.43 mg·g-1,最高含量为5.25 mg·g-1。
3 结论
通过实验可知,在石油醚-乙酸乙酯-甲酸(3∶1∶0.1)的展开条件下,可显现5组与对照药材溶液相同的共有斑点,且这些斑点更为清晰,更具有代表性,可用于三棱饮片的快速鉴别。在2015版《中国药典》的薄层展开条件下,三棱饮片在紫外光下仅能观察到一组荧光斑点,而本实验建立的方法,在紫外光下5%硫酸乙醇加热显色后三棱薄层色谱图显示7组荧光斑点,斑点多且清晰,专属性强。运用紫外可见分光光度法可以快速测定三棱饮片中总黄酮的含量。
参考文献
[1]中华人民共和国药典委员会.中国药典(一部)[M].北京:北京化学工业出版社,2015:13-14.
[2]冯娅茹,张文婷,李二文,等.三棱化学成分及药理作用研究进展[J].中草药,2017,48(22):4804-4818.
[3]董学,王国荣,姚庆强.三棱的化学成分[J].药学学报,2008(1):63-66.
[4]王新胜,吴启南,陈广云,等. 三棱化学成分与质量评价的研究进展 [J].中国药房,2013,24(15):1417-1420.
[5]陆兔林,叶定江,毛春芹,等.三棱总黄酮抗血小板聚集及抗血栓作用研究[J].中成药,1999,21(10):511-513.
[6]孙杰,王芍,郭斌,等.三棱黄酮体外诱导 A549 及 MCF-7 细胞 S/G_2周期停滞的研究 [J].天然产物研究与开发,2011,23(2):224-227,282.
[7]孙杰,王芍,郭斌,等.三棱黄酮抗HeLa宫颈癌:降低分裂期细胞比率诱导细胞凋亡[J].食品科学,2011,32(1):210-214.
[8]王恒,李伟东.三棱薄层色谱鉴别及总黄酮的含量测定[J].成都中医药大学报,2016,39(1):10-14.
[9]张建中,徐菲菲,陈小燕,等.中药三棱的总黄酮提取工艺研究[J].泰州职业技术学院学报,2016,16(1):58-60.
[10]张先洪,毛春芹,陆兔林,等.三棱饮片质量标准研究[J].时珍国医国药,2010,21(6):1384-1385.
(收稿日期:2020-05-09 編辑:刘 斌)

