白桦BpbZIP1 基因抗旱耐盐分析及ABRE 元件结合鉴定
郭依萍,石晶静,周美琪,于 颖,王 超
(林木遗传育种国家重点实验室,东北林业大学,黑龙江 哈尔滨 150040)
持续恶化的自然环境使得植被不断受到各种各样的非生物胁迫导致生物量不断减少。对基因工程研究的不断深入,使科研人员对植物在抗性方面的研究取得了显著成就。与植物抗逆相关的基因主要包括可以编码渗透压物质的基因、抗氧化基因、编码保护生物大分子及膜结构蛋白质的基因、编码转录因子的调节基因以及编码可在逆境中诱导的植物蛋白激酶基因[1]。
碱性亮氨酸拉链转录因子(bZIP)普遍存在于真核生物当中,参与多种生物学功能,如植物的生长[2]、损伤修复[3]、逆境胁迫的抵御[4-9]以及病菌的防御[4-5]。
bZIP 转录因子结构域含有大约60 到80 个氨基酸残基,由一个16 至20 个保守氨基酸残基组成的碱性氨基酸区和一个亮氨酸拉链共同组成[10]。保守的碱性氨基酸区含有核定位的信号序列,紧随其后的是DNA 的识别区域, 该区域可以与特异的DNA 序列相互作用。亮氨酸拉链区是一个具有两亲性的α 螺旋[11],α 螺旋中,每个重复的七肽都包含一个亮氨酸或者其他的疏水残基。该螺旋结构参与bZIP 蛋白与DNA 结合之前的二聚体化[12]。植物的bZIP 转录因子主要存在于细胞核中[13]。
干旱和高盐等条件下,bZIP 转录因子可以与ABFs 和AREBs 结合,从而调控下游的靶基因,ABFs 是元件ABRE 的结合因子,AREBs 是元件ABRE 的结合蛋白,其核心序列为ACGT。拟南芥的抗逆相关基因ICK1、rd29B、rab18、KIN2/KAT2、ADH1、CHS、racS、SUS1 的启动子区域都发现了ABRE 顺式作用元件[14]。Choi 等第一次克隆了拟南芥中的bZIP 转录因子,主要包括参与低温应答反应的ABF1、参与高盐、干旱等逆境应答反应的ABF2/AREB1、ABF3以及ABF4/AREB2[15]。大豆中鉴定了10 个亚家族共131 个bZIP基因,其中,有近三成bZIP基因可以响应高盐干旱等逆境胁迫[16]。Liao 等选取其中的4 个GmbZIP基因的过表达载体转入拟南芥中,发现其均能对逆境胁迫产生相应的应答[17]。Xiang 等鉴定出了水稻中的bZIP基因OsbZIP23,该基因可以显著提高水稻中的耐旱、耐盐性[18]。Kranner 等将bZIP 家族中的ThbZIP1基因的过表达载体转入烟草中,可以提高烟草的部分保护酶(超氧化物歧化酶(SOD)和过氧化物酶(POD))的活性,以此减少活性氧的数量来有效的克服逆境环境[19]。
白桦(Betula platyphyllaSuk)作为东北地区重要的绿化及用材树种,鉴定重要抗旱耐盐基因,研究分子调控机制,具有重要的理论及应用价值。本研究克隆白桦bZIP 转录因子,验证抗旱耐盐功能,为研究白桦抗非生物胁迫性状形成的的分子基础研究及抗性分子育种提供理论数据和研究材料。
1 实验材料和方法
1.1 实验材料
白桦组培苗培养于东北林业大学林木遗传育种国家重点实验室组织培养室,温度为25℃,光周期为12 h 光照/12 h 黑暗,光照强度 400 μmol·m-2·s-1。白桦的野生型无菌幼苗作为RNA 提取和过表达载体的瞬时转化材料。pROKⅡ载体和大肠杆菌(Escherichia coli)Top10、根瘤农杆菌(Agrobacterium tumefaciens)EHA105 由实验室保存。
1.2 实验方法
1.2.1 基因克隆及过表达载体构建 RNA 提取试剂盒(Takara,大连)用于提取白桦的总RNA;利用反转录试剂盒(Takara,大连)合成cDNA 第一链。通过白桦基因组分析及拟南芥抗性bZIP基因同源比对, 确定白桦bZIP基因序列。 利用pROKⅡ质粒的和白桦BpbZIP1基因序列设计引物,其中,pROKⅡ载体SmaⅠ同源序列用下划线表示出来,如下:bZIP-pROKⅡF′,5′-CTCTAGAGG ATCCCGACAGACCCACCGGGCGATG-3′和bZIP-pROKⅡR′,5′->TCGAGCTCGGTACCCCAACGCT AACACCTCCAGCT-3 ′( 金 唯 智 , 江 苏 ) 。 以cDNA 为模板扩增,反应体系如下:正向引物与反向引物各1 μL、模板2 μL、dNTP 4 μL(2.5 mmol·L-1,Takara, 大连)、TransTaqTaq DNA Polymerase High Fidelity( 2.5 U·μL-1) 0.5 μL、 Buffer 5 μL、去离子水36.5 μL,为50 μL 体系。PCR 的反应程序为94℃预变性3 min,94℃变性30 s、58℃退火30 s、72℃延伸90 s、共35 个循环,72℃延伸10 min。利用琼脂糖凝胶电泳进行检测,用胶回收试剂盒(Takara,大连)回收,将回收产物连接到pROKⅡ载体,转入大肠杆菌Top10,通过筛选送至金唯智测序公司进行DNA 测序。
1.2.2 植物工程菌株的制备 采用液氮法将BpbZIP1-pROKⅡ质粒转入农杆菌中,通过阳性筛选后保存于-80℃的冰箱中备用。
1.2.3BpbZIP1基因生物信息学分析 根据已发表文献从拟南芥bZIP 每个亚家族中共选取46 个拟南芥bZIP 蛋白[20],从NCBI 网站(http://www.ncbi.nlm.nih.gov/)中查找6 个柽柳bZIP 蛋白,根据BpbZIP1 蛋白序列信息用MEGA5.0 软件进行进化树分析。用BioEdit 软件进行多序列比对分析。
1.2.4BpbZIP1基因GFP 融合表达载体亚细胞定位 利用基因枪介导瞬时转化法将融合表达载体BpbZIP1-PBI121-GFP 转化到洋葱表皮细胞中。使用激光共聚焦显微镜观察并照相。
1.2.5BpbZIP1基因对白桦的瞬时转化及表达检测瞬时转基因方法参照发表文献进行[21-22]。为检测基因是否在瞬时转化株系中表达,根据BpbZIP1基因序列信息设计定量引物,正向引物5′-TC CATGAACATGGACGAGCT-3′,反向引物5′-ATG CTGCCGCTGCGGCAAGC-3 ′ , 选 择 β-tubulin和ubiquitin( GenBank Ac. Num.: HO112154 and FG065618)作为内参基因。进行实时荧光定量PCR 分析[23],反应体系如下:上下游引物各 1 μL、模板2 μL、去离子水7 μL 和2×Power SYBR Green PCR master mix 10 μL(Toyobo Co.,Osaka,Japan)总体系为20 μL,3 次重复,反应程序为94℃预变性3 min,94℃变性12 s、58℃退火30 s、72℃延伸40 s、78.4℃读板1 s,共45 个循环,72℃延伸7 min。在Bio-Rad Hercules.CA.USA.上完成该反应。读数分析其数据,运用2-ΔΔCT方法进行相对表达量分析[24]。数据分析采用统计软件 SPSS17.0(SPSS Inc,Chicago,IL,USA)。利用独立样本T检验比较处理组和对照组的差异显著性。
1.2.6BpbZIP1耐盐抗旱功能分析
1.2.6.1 非生物胁迫下转基因白桦的组织化学染色 以瞬时转化过表达载体的植株为实验组,以瞬时转化空载体的植株为对照组,分别用水、200 mmol·L-1NaCl 溶液和200 mmol·L-1甘露醇溶液处理,培养48 h 后,剪取大小一致的叶片用于化学染色,利用二氨基联苯胺(DAB)、伊文思蓝(Evans blue)和氮蓝四唑(NBT)染色,检测其活性氧积累及细胞损伤程度。将剩下的植株液氮研磨用于其他生理指标的检测。
1.2.6.2 非生物胁迫下转基因白桦的生理指标分析 将液氮研磨后的样品用植物组织铜锌-超氧化物歧化酶(SOD)测定试剂盒(建成生物工程研究所,南京)测定转基因和对照株系SOD 活性。利用过氧化物酶(POD)测试盒(建成生物工程研究所,南京)测定转基因和对照株系POD 酶活。
1.2.7 结合元件分析 根据已发表数据选取ABRE顺式作用元件(ACGTGGC)作为主要研究对象,利用酵母单杂交实验[25-26]进行转录因子与ABRE元件及6 个突变元件的结合验证。
2 结果与分析
2.1 BpbZIP1 基因的克隆
通过白桦基因组数据分析及拟南芥抗性相关bZIP基因同源比对分析,鉴定了一条白桦bZIP基因,该基因完整的开放读码框(ORF)共有1 269个碱基,总共编码422 个氨基酸残基,将其命名为BpbZIP1。以野生型白桦cDNA 为模板,使用特异性的基因引物bZIP-pROKⅡF’和bZIP-pROKⅡR’,利用RT-PCR 对其进行克隆,扩增出含载体同源序列的大小的目的片段(图1)。目的片段连接到pROKⅡ载体上并转化至大肠杆菌中,选取阳性单克隆进行菌液PCR 验证,并进行测序,测序结果与序列一致,说明成功克隆获得BpbZIP基因。
2.2 BpbZIP1 基因的生物信息学分析
将BpbZIP1 蛋白序列与拟南芥和柽柳中多条蛋白序列进行比对,结果(图2)表明:BpbZIP1蛋白与拟南芥AtbZIP12、AtbZIP67、AtbZIP14 和AtbZIP27 进化关系较近,其中,与BpbZIP1 蛋白亲缘关系最近的AtbZIP12 蛋白在非生物胁迫中起到重要作用[27],推测出BpbZIP1 蛋白也可能具有抗逆作用。
将BpbZIP1 蛋白与进化树中进化关系较近的AtbZIP12、AtbZIP14 和AtbZIP27[20]进行多序列比对,结果(图3)表明:比对得出很多相似的保守区,用红色框标出,其中,含有碱性亮氨酸拉链域的用蓝色框标出。

图1 BpbZIP1-pROKⅡ载体菌液PCR 验证结果Fig. 1 PCR verification of BpbZIP1-pROKⅡ vector
2.3 氯化钠和甘露醇胁迫下BpbZIP1 基因的表达
为检测BpbZIP1基因是否对盐和旱胁迫应答,通过实时定量分析了白桦野生型中BpbZIP1基因在受到甘露醇和NaCl 胁迫不同时间梯度后的表达模式,结果(图4)表明:在NaCl 胁迫时,BpbZIP1基因在6、12 、24 h 时白桦体内的相对表达量相对较低,在胁迫48 h 时高度诱导表达;在甘露醇胁迫时,表达变化不明显。说明BpbZIP1基因响应NaCl 胁迫,干旱胁迫响应较弱。
2.4 亚细胞定位
用pBI121-GFP 质粒做为对照组,轰击洋葱表皮细胞后进行暗培养,利用激光共聚焦显微镜观察转化后洋葱表皮细胞,实验结果(图5)表明:对照在细胞膜以及细胞核内均含有绿色荧光,BpbZIP1-PBI121-GFP 只有在洋葱表皮细胞核中有绿色荧光的出现,与DAPI 核染色位置一致,说明BpbZIP1转录因子定位在细胞核中。
2.5 瞬时转基因白桦株系的获得
利用农杆菌介导的瞬时转化法,能够快速筛选鉴定基因功能。本研究将BpbZIP1-pROKⅡ表达载体瞬时转化白桦,利用实时荧光定量PCR 检测转基因效率,结果(图6)显示:在转基因白桦中,BpbZIP1基因的表达量明显高于野生型对照白桦植株,验证检测出的过表达的阳性株系用于之后的非生物胁迫相关实验。
2.6 BpbZIP1 转基因白桦抗旱耐盐性分析

图2 BpbZIP1 与其他物种bZIP 蛋白进化分析Fig. 2 Evolution analysis of BpbZIP1 and other bZIP proteins
2.6.1 非生物胁迫下转基因白桦的组织化学染色结果 在对白桦野生型进行BpbZIP1基因的瞬时转化之后,以转化pRKOⅡ空载体的白桦为参照,根据着色程度可以鉴别白桦细胞的损伤情况及活性氧积累,实验结果(图7)表明:在没有进行非生物胁迫(对照组)时,BpbZIP1 转基因株系和野生型对照(WT)基本着色浅且相互之间无明显差异,说明细胞损伤程度基本相同。在NaCl 和甘露醇胁迫下,白桦的着色不同程度的加深,BpbZIP1 基因的过表达株系叶片的DAB、NBT 和Evans blue 着色浅于野生型对照,说明转基因株系叶片在胁迫处理下,活性氧积累少于野生型对照,细胞损伤程度较低,可以初步证明BpbZIP1 基因能够提高转基因白桦的抗逆能力。
2.6.2 非生物胁迫下转基因白桦的生理生化指标分析
2.6.2.1 SOD 活性测定 从图8 可以看出:在NaCl和甘露醇的非生物胁迫下,转BpbZIP1基因株系和WT 的SOD 活性发生了变化,BpbZIP1 基因的过表达株系SOD 活性高于WT,说明BpbZIP1 转基因株系的胁迫抗逆能力较WT 的植株强。实验结果进一步表明,BpbZIP1 基因在白桦体内有一定的抗逆作用。
2.6.2.2 POD 活性测定 从图9 可以看出:在NaCl 和甘露醇的非生物胁迫下,BpbZIP1 转基因株系和WT 的POD 活性发生了变化,NaCl 胁迫下,BpbZIP1 基因的过表达株系POD 活性高于WT,甘露醇胁迫变化不明显,说明BpbZIP1 转基因植株在盐胁迫下,保护酶活性高于WT,转基因植株的耐盐能力在一定程度上有所提高。实验结果进一步表明,BpbZIP1基因在白桦体内有一定的耐盐作用。

图3 BpbZIP1 与bZIP 蛋白序列比对结果Fig. 3 Multiple alignment analysis of BpbZIP1 and bZIP protein sequences

图4 BpbZIP1 基因响应盐、旱胁迫分析Fig. 4 Analysis of BpbZIP1 Gene response to salt and drought treatments
2.7 BpbZIP1 与ABRE 元件结合分析
2.7.1 BpbZIP1-pGBKT7 载体转录激活检测 将BpbZIP1-pGBKT7 质粒和作为对照的pGBKT7 空载体转化Y2H 酵母感受态,将稀释后的菌液依次涂布在培养基SD/-Trp、SD/-Trp/-His/X-a-Gal、SD/-Trp/-His /-Ade /X-a-Gal 上,培养箱倒置培养(30℃/3 d)。BpbZIP1-pGBKT7 能在一缺培养基上生长,但是在二缺和三缺培养基上不生长。挑取一缺培养基上菌体加入到一缺液态培养基中震荡培养,将适量菌液接种在三缺培养基(含X-a-Gal)上,30℃培养后发现, BpbZIP1-pGBKT7 没有蓝斑出现(图10),说明BpbZIP1基因全长序列不具有转录激活活性。

图5 BpbZIP1 转录因子亚细胞定位Fig. 5 Subcellular localization of BpbZIP1 transcription factor
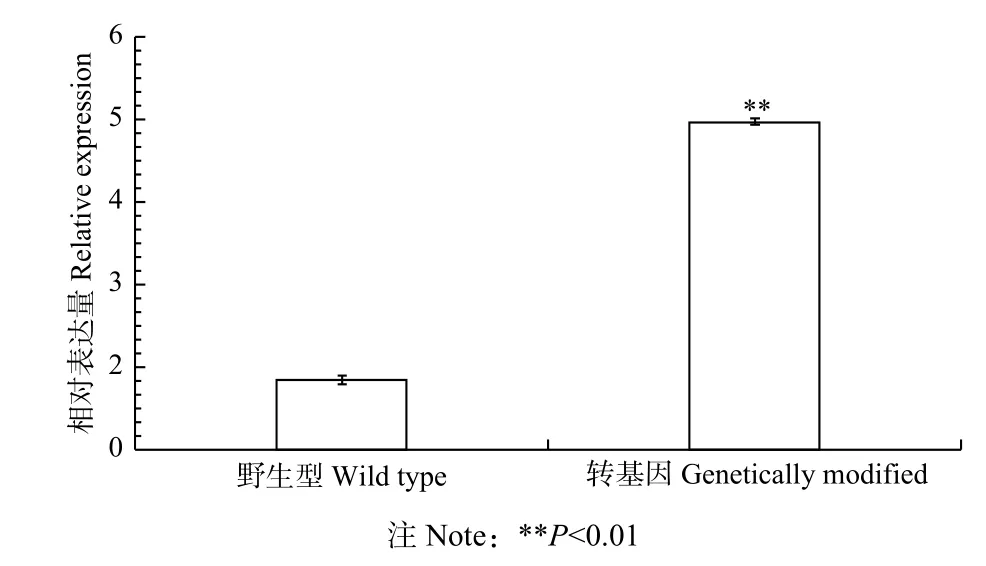
图6 过表达转基因白桦植株BpbZIP1 基因的表达量分析Fig. 6 Analysis of the expression levels of transgenic B.platyphylla plants

图8 非生物胁迫下转基因白桦株系SOD 活性分析Fig. 8 SOD activity of transgenic B. platyphylla lines under abiotic stress
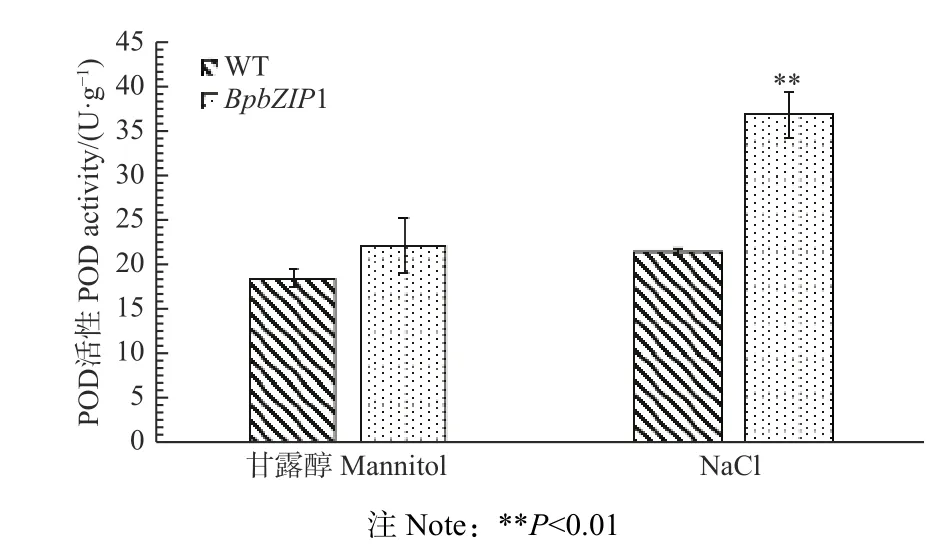
图9 非生物胁迫下转基因白桦株系POD 活性分析Fig. 9 POD activity of transgenic B. platyphylla lines under abiotic stress

图10 BpbZIP1 转录激活验证Fig. 10 Transcription activation verification of BpbZIP1
2.7.2 BpbZIP1 转录因子与ABRE 元件结合 将ABRE-pHIS2 和pHIS2-AM1-6 突变载体分别同BpbZIP1-pGADT7 载体共转化Y187 酵母细胞,在筛选之后将一缺培养基上的菌体于一缺液态培养基内震荡培养,后经不同稀释倍数后,依次接种于加入30 mmol·L-13-AT 的二缺和三缺培养基上,培养4 d后长出菌点。结果(图11)表明:在二缺培养基上除了阴性对照,ABRE 元件与其6 个突变元件长出正常的菌点,而三缺培养基(30 mmol·L-13-AT)上突变元件则无法长出菌点,表明BpbZIP1转录因子能够与ABRE 顺式作用元件结合。
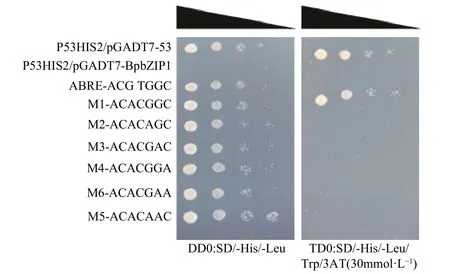
图11 BpbZIP1 与ABRE 元件结合分析Fig. 11 Binding analysis between BpbZIP1 and ABRE element
3 讨论
本研究鉴定的bZIP 转录因子,具有该家族结构域的典型特征[28]。系统进化和功能分析证实BpbZIP1基因与拟南芥亲缘关系相近的bZIP基因在非生物胁迫中起到相似的作用。BpbZIP1在NaCl胁迫了48 h 时表达量大幅上调,说明该基因能够响应盐胁迫;但盐胁迫后,该基因先下调后上调的表达模式,可能与植物适应外界环境以及自身保护机能的衰退有关[29]。在甘露醇胁迫时,BpbZIP1 表达变化则不明显,该基因的抗旱功能有待更多的试验证据来确定。
瞬时转化法是快速确定基因功能的有力工具[21-22]。本研究利用农杆菌介导的瞬时转化法,分析BpbZIP1 基因在白桦转基因株系中的耐盐抗旱能力。植物细胞中的H2O2能释放出氧化DAB 的氧离子,产生棕色的沉淀,细胞受损伤越严重,H2O2释放的量越多,染色的颜色也就越深,所以,可以根据颜色深浅判断细胞的损伤程度。本研究利用NaCl 盐和甘露醇处理模拟盐和干旱胁迫,分析转基因株系耐盐抗旱性[30],并进行了组织化学染色和生理指标检测,结果发现,转基因株系和野生型在活性氧积累和保护酶活性指标上发生了变化。实验结果显示,转基因株系受到胁迫后,过表达株系DAB 染色的颜色比野生型颜色浅,说明过表达株系中H2O2积累低于野生型。Evans blue 染色的颜色较野生型浅,说明转基因株系细胞损伤程度小。植物体的超氧化物歧化酶可以抑制氮蓝四唑(NBT)在光下的还原作用。NBT 染色结果也显示,转基因株系细胞内超氧离子的积累少于野生型。综上所述,组织化学染色结果显示:BpbZIP1基因的过表达株系较野生型受盐害程度低,BpbZIP1基因在白桦转基因体内起一定的抗逆作用。
保护酶能有效地保护植物细胞免受损伤[31]。SOD 和POD 是细胞内清除过量活性氧的重要酶促系统[32]。当植物受到胁迫时,体内的SOD 和POD含量增高,以便较快地清除植物体内的自由基,从而降低植物受伤的程度[33]。本实验中,保护酶活性分析同样印证了组织化学染色的结果。当植物受到甘露醇和NaCl 胁迫时,转基因植株中的SOD 和POD 含量都高于野生型,说明转基因植株受到胁迫时,细胞内保护酶含量增高,从而减少损伤。在转BpbZIP1 基因白桦体内,抗逆性可能是通过保护酶系统发挥作用的。相反,在甘露醇胁迫下,转基因植株所测定的各项指标都较野生型植株变化不明显。在基因表达分析结果中也显示,该基因受干旱胁迫诱导不明显,说明该基因主要具有耐盐功能。
bZIP 转录因子可以与抗逆相关的顺式作用元件(如ABRE 元件、G-box 元件以及w-box 元件)相互作用,调控下游基因的表达。本研究验证了BpbZIP1 能够与ABRE 顺式作用元件相结合,为研究白桦抗非生物胁迫性状形成的分子基础及林木抗性分子育种提供理论数据和研究材料。
4 结论
克隆获得白桦BpbZIP1 基因,该基因蛋白序列与已知抗性相关基因AtbZIP12 蛋白序列聚为一组,定位于细胞核中表达;BpbZIP1 基因受NaCl处理的诱导;BpbZIP1 基因能够通过清除活性氧,减轻细胞损伤来提高白桦瞬时转化株系的耐盐能力,抗旱能力不明显;BpbZIP1 能够与逆境相关ABRE 元件特异性结合。本研究鉴定出具有耐盐功能的白桦BpbZIP 转录因子及其结合元件,为进一步分析白桦bZIP 基因的耐盐分子调控机制及白桦耐盐分子育种提供基础数据和材料。

