超声引导下硬化治疗婴幼儿头颈部淋巴管畸形临床疗效分析
姜 磊,都晓英,李 阳,周 凯,孙医学
(1.蚌埠医学院第一附属医院小儿外科,安徽 蚌埠 233004;2.蚌埠医学院第一附属医院超声科,安徽 蚌埠 233004)
淋巴管畸形源于增生、结构紊乱的淋巴管,是先天性脉管发育畸形的一种,发病率1/4000~1/2000,50%~75%出生时即发病,80%~90%在2岁前确诊[1]。临床常以体表囊性质软包块为首发症状,或肿块不明显伴有囊内出血、感染,肿块短期内迅速增大并出现疼痛、发热症状。临床根据其组织形态学特点分为巨囊型、微囊型和混合型淋巴管畸形。该病可发生于身体任何部位,以头颈部最多见,其次为腋窝、纵隔和四肢。传统的治疗方式是外科手术完全切除病变,但常存在切除不彻底、易复发及严重的并发症等问题,特别是对于头颈部特殊部位,可能造成面部外观损害或重要神经血管损伤,降低生活质量,严重者可危及患者生命[2]。我们采用超声引导下介入硬化治疗婴幼儿头颈部淋巴管畸形58例,取得良好效果,现报告如下。
1 资料与方法
1.1 一般资料
2013-12—2020-06月蚌埠医学院第一附属医院小儿外科收治婴幼儿头颈部淋巴管畸形患儿58例,均采用超声引导下介入硬化治疗。其中男33例,女25例;年龄<1月18例,1月~<4岁21例,4~6岁19例;头面部12例,颈部46例;巨囊型18例,巨囊型伴出血感染7例,微囊型11例,混合型22例;临床表现为体表局部囊性包块或局部组织增厚,伴有出血者近期有突发颈部肿块体积增大表现,伴有出血感染者有局部红肿热痛或体温升高表现。B超或MRI检查确诊为淋巴管畸形。纳入标准:①年龄:出生后~6岁;②头、颈部局灶性淋巴管畸形;③患儿家属能够接受反复治疗2次及以上者;④术前检查无手术禁忌症。排除标准:全身多发或弥漫性病变。
1.2 治疗方法
1.2.1 术前准备
术前超声、MRI诊断明确。常规超声探查病变范围与周围神经、血管关系,标记病变区域。
1.2.2 麻醉
年龄<1个月的患儿在局部麻醉下行介入硬化治疗;年龄>1个月的患儿采取全身麻醉下介入硬化治疗。
1.2.3 操作步骤
①术前常规体检建立静脉通路;②麻醉后,患儿根据病变部位取平卧或侧卧位;③超声科医生及超声机器置于患者右侧,外科操作医生位于患者左侧,面向超声显示屏,通过B超全程监控进针路径;④配置硬化剂:平阳霉素8 mg+生理盐水3 mL,用量0.2~0.4 mg·kg-1;聚桂醇按1∶4与空气混合配成泡沫;99.7%无水乙醇;⑤术中根据病情选用7F猪尾管、深静脉穿刺针、5 mL注射器针头,操作全程监视进针路径和针尖到达的位置;对于巨囊型淋巴管畸形患儿,采用7F猪尾管置入囊腔,可最大限度抽吸囊液,99.7%无水乙醇反复冲洗硬化囊壁2~3遍至液体澄清,再注入并保留泡沫硬化剂;对于多房型淋巴管畸形患儿,予以抽脂样操作破坏囊壁,再根据术中冲洗判断各房之间是否相通,若不相通则行多点多房穿刺硬化;对于微囊型淋巴管畸形患儿,选取较大囊泡注射聚桂醇泡沫,超声监视下可见含气样药物弥散范围,若弥散局限,则多点注射,保留硬化剂于囊腔或组织间隙内;⑥伴有感染发热者,抽吸囊液,生理盐水反复冲洗囊腔至液体清澈,留取囊液培养+药敏,术后抗炎治疗,暂不行硬化治疗;⑦伴有囊内暗红色血性液体者,抽吸囊液并生理盐水冲洗后,留置泡沫硬化剂。
1.2.4 术后处理
术后观察患儿神志、呼吸、体温、局部皮肤颜色等。1月后复查彩超,行第二次硬化治疗,若硬化效果显著可3月后再进行复查。
1.3 疗效标准
显效:肿块基本消失,查体不能触及;有效:瘤体缩小50%以上;无效:瘤体缩小<50%或治疗后复发。总有效=显效+有效。
2 结 果
所有患儿治疗1~3次,术后随访3个月~3年,总有效率91.4%,其中显效36例(巨囊型21例,混合型15例),有效17例(巨囊型4例,混合型7例,微囊型6例),无效5例(微囊型)。术后4例出现出血(巨囊型2例,混合型2例),红肿伴发感染5例(巨囊型3例,混合型2例),面神经水肿致口角歪斜5例(巨囊型),均行保守治疗好转,未出现严重皮肤缺血坏死、神经不可逆损伤、过敏等并发症。
3 典型病例
3.1 病例1
患儿男,生后10 d,主诉:发现左颈部肿物10 d。诊断:左颈部淋巴管畸形(巨囊型)。行B超引导下聚桂醇泡沫20 mL栓塞治疗1次,治疗3个月后,颈部病灶基本消失,随访期间病灶未见增大,复查B超未见明显瘤腔残留(图1)。
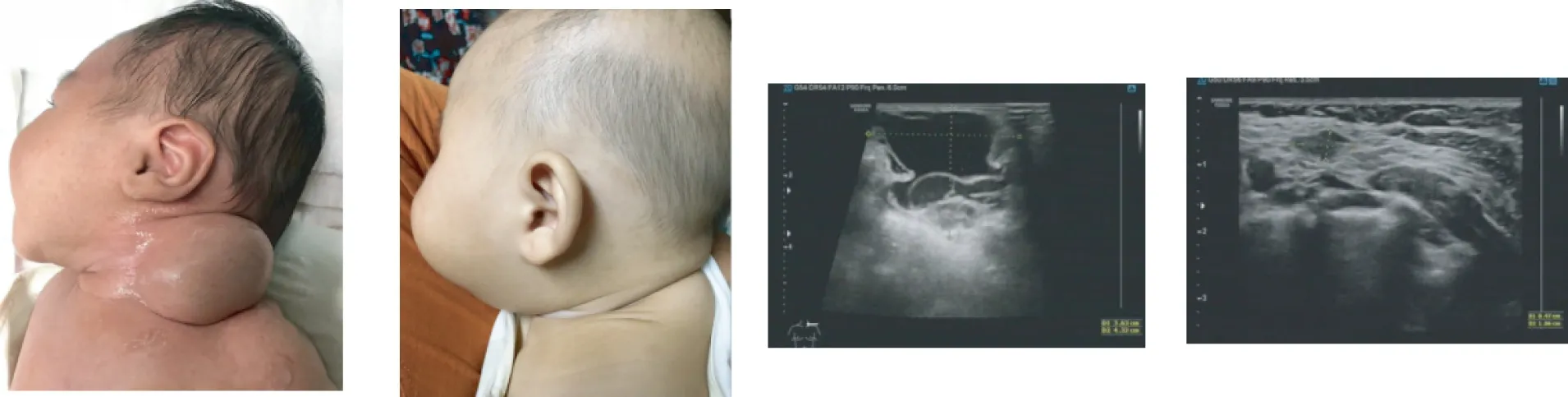
A 术前 B 术后3个月 C 术前超声 D 术后3个月超声
3.2 病例2
患儿男,8月余,主诉:发现左额部肿物逐渐增大8月余。诊断:左额部淋巴管畸形(微囊型)。行2次硬化治疗,第一次全麻下行B超引导下平阳霉素+聚桂醇泡沫栓塞治疗,第二次于1月后行聚桂醇泡沫栓塞治疗。治疗半年后复查,超声提示病灶基本消失,未见瘤腔残留(图2)。
4 讨 论
4.1 淋巴管畸形的特点
淋巴管畸形是先天性淋巴管发育异常的一种疾病,以往曾被称为“囊性水瘤”“淋巴管瘤”“淋巴管囊肿”。国际血管瘤和脉管畸形研究学会(ISSVA)于2014年修订了1996年制定的分类系统,根据淋巴管囊肿的大小分为巨囊型、微囊型和混合型淋巴管畸形[3]。以往的囊肿型归类为巨囊型淋巴管畸形,毛细管型、海绵型归类为微囊型淋巴管畸形,而淋巴血管瘤则归类为混合型淋巴管畸形。超声表现特征[4]:巨囊型淋巴管畸形在超声下常表现为多发单纯无回声区,囊内可见多条分隔,囊腔之间相通或不相通,分隔内膜薄且光滑;混合型淋巴管畸形超声表现为多个大小不等、以无回声为主的低回声及无回声区,囊内分隔厚薄不一且壁不光滑;微囊型淋巴管畸形超声表现相比前两者回声相对较强。合并感染及血管畸形时周边可表现出血流信号。
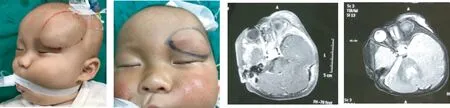
A 术前 B 术后1个月 C 术前T1增强序列 D术前T2加权序列
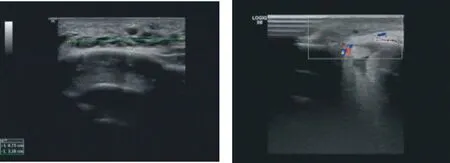
E 术前超声 F 术后6个月超声
4.2 淋巴管畸形的临床表现及诊断
临床症状大多较为典型,约50%患者出生时发现此病,大部分在婴幼儿期发病。最常见的病变部位在头、颈部,约占75%,其次是腋窝、纵隔及四肢。结合超声、MRI检查基本可以诊断,有疑虑者可行诊断性穿刺明确,抽出囊液为淡黄色或深黄色清亮的淋巴液,伴有出血时可抽出陈旧性血性液体,结合细胞学检查,可诊断淋巴管畸形伴囊内出血。
4.3 淋巴管畸形的治疗
淋巴管畸形是淋巴系统的良性病变,不同于血管畸形,很少自行消退,随患儿生长发育成比例生长。伴有囊内出血时,肿块会突然增大,手术是首选治疗方式。然而对于头颈部淋巴管畸形且年龄较小的患儿,手术创伤大,不易完全切除[5];且婴幼儿神经血管发育尚不完全,术中辨识度差,极易损伤重要血管神经;因术中精细操作,手术、麻醉时间可能超过2 h等因素,可造成术后严重脏器损害,甚至导致患儿死亡。随着对淋巴管畸形的深入认识,介入硬化的疗效被逐渐认可[6],该方法具有创伤小、风险小、住院时间短、恢复快、费用低等特点,缺点是可能需多次治疗。介入硬化治疗的药物有很多,常用的有博莱霉素、平阳霉素、无水乙醇、聚多卡醇和聚桂醇等。药理作用是通过破坏淋巴管壁上皮细胞,使之不再分泌囊液达到治疗目的[7]。博莱霉素与平阳霉素作用温和,属于抗肿瘤化疗药物,随使用剂量的增多引起肺纤维化的风险亦成比例增大。无水乙醇使用较早,硬化效果良好,局部刺激性大,一过性疼痛明显。聚多卡醇和聚桂醇是醇类提取物,最先用于静脉曲张病人的硬化治疗,又叫做“泡沫硬化剂”,后用于血管畸形和淋巴管畸形的硬化治疗[8],并取得良好效果,安全性高、不良反应少同时对局部有独特的微麻作用。本研究选取头、颈部淋巴管畸形年龄在6岁以内的患儿进行介入硬化治疗,主要应用的药物为无水乙醇、聚桂醇和平阳霉素。介入硬化过程中借助超声引导,实时监控操作过程中针尖的位置,避免直接损伤血管神经,同时可通过调整针尖方向将囊液完全抽吸干净。巨囊型淋巴管畸形囊腔较大,直接注射聚桂醇可能与囊壁接触面积不完全,降低治疗效果[9],在抽空囊液后,抽取囊液等量的无水乙醇注入囊腔后迅速抽吸干净,反复冲洗数次,可最大程度减轻无水乙醇的刺激,同时也达到破坏囊壁上皮细胞的作用,最后留置聚桂醇于囊腔。对微囊型淋巴管畸形采用聚桂醇泡沫,泡沫硬化剂在超声下表现为强回声,注入后可见强回声呈片状弥散,提示各微囊泡之间相通,不相通的其余部分采用多点注射[10]。值得注意的是注射后观察到药物弥散的强回声面积明显大于术前超声诊断的范围,提示手术治疗淋巴管畸形应扩大切除范围,可减少复发[11]。
综上,B超引导下介入硬化治疗婴幼儿头颈部淋巴管畸形治疗效果确切,相对安全,不良反应少,值得临床推广。

