调节性T细胞在布鲁氏菌感染中的变化特点研究
刘 熔,王昌敏,郝立君,卢佩佩,李智伟
布鲁菌病是全球最常见的人兽共患病之一[1]。布鲁氏菌导致的感染如得不到及时诊断和规范治疗常会导致慢性化,有时甚至是终身的。目前关于布鲁菌病转变为慢性状态的原因仍不明确。T细胞介导的细胞免疫在布鲁氏菌感染中发挥关键作用[2]。Treg细胞是发挥免疫抑制的重要细胞,可以预防感染过程中的免疫病理损害和抵御过度活跃的免疫反应对宿主的伤害,Foxp3是Treg细胞的转录因子,IL-10是Treg 细胞分泌产生的一种重要的抗炎免疫抑制细胞因子[3]。本文通过流式细胞术,荧光定量PCR和Aimplex方法评估Treg细胞,Foxp3的mRNA表达及IL-10水平在布鲁氏菌感染中的变化特点和相关性。为布鲁菌病的免疫应答机制提供一定的理论依据,为布鲁菌病的治疗寻找新的治疗靶点。
1 材料与方法
1.1研究对象 收集2019年6-12月在新疆维吾尔自治区人民医院就诊并明确诊断为布鲁菌病的患者49例,其中急性期20例,慢性期29例,分别设立急性布病组和慢性布病组。纳入标准:符合WS 269-2019《布鲁菌病诊断》的标准,临床表现为发热、骨关节痛、全身乏力等,虎红平板凝集试验(RBPT)进行初筛阳性和试管凝集试验(SAT)检测血清中抗布鲁氏菌特异性抗体,滴度≥1∶50者。同期募集52例健康体检人群作为正常对照组,性别年龄与急、慢性布病组无统计学差异。3组人员均进行了虎红平板试验和试管凝集试验,急、慢性布病组发热时进行血培养检测。3组人员均排除肿瘤、伤寒、风湿热、结核、自身免疫病和其他各种感染等疾病的人员。所有人员均签署知情同意书,本研究经过新疆维吾尔自治区人民医院医学伦理学委员会批准,患者知情同意,批准号:KY201803742。
1.2仪器与试剂 美国BD FACS Canto plus流式细胞仪,美国Bio-Rad实时荧光定量PCR仪。美国BD的CD3 PerCP(552851,SP34-2),CD4 FITC(550628,L200),CD25 APC(555434,M-A251),CD127 PE(561028,HIL-7R-M21),溶血素(349202)。美国GE淋巴细胞分离液Ficoll-Paque密度梯度液(17-5442-02),北京全式金TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(AT311),凯捷T QuantiNava SYBR Green Kit(208054),爱信 Trizol试剂(abs9331)。
1.3 方 法
1.3.1样本处理 采集20例急性布鲁菌病患者、29例慢性布鲁菌病患者和52例正常对照组人群的全血标本,使用EDTA抗凝。分为3管,1管直接使用流式细胞仪检测Treg细胞表型和数量;1管用淋巴细胞分离液Ficoll-Paque密度梯度液(美国GE)依照说明书操作步骤提取PBMC,加入TRLZOL冻入-80 ℃低温冰箱保存,用于mRNA检测;另1管3 000 r/min离心5 min吸取上清转移至EP管,-80 ℃低温冰箱保存,用于IL-10检测。
1.3.2流式检测 吸取全血样本100 μL,分别加入CD3 PerCP 20 μL,CD4 FITC 20 μL,CD25 APC 5 μL,CD127 PE 20 μL。避光室温放置15 min,加入2 mL溶血素10 min后离心去上清,加入2 mL PBS洗涤离心去上清,加入500 μL PBS,重悬。上BD FACS canto plus流式细胞仪检测,使用FlowJo 10.0进行数据分析。
1.3.3荧光定量PCR检测 使用qRT-PCR检测Treg转录因子Foxp3的mRNA水平。将冻存的标本取出,依照说明书步骤反转录成cDNA。扩增体系条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共40个循环,结果用2-△△Ct相对定量法,分别对布鲁菌病组与正常对照组中的目的基因进行定量。引物序列由上海生工合成,FoxP3 5′-FGTGGCCCGGATGTGAGAAG-3′;FoxP3 5′-RGGAG-CCCTTGTCGGATGATG-3′;β-Actin-F-5′:CATGTACGTTGCTATCCAGGC-3′,β-Actin-R-5′-CT-CCTTAATGTCACGCACGAT-3′。
1.3.4IL-10检测 将冻存的EP管取出,依照Aimplex试剂盒说明书准备标准品和样品,使用BD FACS canto plus流式细胞仪检测荧光微球,保存流式细胞仪的FCS数据文件,并利用软件FCAP Array 3.0进行数据结果分析。
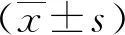
2 结 果
2.1研究对象概况 本研究共纳入急性布鲁菌病患者20例,年龄26~62岁,平均年龄44.3±8.7岁,慢性布鲁菌病患者29例,年龄22~71岁,平均年龄43.1±8.6岁。正常对照组52人,年龄25~72岁,平均年龄44.7±7.4岁。详见表1。
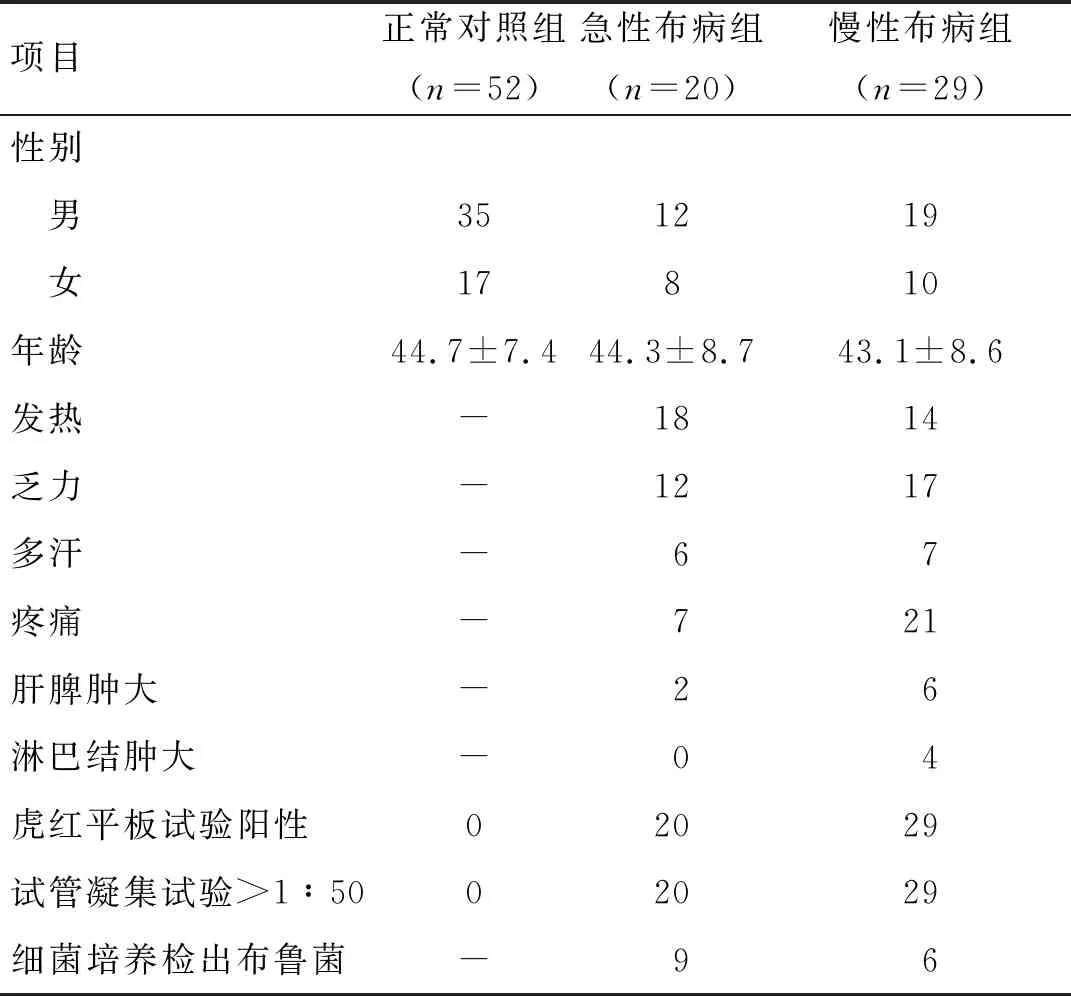
表1 急慢性布病组与正常对照组的基本资料
2.2流式细胞术检测Treg细胞 使用流式细胞术检测CD3+CD4+CD25+CD127low的Treg细胞数量与表型。结果见图1和表2,与正常对照组相比,急性布病组的Treg细胞比例增加,差异有统计学意义(t=2.87,P=0.01);慢性布病组Treg细胞比例显著增加,差异有统计学意义(t=10.82,P<0.01)。与急性布病组相比,慢性布病组Treg细胞比例显著增加,差异有统计学意义(t=4.96,P<0.01)。
表2 Treg、Foxp3和IL-10水平

注:A为正常对照组;B为急性布病组;C为慢性布病组。
2.3荧光定量PCR检测Foxp3 mRNA 使用qRT-PCR检测PBMC的Foxp3 mRNA水平。结果显示,与正常对照组相比,急性布病组的Foxp3 mRNA表达增加,差异有统计学意义(t=3.42,P<0.01);慢性布病组Foxp3 mRNA表达增加,差异有统计学意义(t=6.89,P<0.01)。与急性布病组相比,慢性布病组Foxp3 mRNA表达增加,差异有统计学意义(t=2.38,P=0.02),如图2和表2所示。
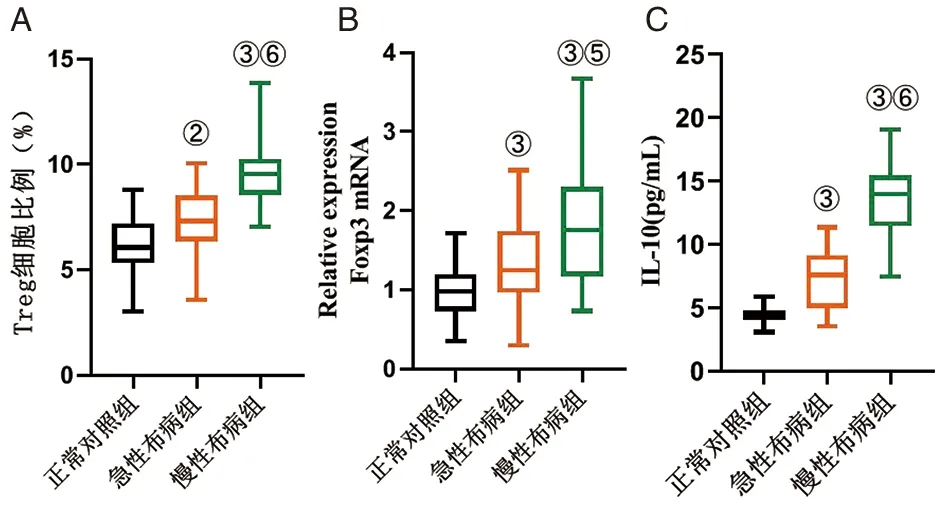
注:A Treg比例,B为Foxp3 mRNA相对表达水平,B为IL-10水平。 与正常对组相比:②P<0.05,③P<0.01;与急性布病组相比:⑤P<0.05,⑥P<0.01。
2.4IL-10水平检测结果 本研究使用Aimplex法检测外周血浆中的IL-10水平。结果表明,与正常对照组相比,急性布病组的IL-10水平增加,差异有统计学意义(t=7.90,P<0.01);慢性布病组IL-10水平增加,差异有统计学意义(t=21.42,P<0.01)。与急性布病组相比,慢性布病组IL-10水平增加,差异有统计学意义(t=7.64,P<0.01),如图2和表2所示。
2.5Treg细胞与Foxp3 mRNA,IL-10的相关性 分析布鲁菌病患者的Treg数量与Foxp3 mRNA表达水平的相关性以及Treg数量与IL-10表达水平的相关性。结果表明,Foxp3 mRNA和Treg数量呈正相关(R=0.72,P<0.01),IL-10水平与Treg数量呈正相关(R=0.71,P<0.01),如图3。
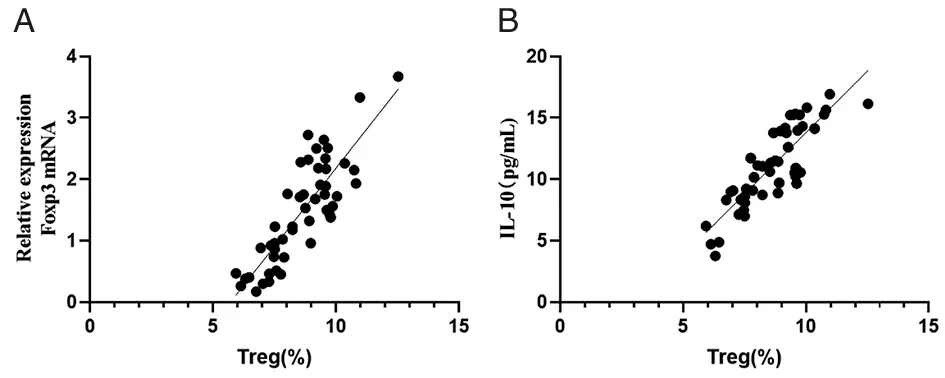
注:A为Foxp3与Treg相关性分析,B为IL-10与Treg相关性分析
3 讨 论
布鲁菌病慢性患者较多[4],免疫机制不清,给患者身体健康带来极大危害。布鲁氏菌作为胞内寄生菌,T淋巴细胞主导的细胞免疫在抵御布鲁氏菌感染中发挥关键作用[5]。宿主无法抵御布鲁氏菌长期感染的原因可能是由于适应性免疫反应减弱而导致。CD4+T细胞参与了适应性免疫应答的调节[6],可以通过分化成不同的亚型调节宿主的免疫应答,Treg细胞是一种具有免疫抑制活性的CD4+T细胞亚群,对于各种病理和生理学免疫应答的负调控至关重要。Treg细胞除了可抑制外部或自身抗原的过度免疫反应,还可防止多种自身免疫性疾病[7],最重要的是Treg细胞也与病原体感染和癌症相关的过度免疫反应的负向控制有关,在某些情况下可能对宿主有害,导致慢性感染[8]。布鲁氏菌慢性化程度较高的原因可能与Treg细胞数量增多有关[9]。本研究结果显示,在布鲁菌病患者的Treg细胞数量升高,慢性布病患者升高更为显著,Hasanjani等[10]也发现Treg细胞在布鲁菌病患者中显著增多的现象,动物实验发现在布鲁氏菌持续感染中Tregs细胞保持其抑制功能[11]。因此,研究结果表明Treg细胞参与了布鲁菌病的发生和发展。由于Treg细胞的增多可以有效抑制炎症反应,Treg细胞可以增加免疫细胞上的抑制性表面分子如B7的表达,并下调抗原提呈细胞功能,竞争性抑制APC细胞上的协同共刺激分子活化。Treg还能抑制NK细胞的增殖、细胞因子分泌和细胞毒作用[12]。Treg细胞上表达的CD25是IL-2的受体,可以有效抑制IL-2的生物学功能,而IL-2可以促进Th1细胞和NK细胞增殖活化[13]。因此,Treg细胞的这些生物学功能可能是导致布鲁氏菌持续感染的原因。
Foxp3是Treg细胞的转录因子,对于Treg细胞的发育和功能控制发挥关键作用[14],该转录因子已被认为是Treg细胞发育和功能的主开关或调节器。本研究结果发现Foxp3的mRNA水平在布鲁菌病患者特别是慢性患者中明显高于正常对照组,说明Foxp3在布鲁氏菌感染后出现上调,而Foxp3表达的高低变化代表了Treg细胞功能的强弱变化[15]。Foxp3通过直接或间接激活和抑制数百个基因来控制Treg细胞发育和发挥生物学功能。
IL-10和TGF-β是Treg细胞主要释放的2个发挥免疫抑制功能的细胞因子,以避免机体产生过度的免疫反应。我们的结果发现布鲁菌病组患者的血浆中的IL-10的水平明显高于健康对照组,并且IL-10的增高水平与Treg细胞数量呈正相关,这说明Treg细胞增多并上调IL-10水平来发挥抑制功能。Treg细胞通过产生IL-10来发挥负向调节效应T细胞的功能。Manuel RZ等[16]曾报道IL-10在布鲁氏菌持续感染中增高。我们前期也报道了布鲁氏菌感染者血清中TGF-β的水平也显著增高[17],结合本文发现的Treg细胞比例增加的情况,我们认为布鲁氏菌感染机体后,细菌会诱导宿主免疫应答向负向免疫发展,进而延缓宿主对布鲁氏菌的清除,最终导致布病迁延不愈。
我国北方农牧地区布鲁氏菌感染者较多,慢性患者众多。我们的研究显示Treg功能表达过度可能是布鲁氏菌发生持续感染的原因之一。布鲁氏菌感染后出现Treg细胞数量增多,Foxp3基因表达上调以及IL-10水平增高的现象,这些结果导致了布鲁氏菌免疫应答的有害作用。通过本研究我们认为布鲁氏菌感染机体后,布鲁氏菌会诱导宿主免疫应答向负向免疫发展,进而延缓宿主对布鲁氏菌的清除,最终导致布病迁延不愈。通过抑制Treg细胞或功能的免疫治疗手段已经尝试用于肿瘤等疾病的治疗[18]。因此,掌握布病持续感染时Treg的变化特点、了解Treg在布鲁氏菌中的作用,通过免疫手段抑制或阻断Treg数量和功能有望成为布病免疫治疗的潜在靶点,为控制布鲁氏菌持续感染带来新的思路。
利益冲突:无

