重组大肠杆菌产Indigoidine的发酵优化
孙菁兰 王华敏 才恒 王丽娟 唐巧巧 刘之毅 高强
摘 要:Indigoidine是一种无毒的微生物天然蓝色素。本研究利用重组大肠杆菌DH5α/pBT2-ET-idgS-sfp发酵生产Indigoidine,通过单因素实验优化发酵培养基中的复合氮源比例及含量和两阶段控制温度策略中的变温点。结果表明:优化后的发酵培养基(g·L-1):胰蛋白胨5,酵母浸粉10,氯化钠10,3-(N-吗啉)丙磺酸5。优化后的变温点为37 ℃培养7 h时变温至28 ℃,Indigoidine产量增加了3倍,从初始的0.35 g·L-1提高至1.4 g·L-1。
关键词:Indigoidine;培养基优化;变温发酵;大肠杆菌
Abstract:Indigoidine is a nontoxic microbial blue pigment. In this work, indigoidine was produced by fermentation of recombinant E. coli DH5α/pBT2-ET-idgS-sfp. Single factor experiment was employed to optimize the proportion and content of compound nitrogen source in fermentation medium and the variable temperature point of two-stage temperature control strategy. The optimized fermentation medium was as following (g·L-1): tryptone 5, yeast extract 10, NaCl 10, MOPS 5. The optimal culture time at 37 ℃ was 7 h and then the temperature change to 28 ℃. Production of indigoidine from the initial 0.35 g·L-1 increased up to 3-fold at 1.4 g·L-1.
Key words:Indigoidine; Medium optimization; Variable-temperature fermentation; Escherichia coli
中图分类号:TQ920.6
Indigoidine是一种来自微生物的天然蓝色素,有近70多年的发现历史,因其无毒、色泽明亮类似于靛蓝,可作为新型天然蓝色素及染料应用于食品、医药、染整等行业,已有将其用于蛋白质类纤维织物的染色报道[1]。在分子生物学研究中,Indigoidine合成酶基因可作为标记基因构建筛选体系[2-3],近年来关于Indigoidine及其合成酶的应用研究也开始得到了重視[4]。
Indigoidine最早从植物病原菌欧文氏杆菌(Erwinia sp.)
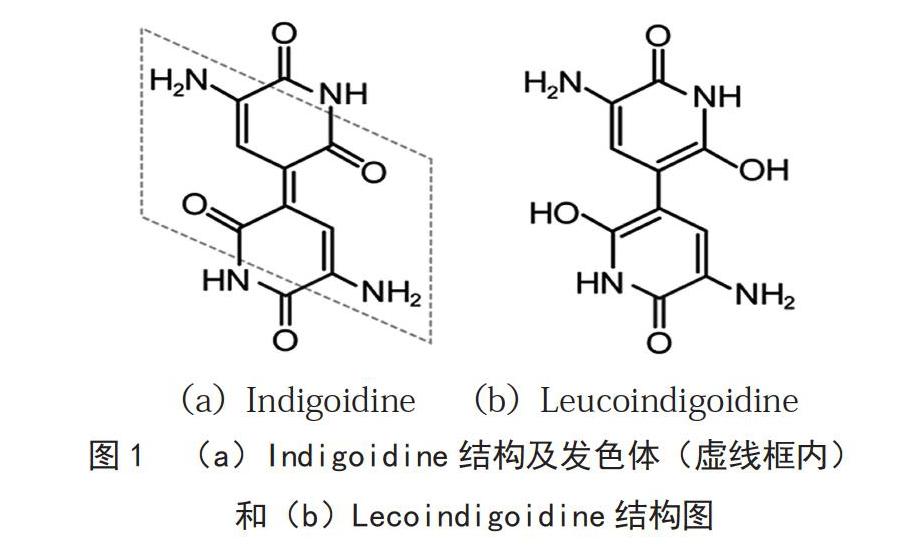
中发现,近年来在链霉菌中发现其合成酶基因以沉默基因的形式存在[5],经其他宿主如大肠杆菌可异源表达并发酵生产Indigoidine[6-7]。Indigoidine合成酶(Indigoidine synthetase)是非核糖体肽合成酶,经过4-磷酸泛酰巯基乙胺基转移酶活化,将微生物体内的2分子谷氨酰胺合成为1分子Indigoidine[8]。该色素为非水溶性蓝色素,具有抗菌性和氧化还原性,能溶解于少数的几种有机溶剂,如DMF、DMSO、四氢呋喃、吡啶、N-甲基吡咯烷酮等[9],结构见图1(a),其
N,N-二甲基甲酰胺溶液在λ=590 nm处有最大吸收峰[2],可被连二亚硫酸钠还原为隐色体形式Lecoindigoidine[3,9],结构见图1(b)。
植物作为天然色素的生产者,虽然来源广泛,但受自然环境影响大、含量低、生长周期缓慢、加工成本高,因此植物源天然蓝色素价格偏高[10]。而利用微生物发酵生产天然蓝色素可避免上述问题,易于工业化生产。目前如利用三孢布拉霉生产的β-胡萝卜素和番茄红素,红曲霉固态发酵生产的红曲色素[11]已作为食品级微生物色素应用于食品行业。利用微生物法发酵生产天然蓝色素,在一定程度上可以缓解市场上天然蓝色素稀缺的问题,本文在成功表达idgS和sfp基因构建产Indigoidine的重组大肠杆菌工程菌的基础上,对其发酵生产Indigoidine的发酵培养基与变温点进行了研究。
1 材料与方法
1.1 菌株
本实验室构建并保藏的一株含有Indigoidine合成酶基因(idgS)与4-磷酸泛酰巯基乙胺基转移酶基因(sfp)的重组大肠杆菌工程菌E.coli DH5α/pBT2-ET-idgS-sfp,其中携带idgS和sfp基因的pCIMt002质粒,由中国科学院微生物研究所陈义华研究员馈赠。
1.2 培养基
LB培养基(g·L-1):胰蛋白胨10,酵母浸粉5,氯化钠10,1×105 Pa灭菌20 min;固体培养基含2%琼脂。
基础发酵培养基(g·L-1):胰蛋白胨10,酵母浸粉5,氯化钠10,3-(N-吗啉)丙磺酸5,pH 7.0,1×105 Pa灭菌20 min。
1.3 试剂与仪器
酵母浸粉、胰蛋白胨(生化级,英国OXOID品牌);N,N-二甲基甲酰胺(DMF,分析纯,天津市津东天正精细化学试剂厂);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);SL 8型高速冷冻离心机[赛默飞世尔(中国)科技公司];ZWYR-D2403型恒温培养振荡器(上海智城分析仪器制造有限公司)。
1.4 方法
1.4.1 種子培养
将菌株E.coli DH5α/pBT2-ET-idgS-sfp经三区划线于含100 mg·L-1氨苄青霉素的LB固体培养基活化,37 ℃过夜培养长出白色单菌落,然后变温至28 ℃培养6~8 h后,白色单菌落变为蓝色,挑取蓝色较深的单菌落于含100 mg·L-1氨苄青霉素的LB液体培养基中,37 ℃、180 r·min-1培养10~12 h,即为种子液。
1.4.2 发酵培养
以1%(V/V)接种量将种子液转接到装有50 mL发酵培养基的250 mL三角瓶中,发酵过程前期37 ℃培养4~10 h,后期28 ℃培养12 h,整个发酵过程摇床转速为180 r·min-1。
1.4.3 发酵优化
培养基氮源优化:优化基础培养基中胰蛋白胨与酵母浸粉的比例和含量;发酵变温点优化:选取产量较高的不同氮源比例的培养基,发酵过程前期37 ℃培养,培养时间分别选择4、6、7、8 h和10 h,后期
28 ℃培养12 h。
1.4.4 Indigoidine产量测定
(1)Indigoidine标准曲线绘制。发酵液经离心取沉淀,用蒸馏水、甲醇、乙酸乙酯、正己烷依次清洗2次,将沉淀中的色素超声溶解于DMF中,通过旋转蒸发、冷冻干燥的方法获取Indigoidine粗品。将色素粗品溶解
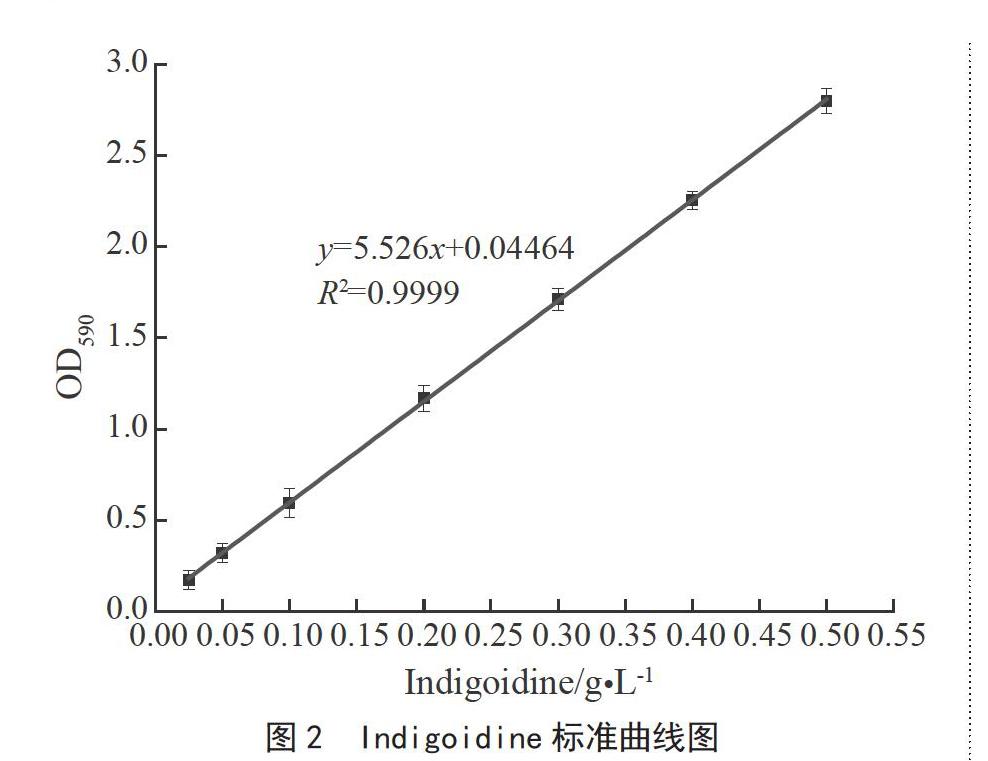
于DMF,配成浓度为1 g·L-1的母液,梯度稀释为0.025、0.050、0.100、0.200、0.300、0.400 g·L-1和0.500 g·L-1的色素溶液,在λ=590 nm处测量色素溶液吸光度值,重复3次(下同),制作Indigoidine标准曲线(见图2)。
(2)Indigoidine产量计算。取发酵液50 mL于离心管中,12 000 r·min-1离心20 min,弃上清,用蒸馏水清洗沉淀2次。向沉淀中加入3 mL N,N-二甲基甲酰胺(DMF),超声1 h,12 000 r·min-1离心20 min,取上清色素溶液。在λ=590 nm处测量色素溶液吸光度值,若OD590大于0.8,则稀释至0.2~0.8 g·L-1范围内测定,根据上述标准曲线换算得出Indigoidine产量。
2 结果与分析
2.1 培养基氮源含量优化
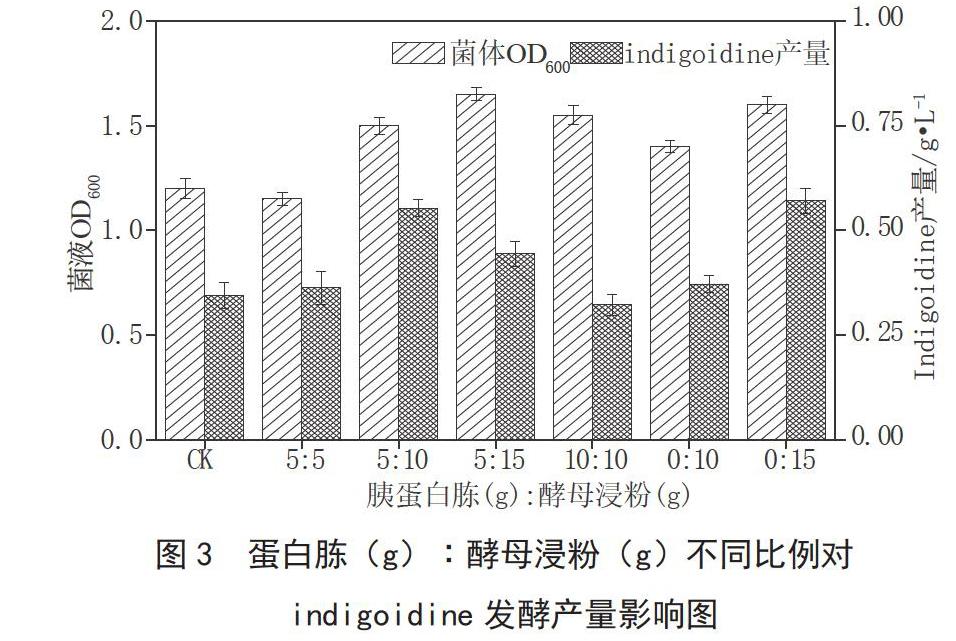
按照1.4.2的方法,发酵前期37 ℃培养4 h后变温至28 ℃培养12 h,测定发酵液中Indigoidine的产量。由图3可知,基础发酵培养基的产量为0.35 g·L-1,当胰蛋白胨(g):酵母浸粉(g)为5∶10、0∶15时产量最高分别为0.55 g·L-1、0.57g·L-1,其次是胰蛋白胨(g):酵母浸粉(g)为5∶15的产量为0.44 g·L-1,上述3个比例的菌体浓度与色素产量都大于对照。
2.2 发酵变温点优化
由于2.1中37 ℃培养4 h后变温,未能真正反映菌体产色素能力的真实水平。因此下一步实验选择上述3个产量较高的复合氮源比例,比较其在多个变温点下的Indigoidine产量。由图4可知,发酵培养基中同一比例的蛋白胨与酵母浸粉在不同变温点下产量差异显著。变温点为4 h时,蛋白胨(g):酵母浸粉(g)为0∶15时产量最高为0.56 g·L-1,但在6~8 h时,蛋白胨(g):酵母浸粉(g)为5∶10时,色素产量最大,其中变温点为7 h时,产量最高为1.4 g·L-1。在各变温点下,蛋白胨(g):酵母浸粉(g)为5∶15的色素产量较5∶10低,可能是菌体浓度过高,发酵液相对黏稠,溶氧下降的原因。因此,确定发酵培养基中复合氮源的比例及含量为胰蛋白胨(g):酵母浸粉(g)=5∶10,变温点为37 ℃培养7 h后变温至28 ℃。
3 结论
通过单因素实验对初始发酵培养基的复合氮源比例及含量和变温发酵的变温点进行优化,得到最终发酵培养基组成(g·L-1):胰蛋白胨5,酵母浸粉10,氯化钠10,3-(N-吗啉)丙磺酸5。最终发酵条件:初始pH 7.0、装液量50 mL/250 mL、37 ℃培养7 h时变温至28 ℃培养12 h,发酵全程摇床转速为180 r·min-1。
采用两阶段控制温度策略,前期利于菌体生长,后期满足菌体产素需求,发酵周期较短。优化后的Indigoidine
产量增加了3倍,达到了1.4 g·L-1。
致谢:感谢中国科学院微生物研究所陈义华研究员馈赠含有idgS和sfp基因的pCIMt002质粒、感谢天津科技大学生物工程学院谢周杰副研究员在Indigoidine
相关研究经验的指导,感谢本实验室唐巧巧同学在重组大肠杆菌工程菌E. coli DH5α/pBT2-ET-idgS-sfp构建方面的工作。
参考文献:
[1]杨叶东,田丽,陈灿军,等.拼色后的天然蓝色素indigoidine对蛋白质纤维织物染色的方法:中国,CN108894014A[P].2018-11-27.
[2]Xie Z J,Zhang Z,Cao Z J,et al.An external substrate-free blue/white screening system in Escherichia coli[J].Applied Microbiology & Biotechnology,
2017,101(9):3811-3820.
[3]Müller M,Ausl?nder S,Ausl?nder D,et al.
A novel reporter system for bacterial and mammalian cells based on the non-ribosomal peptide indigoidine[J].Metabolic Engineering,2012,14(4):325-335.
[4]孙菁兰,朱玉章,王华敏,等. 大肠杆菌异源表达的indigoidine与靛蓝的稳定性比较[EB/OL].(2020-09-25)[2020-09-09].https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST&filename=WSWT20200924002&v=5O1hyDJ8vxQv7oShyn849OHa2Xh2jbMFfPKcYVsSGWDgcQJz5g52m5u60dhDorsG.
[5]Li P W,Li J,Guo Z Y,et al.An efficient blue-white screening based gene inactivation system for Streptomyces[J].Applied Microbiology and Biotechnology,2015,99(4):1923-1933.
[6]Xu F C,Gage D,Zhan J X.Efficient production of indigoidine in Escherichia coli[J].Journal of Industrial Microbiology and Biotechnology,2015,42(8):1149-1155.
[7]Yu D Y,Xu F C,Valiente J,et al.An indigoidine biosynthetic gene cluster from Streptomyces chromofuscus ATCC 49982 contains an unusual IndB homologue[J].Journal of Industrial Microbiology and Biotechnology,2013,40(1):159-168.
[8]Takahashi H,Kumagai T,Kitani K,et al.Cloning and characterization of a Streptomyces single module type non-ribosomal peptide synthetase catalyzing a blue pigment synthesis[J].Journal of Biological Chemistry,2007,282(12):9073-9081.
[9]Heumann W,Young D,Gottlich C.Leucoindigoidine formation by an Arthrobacter species and its oxidation to indigoidine by other microorganisms[J].Biochimica et Biophysica Acta-General Subjects,1968,
156(2):429-431.
[10]王君,張宝善.微生物生产天然色素的研究进展[J].微生物学通报,2007,34(3):183-186.
[11]徐春明,王晓丹,焦志亮.食用微生物色素的研究进展[J].中国食品添加剂,2015(2):162-168.

