RBMS3-AS3对宫颈癌细胞增殖、凋亡和侵袭的影响及作用机制
兰 莉,陈海丽,徐 蕾
(十堰市妇幼保健院产科,湖北 十堰 442008)
宫颈癌是女性生殖系统常见的恶性肿瘤,对女性生命健康造成极大的威胁。宫颈癌具有较高的致死率,近几年来,其发病率呈增长和年轻化趋势[1]。早期宫颈癌治疗方法主要有手术、化疗、放疗等,但部分患者极易复发转移,预后不佳[2]。目前,宫颈癌的发病机制尚不明确,并且缺乏有效的诊断和治疗靶点,因此探讨宫颈癌的致病机制、寻找宫颈癌的治疗靶点具有重大意义。长链非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200个核苷酸的非编码RNA,参与调控细胞增殖、分化和凋亡等生命活动,与肿瘤的发生发展密切相关[3]。RNA 结合基序单链相互作用蛋白3(RNA-binding motif,singlestranded-interacting protein 3,RBMS3)是一种RNA 结合蛋白,在人体内广泛表达。研究显示,RBMS3参与胃癌、食管鳞状细胞癌等肿瘤的发生发展[4-5],可作为肿瘤诊治的生物学标记或分子靶点。RBMS3 反义链3(RBMS3 antisense 3,RBMS3-AS3)是一种lncRNA,且部分与RBMS3基因互补。有报道称,RBMS3-AS3在宫颈癌组织中高表达,可能参与宫颈癌的发生发展[6]。本研究主要探讨了RBMS3-AS3对宫颈癌细胞增殖、凋亡和侵袭的影响及其是否通过调控RBMS3表达发挥作用,以期为宫颈癌的治疗提供新的靶点。
1 材料与方法
1.1 细胞和实验试剂
人宫颈永生化细胞Ect1/E6E7 和宫颈癌细胞HeLa、Caski 和SiHa,购于中国科学院上海细胞库;胎牛血清(fetal bovine serum,FBS)和RPMI 1640 培养基, 购于美国Gibco 公司; 四甲基噻唑蓝(methylthiazoletrazolium,MTT)和胰蛋白酶,购于美国Sigma 公 司;Trizol 试 剂 和LipofectamineTM2000 试 剂盒,购于美国Invitrogen公司;逆转录试剂盒和PCR试剂盒,购于深圳晶美公司;鼠抗人RBMS3 单克隆抗体,购于英国Abcam 公司;鼠抗人基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、细胞周期蛋白D1(Cyclin D1)单克隆抗体和兔抗人B淋巴细胞瘤-2(Bcell lymphoma-2,Bcl-2)、B 淋巴细胞瘤-2 相关蛋白(Bcl-2-associated X protein,Bax)多克隆抗体,购于北京中山生物技术有限公司;PCR引物,购于上海生工生物工程有限公司;RBMS3-AS3 和RBMS3 的小干扰RNA,购于上海吉凯基因公司;BCA蛋白测定试剂盒,购于上海碧云天公司;Annexin V-FITC/PI 试剂盒,购于上海雅吉生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养人宫颈永生化细胞Ect1/E6E7 和宫颈癌细胞HeLa、Caski 和SiHa 均用含10% FBS 的RPMI 1640 培养基、置于37 ℃、CO2体积分数为5%、97%湿度的培养箱中培养。每2~3 d 更换1 次新鲜培养基。待细胞汇合度达80%~90%时,用0.25%胰蛋白酶消化,传代培养。
1.2.2 实时荧光定量PCR 检测RBMS3-AS3 表达将对数生长期的Ect1/E6E7、HeLa、Caski和SiHa细胞均以每孔1×105个接种于6 孔板中,培养24 h 后,收集细胞,用Trizol 试剂提取细胞中总RNA,经微量核酸仪检测纯度和浓度后,参照逆转录试剂盒,将RNA逆转录为cDNA。然后以cDNA为模板,进行实时荧光定量PCR(real-time quantitative PCR,qPCR)扩增。扩增条件:95 ℃预变性6 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共进行35 个循环。引物序列:RBMS3-AS3 上游5′-CGGGCTTAGCCGTAGCG TTGC-3′,下 游5′-CAAATGGCCCGTGGTCATGCG-3′;GAPDH 上 游5′-CGCTCTCTGCTCCTCCTGTTC-3′,下游5′-ATCCGTTGACTCCGACCTTCAC-3′。以GAPDH为内参,采用2-ΔΔCT法计算RBMS3-AS3相对表达水平。
1.2.3 Western blot 法检测RBMS3 蛋白表达将对数生长期的Ect1/E6E7、HeLa、Caski和SiHa细胞均以每孔1×105个接种于6 孔板中,培养24 h 后,收集细胞,RIPA试剂提取细胞中总蛋白,BCA蛋白试剂盒检测蛋白含量。取适量蛋白,100 ℃煮沸5 min。蛋白变性后,以每泳道30 μg 蛋白进行SDS-PAGE 电泳。电泳后,转至聚偏乙烯二氟膜,将其置于5%脱脂牛奶中封闭2 h。分别加RBMS3(1∶500)、β-actin(1∶1 000)一抗,4 ℃孵育过夜。TBST缓冲液洗膜后,加辣根过氧化酶标记的山羊抗兔二抗(1∶2 000),室温孵育1 h。TBST 缓冲液洗膜后,加入ECL 显影液,避光显影,凝胶成像系统曝光拍照,ImageJ软件分析RBMS3蛋白相对表达水平。RBMS3蛋白相对表达水平以其蛋白条带灰度值与β-actin蛋白条带灰度值的比值表示。
1.2.4 HeLa细胞转染和分组将宫颈癌细胞HeLa以1×105个/孔接种于6 孔板中,待细胞生长至汇合度为60%时,更换无FBS的培养基,并分为si-RBMS3-AS3组、阴性序列组、si-RBMS3-AS3+si-RBMS3 和si-RBMS3-AS3+阴性序列组。其中si-RBMS3-AS3 组转染RBMS3-AS3 的小干扰RNA,阴性序列组转染乱序无意义阴性序列,si-RBMS3-AS3+si-RBMS3 组共转染RBMS3-AS3 的小干扰RNA 与RBMS3 的小干扰RNA,si-RBMS3-AS3+阴性序列组共转染RBMS3-AS3 的小干扰RNA 与乱序无意义阴性序列。转染6 h后,更换培养基。在培养24 h后收集细胞,用于后续实验。同时设置对照组(对照组):不进行转染操作,细胞正常培养相同时间。qPCR 法检测各组HeLa 细胞中RBMS3-AS3 表达水平,方法同1.2.2;Western blot法检测各组HeLa 细胞中RBMS3、Cyclin D1、Bcl-2、Bax 和MMP-2 蛋白表达,方法同1.2.3,其中RBMS3、Cyclin D1、Bcl-2、Bax 和MMP-2 一抗稀释度分为1∶500、1∶500、1∶1 000、1∶1 000、1∶500。
1.2.5 MTT 检测细胞增殖各组HeLa 细胞以1×103个/孔接种于96 孔板中,分别培养24、48、72 h 后,加20 μL浓度为5 g/L的MTT,继续孵育4 h。弃培养基,加150 μL 二甲基亚砜,振荡混匀,酶标仪测定光密度D(490)值。
1.2.6 Transwell 实验检测细胞侵袭将Matrigel 基质胶用RPMI 1640 培养基以1∶8 的比例稀释,铺于Transwell小室的上室,自然晾干。调整各组HeLa细胞密度为5×104个/mL。取100 μL 细胞悬液,加入Transwell 上室。下室加500 μL 含FBS 的RPMI 1640培养基。培养48 h 后,4%多聚甲醛固定30 min,0.4%结晶紫染色15 min,置于倒置显微镜下观察,随机选取5个视野,对侵袭细胞进行计数。
1.2.7 流式细胞术检测细胞凋亡率各组HeLa 细胞以1×104个/孔接种于24 孔板,培养48 h 后,胰酶消化,适量磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞2 次。取含1.0×106个细胞的细胞悬液,吸弃PBS,加入400 μL结合缓冲液,用移液器轻轻吹打,混悬细胞。加入10 μL Annexin V-FITC,室温避光孵育10 min 后,加入5 μL 碘化丙啶(propidium iodide,PI),室温避光反应5 min。最后再加入100 μL 结合缓冲液,混匀后,流式细胞仪检测细胞凋亡情况。
细胞凋亡率/%=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%
1.3 统计学方法
利用SPSS 22.0 软件分析实验数据。计量资料以±s 表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以α=0.05为检验水准。
2 结 果
2.1 RBMS3-AS3和RBMS3在宫颈癌细胞系中的表达水平
Western blot和qPCR检测结果见图1和表1,宫颈癌细胞系HeLa、Caski和SiHa中RBMS3-AS3的表达水平均高于Ect1/E6E7细胞(P<0.05),而RBMS3蛋白表达均低于Ect1/E6E7细胞(P<0.05)。由于宫颈癌细胞HeLa中RBMS3-AS3、RBMS3 蛋白的表达水平较Ect1/E6E7细胞差异更显著,因此,选择HeLa 细胞进行后续实验。

图1 Western blot检测宫颈癌细胞株中RBMS3蛋白表达的条带图
表1 qPCR 和Western blot 检测宫颈癌细胞株中RBMS3-AS3 和RBMS3蛋白的表达±s,n=9)
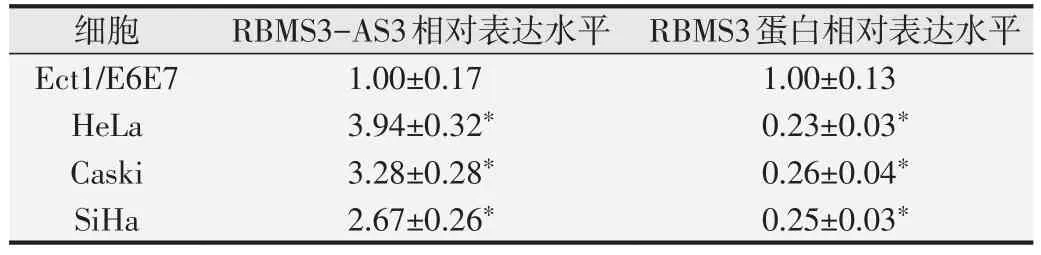
表1 qPCR 和Western blot 检测宫颈癌细胞株中RBMS3-AS3 和RBMS3蛋白的表达±s,n=9)
与正常宫颈细胞株Ect1/E6E7比较,*P<0.05.
?
2.2 HeLa细胞中RBMS3-AS3的表达
qPCR检测结果见表2,与对照组或阴性序列组比较,si-RBMS3-AS3 组HeLa 细胞RBMS3-AS3 相对表达水平降低(P<0.05),而对照组与阴性序列组HeLa 细胞RBMS3-AS3 相对表达水平比较差异无统计学意义(P>0.05)。

表2 qPCR检测各组HeLa细胞中RBMS3-AS3表达(x±s,n=9)
2.3 HeLa 细胞中RBMS3、Cyclin D1、Bax、Bcl-2、MMP-2蛋白的表达
Western blot 检测结果见图2 和表3,与对照组或阴性序列组比较,si-RBMS3-AS3 组HeLa 细胞中RBMS3、Bax 的 蛋 白 表 达 水 平 升 高(P<0.05),Cyclin D1、Bcl-2 和MMP-2 的蛋白表达水平降低(P<0.05),而对照组与阴性序列组HeLa 细胞中RBMS3、Cyclin D1、Bax、Bcl-2 和MMP-2 蛋白表达水平比较均无显著差异(P>0.05)。与si-RBMS3-AS3+阴性序列组比较, si-RBMS3-AS3 + si-RBMS3 组HeLa 细 胞 中RBMS3、Bax 的蛋 白 表达 水 平降低(P<0.05),Cyclin D1、Bcl-2和MMP-2的蛋白表达水平升高(P<0.05)。

图2 Western blot检测各组细胞中RBMS3、Cyclin D1、Bax、Bcl-2、MMP-2蛋白表达
表3 Western blot检测各组HeLa细胞中RBMS3、Cyclin D1、Bax、Bcl-2、MMP-2蛋白表达水平±s,n=9)
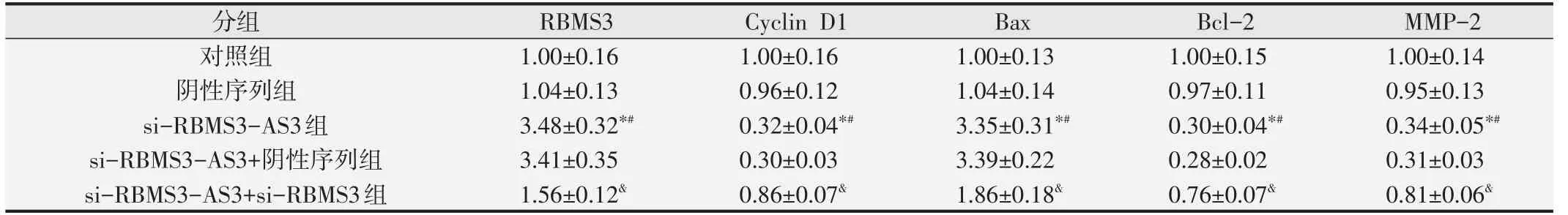
表3 Western blot检测各组HeLa细胞中RBMS3、Cyclin D1、Bax、Bcl-2、MMP-2蛋白表达水平±s,n=9)
与对照组比较,*P<0.05;与阴性序列组比较,#P<0.05;与si-RBMS3-AS3+阴性序列组比较,&P<0.05.
?
2.4 HeLa细胞的增殖情况
MTT 法检测各组HeLa 细胞的增殖情况结果见表4,可见与对照组或阴性序列组比较,si-RBMS3-AS3组HeLa 细胞D(490)值降低(P<0.05),而对照组与阴性序列组HeLa 细胞D(490)值比较无显著差异(P>0.05)。与si-RBMS3-AS3+阴性序列组比较,si-RBMS3-AS3+si-RBMS3组HeLa细胞D(490)值升高(P<0.05)。
表4 MTT法检测各组HeLa细胞的增殖情况[D(490)值,s,n=9]
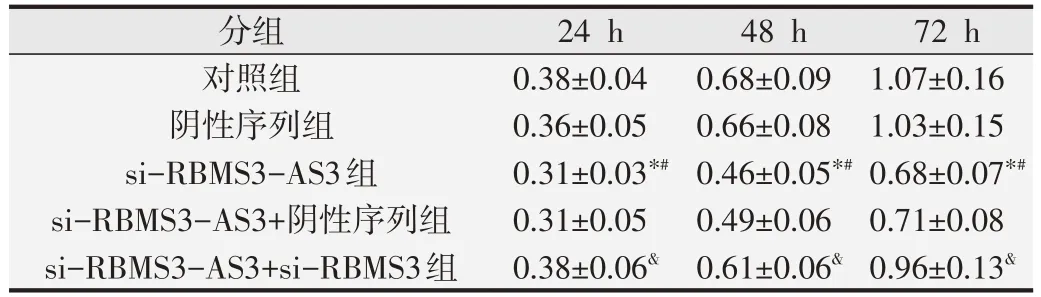
表4 MTT法检测各组HeLa细胞的增殖情况[D(490)值,s,n=9]
与对照组比较,*P<0.05;与阴性序列组比较,#P<0.05;与si-RBMS3-AS3+阴性序列组比较,&P<0.05.
?
2.5 HeLa细胞的侵袭情况
Transwell实验检测各组HeLa细胞侵袭情况结果见表5 和图3,可见与对照组或阴性序列组比较,si-RBMS3-AS3组HeLa细胞侵袭数降低(P<0.05),而对照组与阴性序列组HeLa 细胞侵袭数比较无显著差异(P>0.05)。与si-RBMS3-AS3+阴性序列组比较,si-RBMS3-AS3+si-RBMS3 组HeLa 细胞侵袭数显著升高(P<0.05)。
表5 Transwell实验检测各组HeLa细胞的侵袭数目s,n=9)

表5 Transwell实验检测各组HeLa细胞的侵袭数目s,n=9)
与对照组比较,*P<0.05;与阴性序列组比较,#P<0.05;与si-RBMS3-AS3+阴性序列组比较,&P<0.05.
?
2.6 HeLa细胞的凋亡情况
流式细胞术检测各组HeLa细胞凋亡率结果见表6和图4,可见与对照组或阴性序列组比较,si-RBMS3-AS3组HeLa细胞凋亡率升高(P<0.05),而对照组与阴性序列组HeLa 细胞凋亡率比较无显著差异(P>0.05)。与si-RBMS3-AS3+阴性序列组比较,si-RBMS3-AS3+si-RBMS3 组HeLa 细胞凋亡率降低(P<0.05)。
表6 流式细胞术检测各组HeLa细胞凋亡率s,n=9)

表6 流式细胞术检测各组HeLa细胞凋亡率s,n=9)
与对照组比较,*P<0.05;与阴性序列组比较,#P<0.05;与si-RBMS3-AS3+阴性序列组比较,&P<0.05.
?
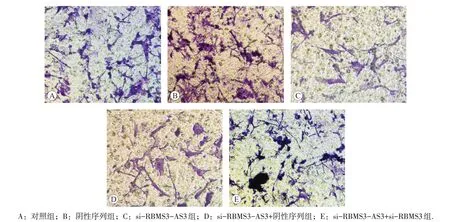
图3 Transwell实验检测各组HeLa细胞侵袭情况
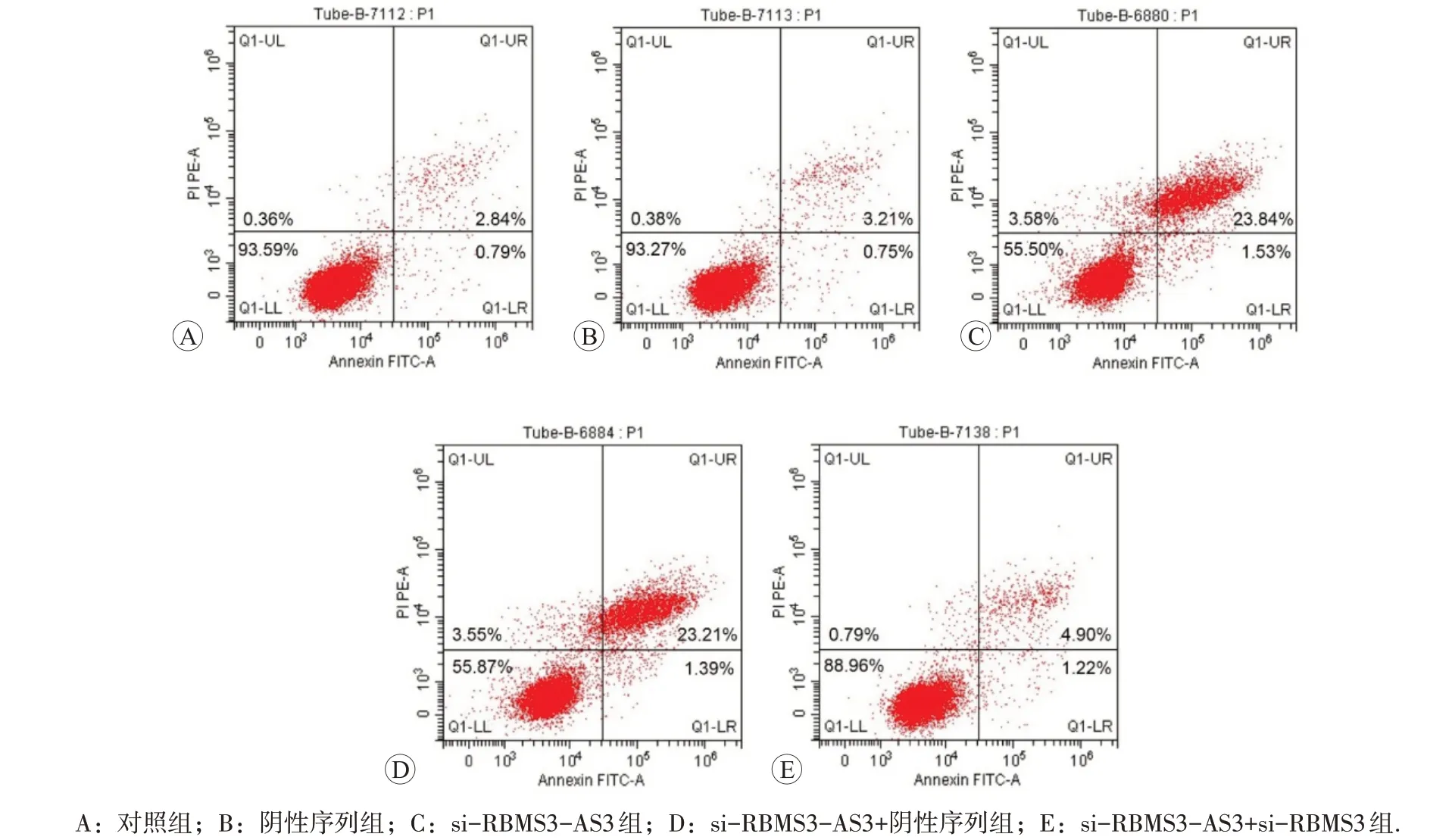
图4 流式细胞术检测各组HeLa细胞凋亡情况
3 讨 论
宫颈癌是严重威胁女性生命健康的恶性肿瘤,其发生发展是一个多因素和多阶段的过程。宫颈癌的早期诊断和治疗缺乏有效的生物学指标,因此,研究宫颈癌细胞增殖、侵袭和凋亡的分子机制,寻找有效的诊断和分子治疗靶点,有助于宫颈癌患者的治疗。LncRNA 可在转录,表观遗传等多个方面调控基因的表达,参与调控细胞的增殖、凋亡、迁移和侵袭等生物学行为[7-9]。LncRNA 的作用机制与相邻基因的位置关系十分密切,根据其编码蛋白基因的位置关系,可将lncRNA 分为正义(sense)、反义(antisense),双向(bidirectional)、内含子(intronic)和基因间(intergenic)lncRNA。其中反义链型lncRNA 对相应基因具有调控作用,参与肿瘤的发生发展[10]。
RBMS3-AS3 是RBMS3 反义链3,属于lncRNA。Su等[11]研究显示,RBMS3-AS3在主动脉瘤中表达有差异,可作为主动脉瘤的诊断标志物。目前RBMS3-AS3对宫颈癌细胞生物学行为的影响和作用机制还未见相关报道。本研究显示,与人宫颈永生化细胞Ect1/E6E7 比 较,宫 颈 癌 细 胞HeLa、Caski 和SiHa 中RBMS3-AS3 表达降低,提示RBMS3-AS3 在宫颈癌发生发展中起重要作用。通过转染RBMS3-AS3 的小干扰RNA 抑制宫颈癌HeLa 细胞中RBMS3-AS3 表达后,细胞增殖和侵袭受到抑制,凋亡加剧,Cyclin D1、Bcl-2 和MMP-2 蛋白表达降低,Bax 蛋白表达升高,说明抑制RBMS3-AS3 表达可抑制宫颈癌细胞增殖和侵袭,并促进细胞凋亡,提示RBMS3-AS3 可能是宫颈癌治疗的潜在作用靶点。
RBMS3是C-myc基因单链结合蛋白家族成员,在肿瘤的发生发展中起重要作用。研究显示,RBMS3在胃癌细胞中表达降低,过表达RBMS3可通过阻滞Wnt/β-catenin 信号通路,抑制胃癌细胞的侵袭和上皮-间质转化[12];人乳腺癌组织和细胞系RBMS3的mRNA和蛋白质表达下调,RBMS3过表达可在体外显著抑制乳腺癌细胞的增殖、迁移和侵袭及体内肿瘤生长[13];胆囊癌组织中RBMS3 表达降低,过表达RBMS3 可抑制胆囊癌细胞增殖和克隆形成,并促进细胞凋亡[14]。本研究结果显示,宫颈癌细胞中RBMS3 蛋白呈低表达,提示RBMS3参与宫颈癌的发生和发展。抑制宫颈癌细胞中RBMS3-AS3 表达后,RBMS3 蛋白表达升高,且抑制RBMS3 表达逆转RBMS3-AS3 对宫颈癌细胞增殖和侵袭的抑制作用及凋亡的促进作用,并能够逆转RBMS3-AS3 对宫颈癌细胞Cyclin D1、Bcl-2、Bax 及MMP-2 蛋白表达的影响,提示RBMS3-AS3 可能通过上调RBMS3表达抑制宫颈癌细胞增殖和侵袭,并促进细胞凋亡。
综上所述,RBMS3-AS3 在宫颈癌细胞中呈高表达,RBMS3 蛋白呈低表达;抑制RBMS3-AS3 表达可抑制宫颈癌细胞的增殖和侵袭,并促进宫颈癌细胞凋亡,其可能通过负调控RBMS3表达发挥作用,是宫颈癌靶向治疗的潜在作用靶点。

