数据挖掘分析MYB家族在乳腺癌中的表达及其预后评估价值
李玮玮,朱 莹
(1.惠州卫生职业技术学院医学技术系,广东惠州 516025;2.南方医科大学附属东莞人民医院病理科,广东 东莞 523059)
乳腺癌是女性常见恶性肿瘤之一,占女性新发肿瘤的30%[1]。早期诊断和精准治疗策略虽然极大的改善了乳腺癌患者的整体预后,但在女性肿瘤患者中,乳腺癌死亡率仍排名第二[1]。乳腺癌具有独特的分子病理学特征,其中雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)、Ki67 已为乳腺癌亚分类、患者精准诊疗和预后评估提供了重要的信息,大大降低了患者的死亡率[2]。然而,鉴于肿瘤复发、转移的出现以及精准治疗的迫切性,探寻新的生物标志物成为当前乳腺癌研究的主要方向之一。
MYB 家族包括MYB(C-Myb)、MYBL1(A-Myb)和MYBL2(B-Myb),每个家族成员识别共同的DNA 基序激活下游基因表达,发挥重要的转录调控功能,但它们参与的调控机制和生物学功能却有所区分[3-5]。创始者成员MYB是一种参与细胞增殖、分化的重要转录因子,它通过基因扩增、染色体易位、转录活性增加等方式异常表达,调控细胞增殖、分化、凋亡、DNA损伤等生物学功能,发挥致癌作用[4,6-8],促进乳腺癌[6]、结直肠癌[9]、白血病[10]等恶性肿瘤发生发展。MYBL1通过基因重排形成融合基因(如MYBL1-NFIB)[7]或通过基因负调控片段(C-端结构域)缺失的方式异常表达[11],促进乳腺腺样囊性癌[7]、儿童弥漫性低级别胶质瘤[11]和淋巴细胞白血病[12]的发生和发展。MYBL2 是肿瘤细胞周期进展、细胞存活和上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)的中心调控因子,影响细胞增殖、耐药性以及肿瘤转移等生物功能[5],其过表达常常与乳腺癌[5,13]、肺癌[14]、肝癌[15]等肿瘤不良预后相关。
近年来,基于大型数据库分析生物标志物已被肿瘤研究领域广泛接受。尽管MYB家族在肿瘤发生发展过程中发挥重要作用,但每个家族成员在乳腺癌中的临床价值仍未得到充分阐明。因此,本研究通过多个数据平台综合分析MYB家族在乳腺癌中的表达及预后价值,探究其对乳腺癌转移复发的临床意义。
1 材料与方法
1.1 Oncomine数据分析
Oncomine包含多种大型肿瘤基因芯片数据库,用于分析多种肿瘤中基因转录水平变化(http://www.oncomine.org)[16]。本研究利用该数据库对MYB 家族成员在乳腺癌和正常乳腺中的表达进行比较。以改变倍数阈值>1.5,P<0.05被认为差异具有统计学意义。
1.2 基因表达谱数据动态分析
基因表达谱数据动态分析(gene expression profiling interactive analysis 2,GEPIA2)数据库由北京大学研发,用于分析肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)和基因型-组织表达(genotypetissues expression,GTEx)数据库中不同肿瘤和正常组织样本中的基因mRNA 表达(http://gepia2.cancer-pku.cn)[17]。本研究用于分析MYB家族基因在浸润性乳腺癌(breast invasive carcinoma,BRCA)和正常乳腺组织中的表达。
1.3 肿瘤基因组图谱TCGA数据集和cBioPortal数据分析
TCGA 数据库(https://cancergenome.nih.gov/)从分子水平上描述了2万多例原发性肿瘤,并匹配了33种肿瘤对应的正常样本,包含测序数据和临床样本数据[18]。cBioPortal(https://www.cbioportal.org/)通过多功能可视化分析肿瘤样本研究基因组数据,实现复杂的肿瘤基因组和临床特征的整合分析[19]。本研究利用该平台BRCA数据库(TCGA,Firehose Legacy)中1 108例患者的基因表达信息,其中含有突变、拷贝数变异和mRNA 表达数据的样本量960 例,用于进一步分析MYB 家族基因变异情况和筛选MYB 家族的共表达基因(co-expression genes)。设置Spearman 相关系数|R|≥0.6为共表达基因的筛选条件。
1.4 乳腺癌基因表达数据挖掘工具数据分析
乳腺癌基因表达数据挖掘工具(Breast Cancer Gene-Expression Miner v4.4,bc-GenExMiner v4.4,http://bcgenex.centregauducheau.fr/BC-GEM)是一种乳腺癌基因表达数据挖掘工具,于2019 年12 月进行数据更新[20-21]。它被用于分析MYB 家族基因的mRNA 表达水平与多项临床病理参数之间的关系、Cox 分析和无转移复发生存(metastatic relapse-free survival,MRFS)的预后评估。
1.5 Kaplan-Meier Plotter在线分析
用Kaplan-Meier Plotter(https://kmplot.com/analysis/)[22]在线分析3 951名乳腺癌患者中MYB家族基因表达的无复发生存(relapse-free survival,RFS)和进展后生存(post progression survival,PPS)的预后价值。分别根据MYB家族基因中位表达水平将乳腺癌患者分为高表达和低表达两组,选择Jet Set 最佳探针集[23],Kaplan-Meier曲线评价RFS和PPS预后。
1.6 DAVID富集分析
DAVID[24](https://david.ncifcrf.gov/)是一个整合生物信息数据库,可提供大规模基因或蛋白列表系统综合的生物功能注释信息。采用DAVID 进行MYBL2共表达基因GO(gene ontology)功能分析和KEGG(Kyoto Encyclopedia of Gene and Genomes)信号通路的富集分析。
1.7 统计学分析和作图
Oncomine 分析P值和两组计量数据比较采用Student'st检验。利用GraphPad Prism 8 软件绘图。bc-GenExMiner v4.4 分析数据采用Welch 检验、事后Dunnett-Tukey-Kramer 检验、单因素和多因素Cox 分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 MYB家族在乳腺癌和正常乳腺组织中的差异表达
Oncomine 分析结果显示,在乳腺癌、结直肠癌、胃癌等多个数据集中,其肿瘤组织的MYB家族基因表达高于相应正常组织,见图1。其中,MYB、MYBL1和MYBL2分别在17个、14个和15个数据集的乳腺癌组织中表达高于正常乳腺组织,差异具有统计学意义(P<0.05,图1)。同时,MYB 家族基因在不同乳腺癌类型中呈现出高表达,如浸润性导管癌、浸润性小叶癌和乳腺小管癌等,见表1。此外,利用GEPIA2分析结果显示,1 085 例浸润性乳腺癌组织中MYB 和MYBL2 mRNA表达高于291例正常乳腺组织,差异具有统计学意义(P<0.01,图2A和2C),而MYBL1 mRNA表达的差异不明显(图2B)。
2.2 MYB家族在乳腺癌组织中基因变异的分析
基于cBioPortal 分析乳腺癌数据集(TCGA,Firehose Legacy),结果显示,其中960 例乳腺癌患者(microarray数据)中MYB家族基因发生变异率为24.79%(238/960,图3A)。MYB基因表达变异率为7.92%,其中mRNA 低表达占4.17%(40 例);MYBL1基因表达变异率为16.04%,主要表现为基因扩增(占7.29%,70例)和mRNA 高表达(占6.35%,61 例);MYBL2基因表达变异率为7.08%,主要表现为mRNA 高表达(占3.85%,37 例)(图3A,表2)。MYB、MYBL1和MYBL2基因在乳腺癌组织中突变率低,分别为1.15%、0.31%和0.42%(表2)。进一步分析基因拷贝数变异(copynumber variation,CNV)与mRNA表达的关系,结果显示随着MYB家族基因CNV不断增加(二倍体<轻度增加<扩增),MYB mRNA 水平并未逐渐升高(图3B),而MYBL1 和MYBL2 mRNA 表达不断升高,差异具有统计学意义(P<0.01,图3C和3D)。
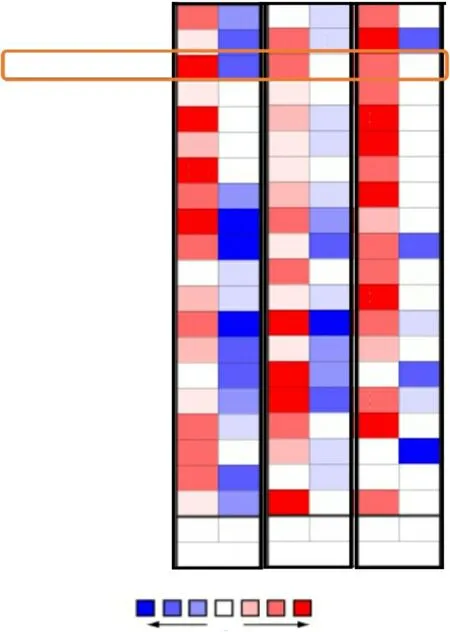
图1 MYB家族基因在多种肿瘤中的表达水平(Oncomine数据库)
2.3 MYB家族表达与乳腺癌患者临床病理特征的关系
使用bcGenExMiner v4.4 在线分析MYB 家族基因mRNA 表达与乳腺癌患者不同临床病理特征的相关性(表3)。结果表明,高龄患者组(>51 岁)MYB mRNA 表达升高,而MYBL1和MYBL2的表达降低(P<0.01)。淋巴结转移阳性患者组中的MYBL2 表达升高(P=0.002),但MYB 和MYBL1 的表达无明显差异。ER+、PR+患者组中,MYB 表达升高(P<0.01),而HER-2+、三阴性乳腺癌(triple negative breast cancer,TNBC)、基底细胞样乳腺癌(basal-like breast carcinoma,BLBC)和P53 突变乳腺癌患者中,MYB 表达降低(P<0.01)。MYBL1 在ER+、PR+、HER-2+乳腺癌患者组中表达降低,但其在TNBC、BLBC 和P53 突变乳腺癌患者组中表达升高(P<0.01)。与MYB结果完全相反,MYBL2在ER+、PR+患者组中表达下降,而在HER-2+、TNBC、BLBC 和P53 突变乳腺癌患者组中表达升高(P<0.001)。此外,Scarff-Bloom-Richardson(SBR)分级越高,乳腺癌患者MYB 表达水平越低(P<0.01,图4A),而MYBL1 和MYBL2 表达逐渐升高(P<0.01,图4B 和4C)。
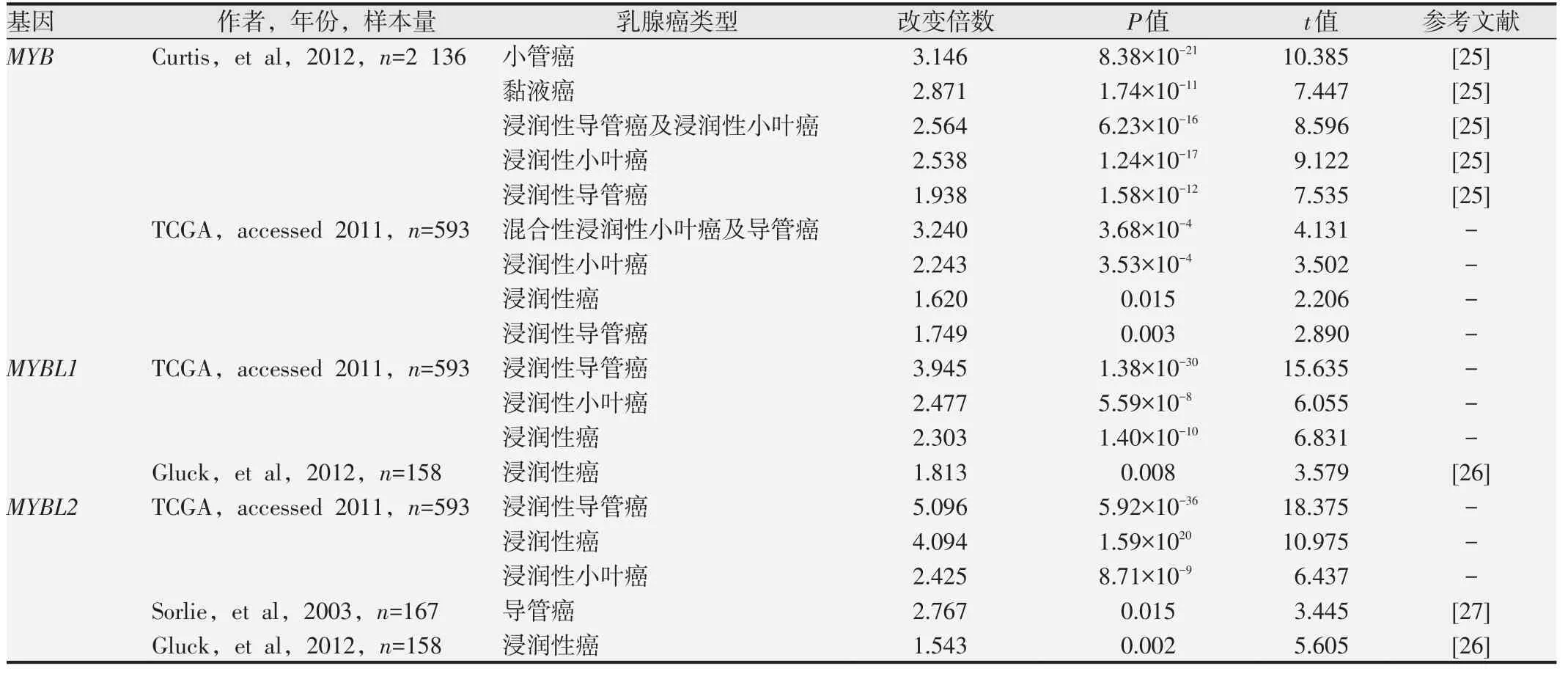
表1 Oncomine数据库分析MYB家族在不同乳腺癌类型中表达的差异
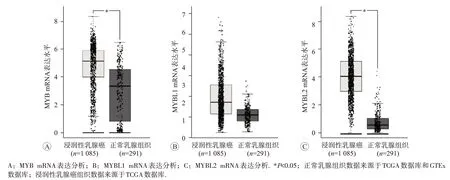
图2 MYB家族在BRCA和正常乳腺组织中的mRNA表达差异(GEPIA2)
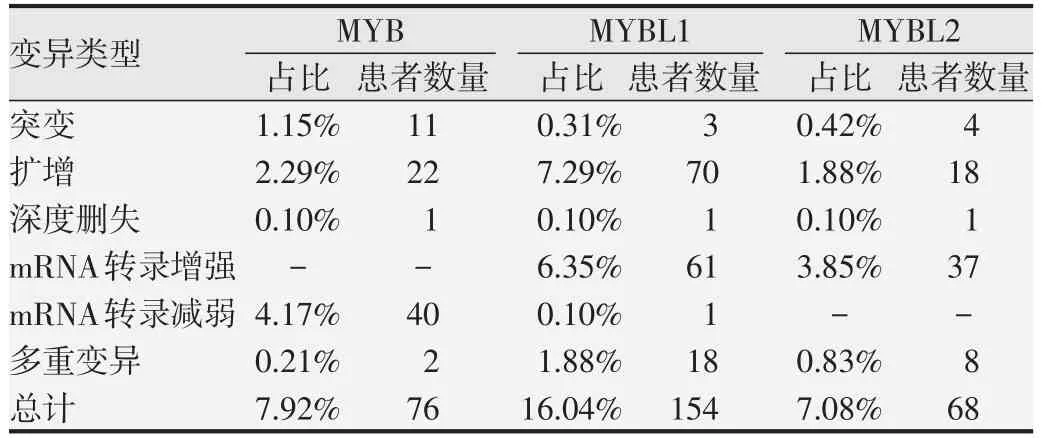
表2 浸润性乳腺癌中MYB家族基因变异类型分析
2.4 MYB家族表达与乳腺癌患者预后的关系
Kaplan-Meier Plotter 在线分析结果显示,MYB 家族成员mRNA表达与乳腺癌患者的无复发生存(RFS)相关(P<0.01)。其中,MYB高表达乳腺癌患者的RFS 比其低表达患者的RFS 更长(图5A)。而MYBL1和MYBL2高表达的乳腺癌患者RFS 显著缩短(图5B 和5C)。进一步分析MYB 家族基因表达与乳腺癌患者进展后生存(PPS)的相关性,结果显示:MYB低表达和MYBL2高表达乳腺癌患者PPS 显著缩短(图5D 和5F),而MYBL1 表达与乳腺癌患者PPS 无明显相关关系(图5E)。此外,利用bc-GenExMiner v4.4 进行单因素Cox分析在转移复发乳腺癌患者中,不同淋巴结状态(N,nodal status)和ER 状态下,MYB 家族基因表达与预后的关系见表4。结果显示,在混合表达状态Nm/ERm或N+/ERm(mixed expression status,m)的转移复发乳腺癌患者中,MYB高表达患者预后好(P<0.01);在Nm/ER+或N-/ER+的转移复发乳腺癌患者中,MYBL1高表达患者预后差(P<0.05);而在不同淋巴结状态下,ERm或ER+的转移复发乳腺癌患者中,MYBL2高表达患者预后 差(P<0.01)。同 时,MYB表 达 降 低、MYBL1和MYBL2表达升高的乳腺癌患者均具有较短的无转移复发生存(MRFS)(P<0.01,图6)。但与乳腺癌经典预后指标诺丁汉预后指数(Nottingham prognostic index,NPI)和增殖评分进行Cox多因素分析发现,仅MYBL2能作为乳腺癌转移复发的独立预后因子(P<0.05,表5)。
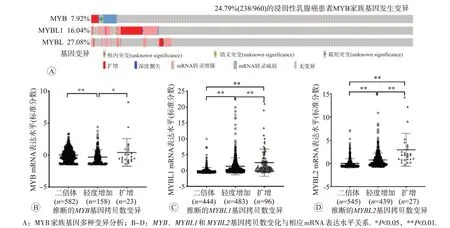
图3 浸润性乳腺癌中MYB家族基因变异分析(cBioPortal)
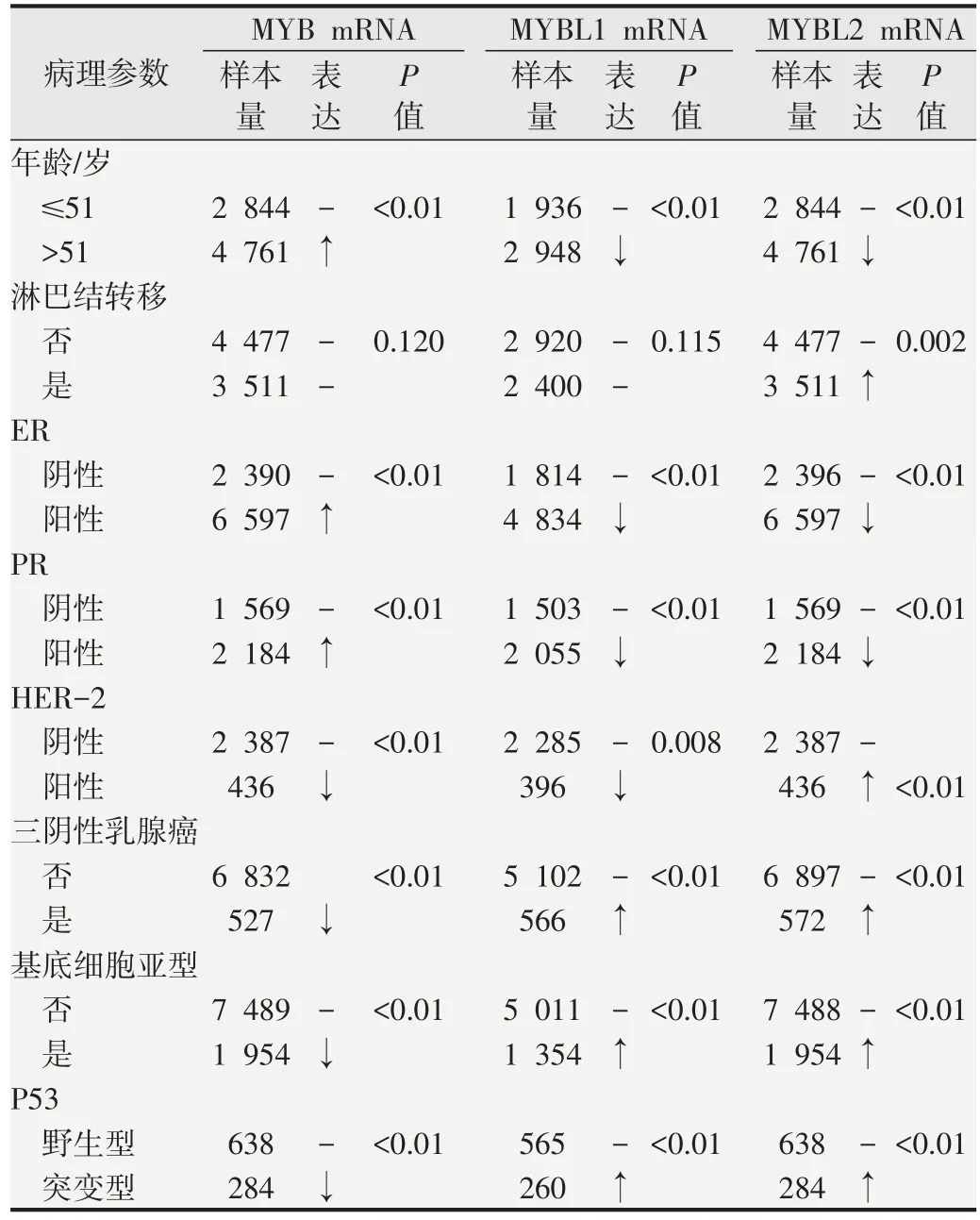
表3 bc-GenExMiner DNA 微阵列数据库分析MYB家族表达与乳腺癌患者临床病理特征的关系
2.5 乳腺癌MYB家族共表达基因功能富集分析
使用cBioPortal 在线分析BRCA 数据集(TCGA,Firehose Legacy)中MYB 家族共表达基因,获得MYB共表达基因21 个,MYBL1共表达基因6 个,MYBL2共表达基因251个。随后利用DAVID对MYBL2共表达基因进行GO 功能注释和KEGG 通路富集分析。GO 结果显示,MYBL2共表达基因主要参与细胞分裂、有丝分裂核分裂、细胞核质成分、蛋白结合、DNA复制等生物功能(图7A)。KEGG 结果显示,MYBL2共表达基因主要影响细胞周期信号通路(图7B)。
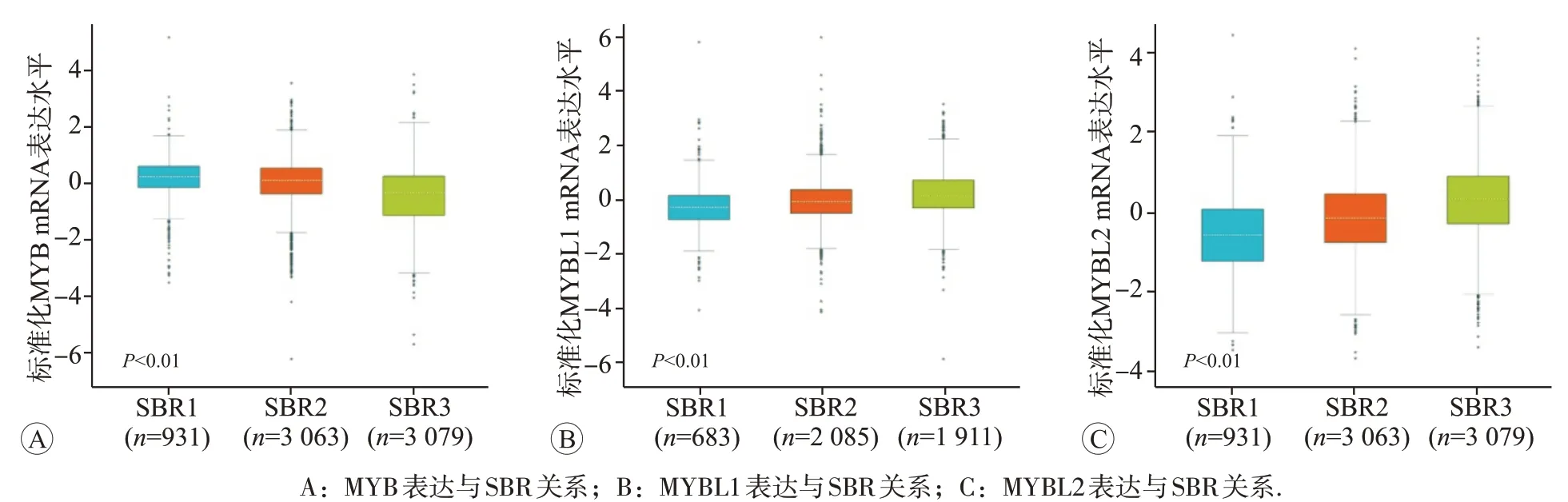
图4 MYB家族mRNA表达水平与乳腺癌患者SBR分级的关系(bc-GenExMiner v4.4 database)
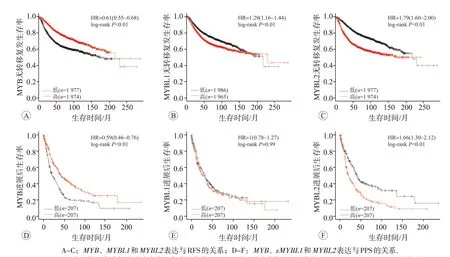
图5 MYB家族基因表达与乳腺癌患者无复发生存期(RFS)和进展后生存期(PPS)的关系(Kaplan Meier-plotter数据库)
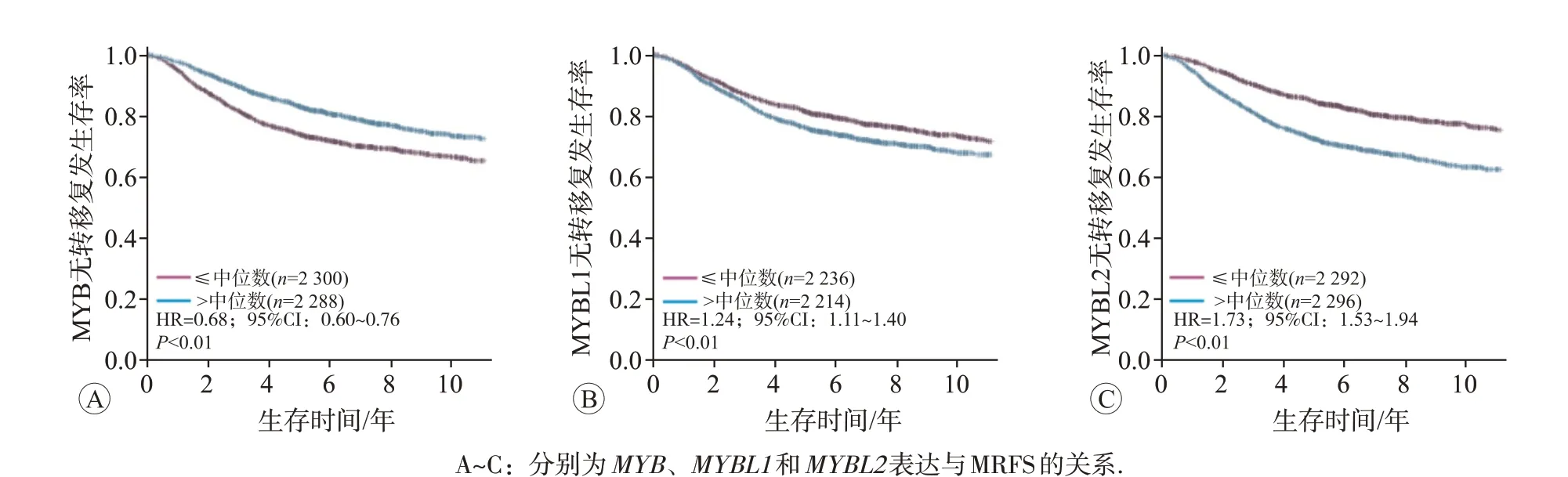
图6 MYB家族基因表达与乳腺癌患者无转移复发生存(MRFS)的关系(bc-GenExMiner v4.4数据库)
3 讨 论
MYB家族是介导多种肿瘤发生发展的重要转录调控因子家族,它们通过调控肿瘤细胞增殖、凋亡、迁移和侵袭等生物学过程,促进肿瘤恶性转化,具有典型的癌基因特征[4-5,7,11]。随着MYB家族在肿瘤研究中的不断深入,MYB家族及其相互作用蛋白、下游靶基因被认为是潜在的治疗靶点[4-5,28]。因此,在本研究中我们首次利用生物信息学方法,对MYB家族成员在乳腺癌中的表达和预后价值进行全面的分析,以期为乳腺癌发病机制和精准诊疗提供有价值的信息。
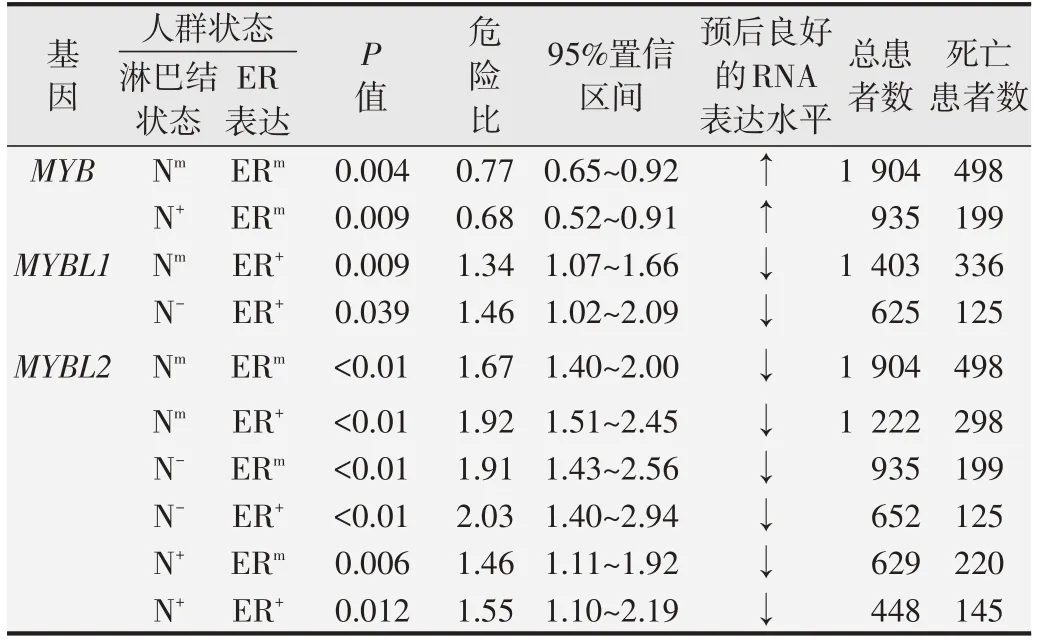
表4 bc-GenExMiner DNA 微阵列数据库中转移复发性乳腺癌的MYB家族单因素Cox分析
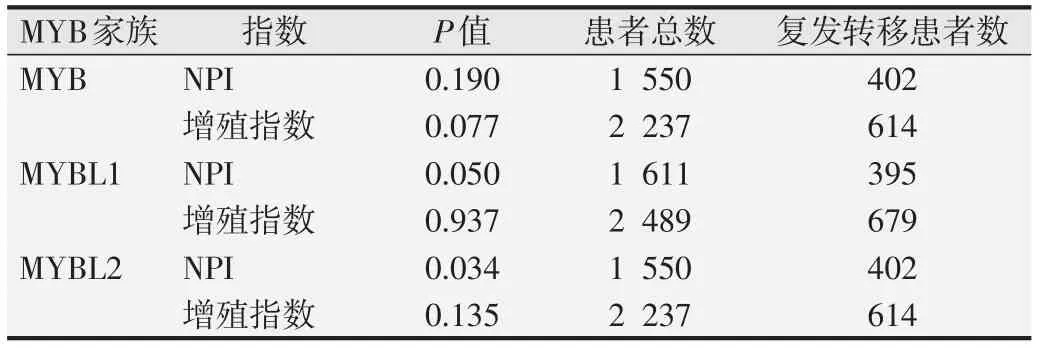
表5 MYB家族表达与NPI和增殖指数Cox分析
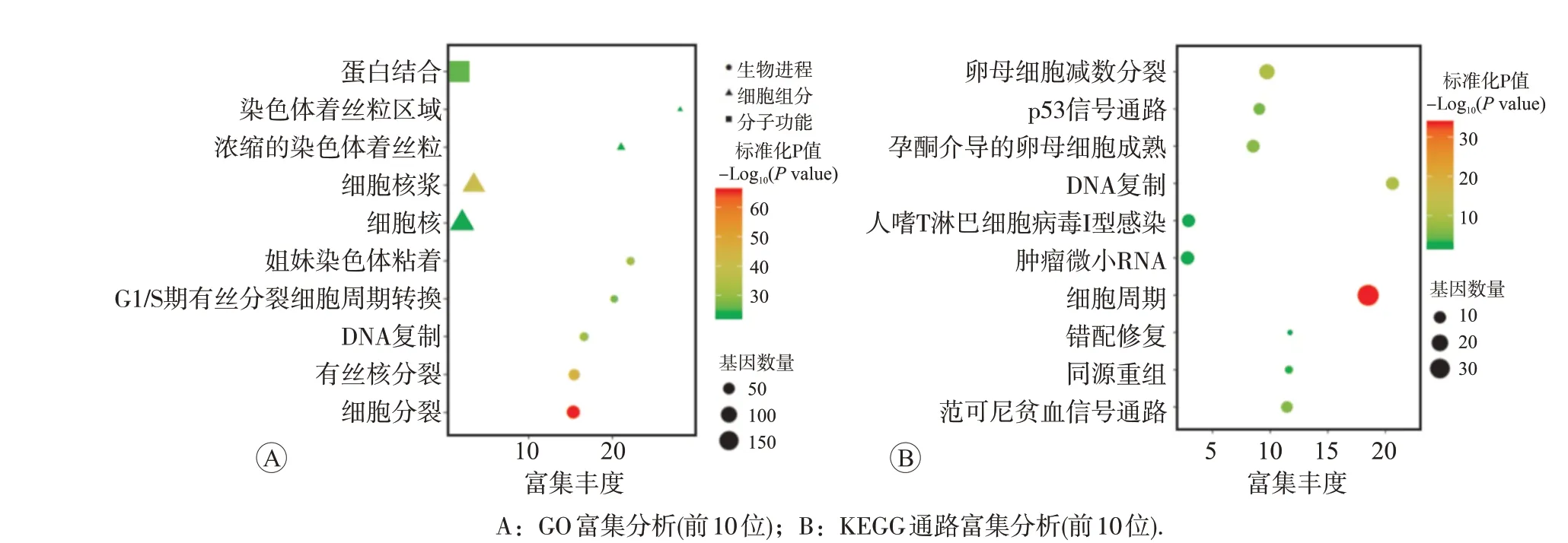
图7 乳腺癌中MYBL2共表达基因GO和KEGG富集分析(DAVID)
本研究结果显示MYB家族成员在乳腺癌组织中表达高于正常乳腺组织。MYB 家族主要通过基因扩增(MYBL1)、mRNA 转录增强(MYBL1、MYBL2)或减弱(MYB)方式,导致家族成员在乳腺癌中的异常表达。同时,MYB家族与乳腺癌分子分型相关。其中,MYB在ER+乳腺癌患者中表达升高,而在TNBC、BLBC 和P53突变乳腺癌患者中表达降低,提示MYB高表达的乳腺癌患者肿瘤恶性程度较低。研究表明,MYB表达与ER+密切相关[29]。在ER+乳腺癌细胞中,ER 与雌激素结合, 募集正性转录延长因子b(positive transcription elongation factor b,PTEFB),磷酸化RNA聚合酶II,促进MYB的转录活化[28-29]。因此,MYB 是雌激素/ER信号传导的效应因子,也是ER+细胞增殖和乳腺癌形成的必要因子[30]。与MYB结果相反,MYBL1和MYBL2在恶性程度较高的TNBC、BLBC和P53突变的乳腺癌中表达升高,并且MYBL2表达与淋巴结转移相关,进一步提示MYBL2 高表达的乳腺癌更具侵袭性。MYBL2 作为乳腺癌21 基因复发评分(21-gene recurrence score,RS)的细胞增殖指标之一,主要反映肿瘤细胞的生物学特性[31]。此外,MYBL2在TP53突变肿瘤中表达异常升高[32]。TP53 的突变造成p53-p21-DREAM复合物(Dimerization partner,RB-like proteins,E2Fs and MuvB core)对MYBL2转录抑制作用减弱,MYBL2 表达增强,克服了由于DNA 损伤等细胞应激条件下的细胞周期检验点阻滞,促进肿瘤细胞周期进展和细胞存活[33-34]。同时,MYBL2 通过干扰DREAM复合物的装配,并与MuvB (multi-vulva class B proteins)核心复合物相互作用形成更多的MMB(Myb-MuvB)复合物,促进有丝分裂基因转录,导致肿瘤细胞周期基因表达程序失调[33]。
虽然乳腺癌诊断和治疗水平不断提高,但患者转移复发的风险依然很高,且大多数乳腺癌患者的死亡归因于肿瘤转移[35]。本研究分析结果显示MYB低表达、MYBL1和MYBL2高表达乳腺癌患者RFS 缩短,患者转移复发风险增加。MYB 低表达和MYBL2 高表达乳腺癌患者PPS 缩短,预后较差。通过进一步单因素和多因素校正分析,我们发现MYBL2能作为乳腺癌患者MRFS 的独立预后因子。Dedić等[13]通过免疫组化分析证实MYBL2表达水平对乳腺癌患者总生存(OS)和无病生存(DFS)预后有显著影响,可作为独立预后因素。此外,MYBL2 在乳腺癌细胞中通过SNAIL 介导EMT 转化和细胞侵袭,加速乳腺癌细胞转移[36]。MYBL1在乳腺癌中尚缺乏系统研究,但在乳腺腺样囊性癌中,MYB和MYBL1通过基因重排,形成MYBNFIB、MYBL1-NFIB融合基因,成为这种特殊类型乳腺癌的致癌驱动因子和诊断指标[7-8]。
研究表明,MYBL2主要在G1晚期和S期表达,是参与细胞周期进展的重要调控因子[33]。在乳腺癌细胞中,由于基因扩增或转录调控异常导致MYBL2 高表达,形成的MMB 复合物直接转录调控中心纺锤体蛋白和有丝分裂驱动蛋白基因,促进肿瘤细胞增殖和细胞存活[37]。同时,我们分析乳腺癌中MYBL2共表达基因,这些基因主要富集于细胞核质和染色体着丝粒细胞成分,发挥蛋白结合分子功能,影响DNA复制、细胞周期G1/S转化、有丝分裂等生物过程和细胞周期相关信号通路。
综上所述,通过多平台数据整合分析MYB家族成员在乳腺癌中的表达和预后价值,我们认为乳腺癌具有典型的“MYB家族依赖型肿瘤”特征。MYB家族成员在乳腺癌中异常表达,与乳腺癌分子分型相关。MYB低表达、MYBL1和MYBL2高表达患者乳腺癌复发、转移风险增加,预后差。这些结果揭示了MYB家族在乳腺癌恶性转化中起着重要的作用。MYBL2主要通过调控细胞周期促进乳腺癌细胞增殖,可作为乳腺癌潜在有效的诊断、预后预测的生物标志物。这些认识和发现将为临床乳腺癌患者的管理提供参考,也为后续深入开展分子机制研究和药物开发提供依据和方向。

