海藻酸单糖钙的制备及其补钙功效研究
王平贵 张 浩 周林卉 徐华蕾 李 焱 陈 宏刘晶营 魏玉西,*
(1 青岛大学生命科学学院,山东 青岛 266071;2 青岛海之林生物科技开发有限公司,山东 青岛 266200)
海藻酸(alginic acid)是由β-D-甘露糖醛酸(M段)和α-L-古洛糖醛酸(G段)两种结构单元以GG、GM、MG和MM 4种方式按照α-1,4糖苷键连接形成的一种无规则线性聚合物[1]。海藻酸具有多种生理功能,如抗肿瘤[2]、免疫调节[3]、调节血脂和抗氧化[4]等,然而海藻酸在医药方面的应用受其黏度的限制,需将海藻酸多糖降解,降低其凝胶特性,才能更好的发挥功效。海藻酸单糖具有良好的溶解性,且具有独特的生理活性,如促进角质形成细胞[5]、抗凝血、降低血液粘度及改善微循环等[6],而寻找适合海藻酸降解的方法,已成为制备海藻酸单糖的技术关键。
海藻酸在水溶液中易发生降解,常表现为粘度下降,还伴随着相对分子质量分布范围不断变化[7]。目前降解海藻多糖的方法主要有酶降解法[8-9]、物理降解法[10-11]和化学降解法[12-13]。酶降解法虽然高效,但是酶存在严格的专一性,每种酶只对特定的分子结构起作用,因此酶降解法适合制备海藻酸寡糖[8-9];物理降解法降解海藻酸效果不明显,仅适合制备海藻酸寡糖[10-11];化学降解法中的酸降解法和碱降解法易造成环境污染,而H2O2氧化降解海藻酸时,虽可自行降解成水和氧气,但也难获得单糖制品[12-13]。因此,为制备海藻酸单糖制品,需联合使用两种或多种降解方法。海藻酸制备寡糖的研究报道较多,但有关制备海藻酸单糖的研究鲜有报道。
海藻酸单糖含有的酸根离子可以与钙结合制备海藻酸单糖钙。钙是人体内含量最丰富的矿物质元素之一,约占体重的1.5%~2.0%[14],是维持人体生命活动所必需的常量元素之一[15]。缺钙是世界各国普遍存在的问题[16],膳食中钙长期摄入不足,不仅影响人们的生长健康,而且不利于骨骼发育,尤其对儿童[17]、绝经妇女[18]及老年人[19]影响更为严重。因此选择有效的补钙制剂是预防与治疗钙缺乏的有效手段。海藻酸单糖钙作为一种有机酸钙,相较于普通无机钙具有良好的溶解度,因此海藻酸单糖钙可以作为一种新型补钙制剂,但目前关于海藻酸单糖钙的制备及其活性的研究尚鲜见报道。
本研究通过高温降解海藻酸制备小分子海藻酸,再通过H2O2进一步氧化降解制备海藻酸单糖;探索海藻酸单糖及结合钙的制备工艺,并将结合钙用于大鼠补钙试验以检验其补钙效果,以期为海藻酸单糖的制备及应用提供基础数据,同时为贝壳资源的高值化利用提供新的方法。
1 材料与方法
1.1 材料与试剂
海藻酸,大连美仑生物技术有限公司;扇贝壳,购自青岛市麦岛市场;30%H2O2,莱阳经济技术开发区精细化工厂;α-萘酚,北京索莱宝科技有限公司;水合氯醛,大连美仑生物技术有限公司;葡萄糖酸-δ-内酯,成都格雷西亚化学技术有限公司;正丁醇、甲酸、硫酸铈、钼酸胺、浓硫酸,青岛世纪星化学试剂有限公司。
Molish试剂,配制成5% α-萘酚乙醇溶液,备用。SD雄性大鼠(4周龄),斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016—0002,体重约为100.00±10.00 g。
1.2 主要仪器与设备
TJYF-A-GKCF-1微型反应釜,上海越众仪器设备有限公司;FD-1D-50真空冷冻干燥机,北京博医康实验仪器有限公司;FT-IR红外光谱仪,美国Nicolet公司;TD5M-WS多管架自动平衡离心机,上海卢湘仪离心机仪器有限公司;RE-52旋转蒸发器,上海亚荣生化仪器厂;BC-2800全自动动物血液细胞分析仪,深圳Mindray医疗器械;GK99-UNIGAMMAX-RAYPLUS双能X射线骨密度仪,意大利Lcan公司。
1.3 试验方法
1.3.1 钙源贝壳粉的制备 扇贝壳清洗干净,之后用0.05 mol·L-1盐酸浸泡2 h,再以自来水冲洗后粉碎至60~80目,水飞法除去密度较大颗粒,之后烘干得钙源贝壳粉,即为合成海藻酸单糖钙的钙源[6]。
1.3.2 海藻酸单糖的制备
1.3.2.1 海藻酸高温降解的单因素试验 准确称取适量海藻酸,用蒸馏水溶解,混匀,置于微型高温反应釜中加热降解。海藻酸高温降解基本条件:料液比1∶25、 降解温度120℃、降解时间150 min。改变其中一个条件以分别考察不同高温降解温度(100.0、110.0、120.0、122.5、125.0、127.5和130.0℃)、不同高温降解时间(90、120、135、150、165和180 min)和料液比(1∶10、1∶20、1∶25、1∶30、1∶35和1∶40)对海藻酸降解的影响。根据公式计算海藻酸降解率:
(1)。
1.3.2.2 海藻酸氧化降解的单因素试验 准确称取适量海藻酸,用蒸馏水溶解,混匀,置于恒温水浴锅中恒温加热,进行海藻酸的氧化降解。海藻酸氧化降解的基本条件:海藻酸与30%H2O2之比为1∶4、降解温度90℃、降解时间90 min。改变其中一个条件以分别考察不同氧化降解温度(80.0、85.0、87.5、90.0、92.5和95℃)、不同氧化降解时间(30、60、90、120、150和180 min)及海藻酸与30%H2O2比例(1∶2、1∶3、1∶4、1∶5、1∶6和1∶7)对海藻酸降解的影响。根据公式(1)计算海藻酸降解率。同时通过Molish反应[20],鉴定单糖结构是否被破坏。
1.3.2.3 海藻酸降解正交试验设计 根据单因素试验结果,以高温降解海藻酸的降解温度(A)、高温降解时间(B)、海藻酸与水的料液比(C)及H2O2氧化降解海藻酸的降解温度(D)、海藻酸与30%H2O2比例(F)、氧化降解时间(E)为因素,设计六因素五水平的正交试验(表1),探究降解海藻酸的最佳组合。
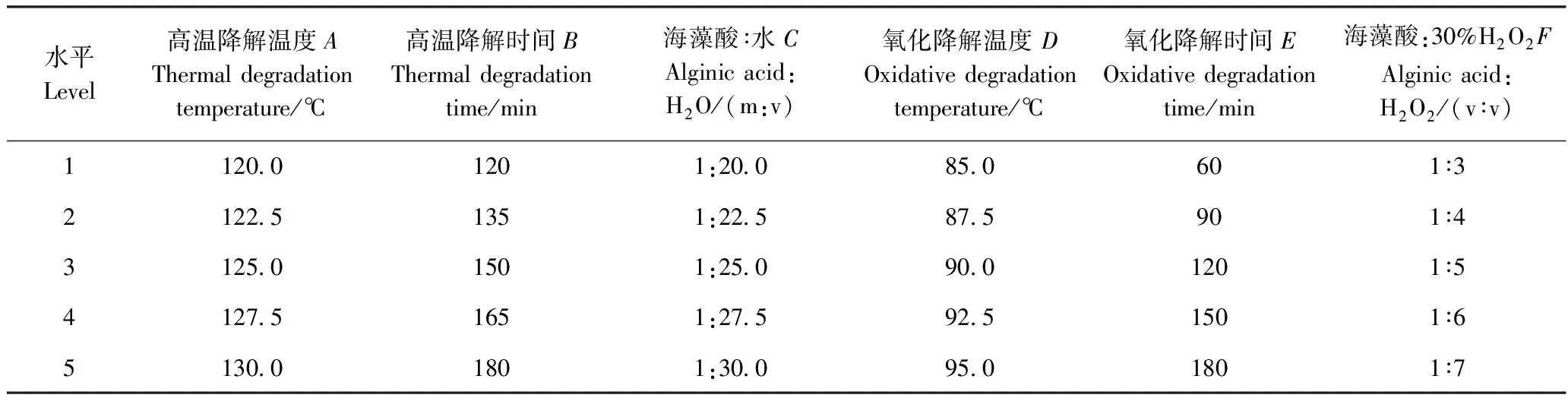
表1 正交试验因素水平表Table 1 Levels and factors of orthogonal experiment
1.3.3 海藻酸降解液预处理 参照文献[21]的方法,略作修改,将最优条件下制得的海藻酸溶液4 000 r·min-1离心10 min,去沉淀后加入2倍体积的95%乙醇,4℃过夜,于4 000 r·min-1离心10 min,去除沉淀后所得溶液即为海藻酸单糖溶液,于50℃条件下旋转蒸发除去乙醇浓缩,然后冷冻干燥,所得产物即为海藻酸单糖。
1.3.4 海藻酸单糖钙的制备 将冻干得到的海藻酸单糖按1∶8(m∶m)溶解于蒸馏水中,按照海藻酸单糖与Ca2+的反应摩尔比2∶1添加钙源贝壳粉,于30℃水浴搅拌12 h,抽滤去除沉淀,得海藻酸单糖钙溶液。将所得溶液添加乙醇(95%)至乙醇浓度90%,于4℃冰箱过夜,再4℃、4 000 r·min-1离心20 min,收集沉淀、冻干,即制得海藻酸单糖钙。使用乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)法测定海藻酸单糖钙的含钙率,并计算其结合率。
1.4 海藻酸单糖及结合钙的结构表征
1.4.1 傅里叶变换红外光谱 参照文献[22]的方法,采用KBr压片法,测定海藻酸、海藻酸单糖及海藻酸单糖钙的红外光谱图。分别取约2.00 mg样品研磨,然后与100.00~200.00 mg干燥KBr粉末充分混合,并再次研磨1~2 min,压片。以KBr空白,扫描范围4 000~400 cm-1。
1.4.2 薄层色谱分析(thin-layer chromatography,TLC) 参照文献[23]的方法,将已制备的海藻酸单糖和海藻酸单糖钙,使用毛细管分别点样到硅胶板上,在展开剂(V正丁醇∶V甲酸∶V水=4∶6∶l)中展开分离,于110℃显色(显色剂配方:20.00 mg 硫酸铈、50.00 mg 钼酸胺、5.00 mL 98% H2SO4溶于95.00 mL乙醇中)。以葡萄糖酸-δ-内酯标准品为对照。
1.5 动物试验评价
1.5.1 动物试验 SD大鼠在温度23±3℃,湿度50%±10%的动物房中以12 h光照/12 h黑暗循环饲养。在自由进食和进水适应饲养1周后,随机分为6组,每组6只。试验以不同钙离子浓度(50、75 和100 mg·mL-1) 设置3个剂量组,同时设置一个碳酸钙对照组(75 mg·mL-1)、正常对照组以及一组低钙模型组,具体分组如表2所示。试验过程中,正常对照组的大鼠喂食正常饲料,其他5个组大鼠喂食低钙饲料,6个组均自由饮用去离子水。在为期4周的试验过程中,在给大鼠喂养饲料的同时灌胃样品,每天上午10点给大鼠灌胃,每周记录体重和摄食量。
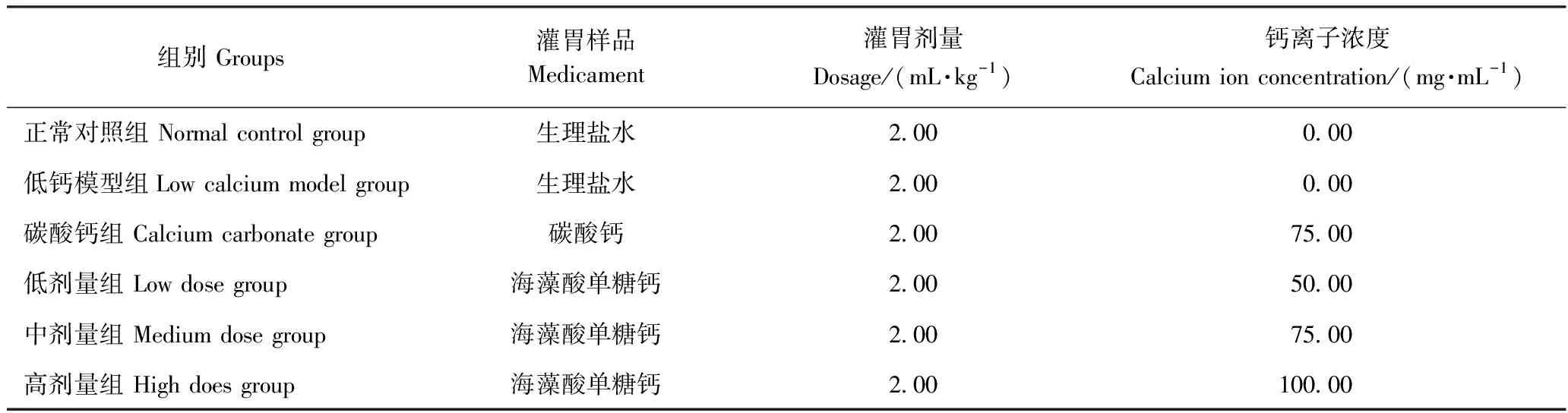
表2 功能性动物试验分组Table 2 Animal experiment grouping
试验进行4周后,将大鼠禁食12 h后利用水合氯醛麻醉,立即通过腹主动脉取血法收集血样并以4 000 r·min-1离心10 min取血清,用于血清分析。同时摘取心、肝、脾、肺、肾脏器,用生理盐水冲洗后称量,记录大鼠脏器重量,计算内脏指数。

(2)
(3)
(4)
(5)

(6)。
1.5.2 血清分析 在全自动动物血液细胞分析仪上分析各试验组大鼠血清中血钙、血磷、血镁及碱性磷酸酶的含量。
1.5.3 股骨骨密度测定 取出小鼠左侧股骨,于室温下平衡60 min,采用双能X线骨密度仪扫描股骨,并使用配套软件分析股骨密度。
1.6 数据分析
采用SPSS 20.0软件进行统计分析,试验结果以mean±SD形式表示。通过单因素方差分析各组间数据差异性,P<0.05表明具有统计学意义。
2 结果与分析
2.1 海藻酸降解单因素试验结果
2.1.1 海藻酸高温降解单因素试验结果 由图1-A可知,海藻酸的降解率随着高温降解温度的升高而大幅度增加。且在研究过程中发现,当降解温度升至125℃时,降解率增加缓慢,当降解温度升高至135℃后,海藻酸在高温反应釜中出现部分糊化,颜色加深,并伴有焦味,造成产率及品质下降。由图1-B可知,随着高温降解时间的延长,海藻酸降解率逐渐增加,当降解时间大于135 min时,海藻酸降解率缓慢上升;当高温降解时间达到180 min时,海藻酸降解率为65.74%。由图1-C可知,当海藻酸与水的料液比由1∶10 减小至1∶20时,海藻酸降解率增加明显,而当料液比小于1∶25时,海藻酸降解率增加缓慢;当料液比为1∶40时,海藻酸降解率为71.20%。通过以上结果,选用降解海藻酸温度为125℃、时间150 min、料液比为1∶25 进行后续正交试验。
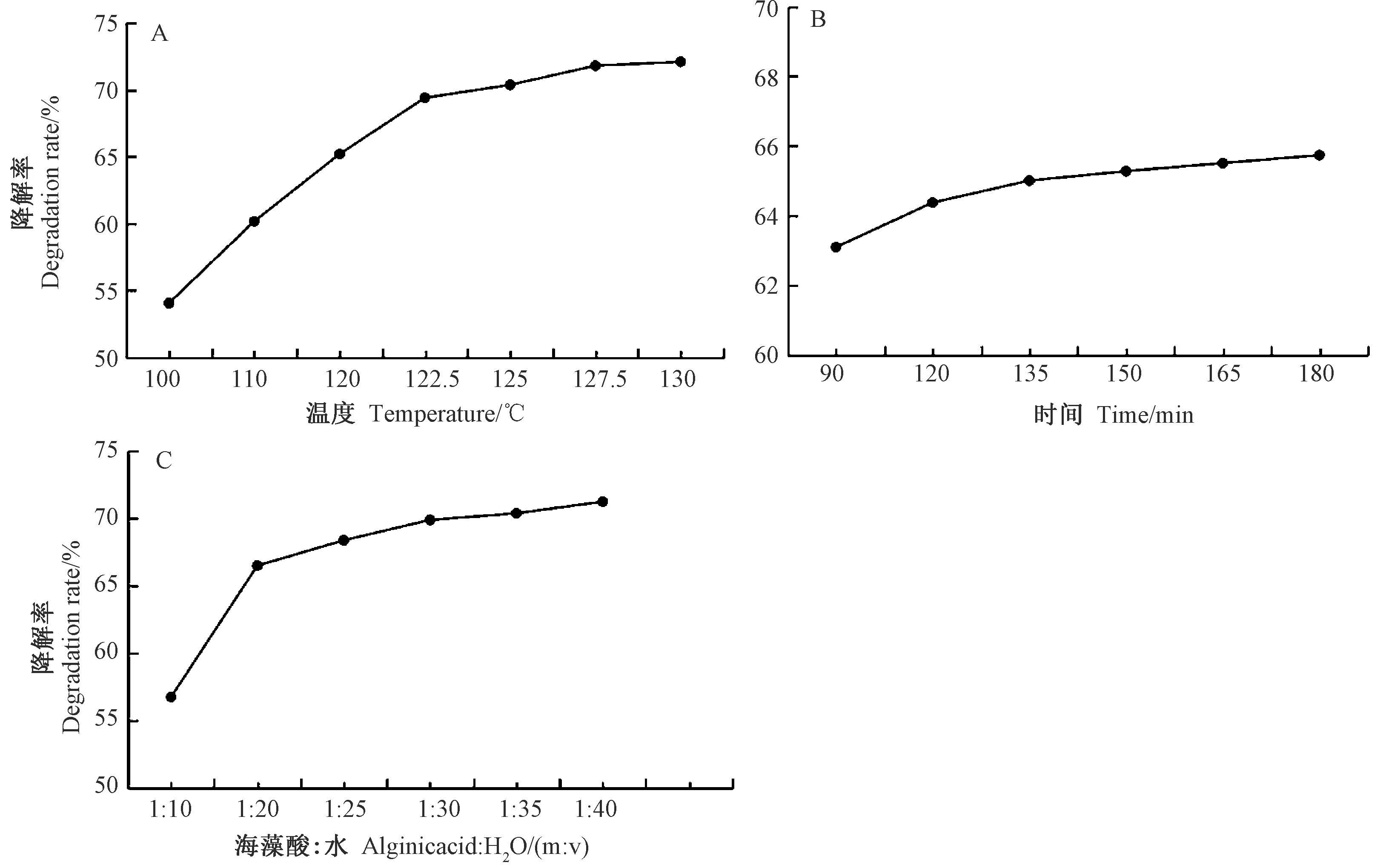
图1 海藻酸高温降解温度(A)、时间(B)和料液比(C)对其降解率的影响Fig.1 Effect of high temperature degradation temperature(A), time(B) and ratio of material to liquid (C) of alginic acid on its degradation rate
2.1.2 海藻酸氧化降解单因素试验结果 由图2-A可知,海藻酸在H2O2作用下,随着氧化降解温度的升高,海藻酸降解率先大幅度增加之后略有下降再缓慢增加,当降解温度升高到92.5℃,海藻酸降解率趋于平缓;降解温度达到95℃时,海藻酸降解率达到70.85%。由图2-B可知,海藻酸氧化降解时间为120 min时,其降解率达到最大值,为70.65%。由图2-C可知,当海藻酸∶30%H2O2为1∶5时,海藻酸的氧化降解率达到73.40%;当海藻酸∶30%H2O2达到1∶8(数据未列出)时,所得溶液通过Molish反应鉴定,单糖的结构部分被破坏,而海藻酸∶30%H2O2为1∶7时,Molish反应鉴定结果显示单糖结构并未破坏,此时海藻酸的降解率为73.65%。通过以上结果,选用氧化降解海藻酸温度90℃,时间120 min,海藻酸与30% H2O2比例为1∶5进行后续正交试验。
2.2 海藻酸降解正交试验结果与分析
由表3可知,在高温降解和氧化降解海藻酸的过程中,影响海藻酸降解速率的因素从大到小依次为高温降解温度>氧化降解时间>高温降解时间>海藻酸∶30%H2O2>海藻酸∶H2O>氧化降解温度。通过K值得出海藻酸降解的最佳条件组合为A5E4B5F5C3D4。然而,海藻酸∶30%H2O2的K3与K5值相近,为降低成本,海藻酸降解最佳组合为A5E4B5F3C3D4。通过验证试验,此条件下海藻酸降解率为80.68%。
2.3 海藻酸单糖钙结构表征
2.3.1 傅里叶红外光谱分析结果 由图3可知,海藻酸的特征峰位于3 364.04 cm-1、海藻酸单糖的特征峰位于3 332.58 cm-1,海藻酸单糖钙的特征峰位于3 347.21 cm-1,且3种物质的峰型基本相似,是缔合-OH的伸缩振动吸收峰。但是海藻酸单糖与海藻酸单糖钙吸收峰发生了偏移,这可能是海藻酸单糖与钙结合产生特殊分子空间结构造成的[24]。海藻酸在2 920.03 和2 631.34 cm-1处有特殊吸收峰,而海藻酸单糖及海藻酸单糖钙在此处无吸收峰,说明海藻酸在降解过程中,游离羟基发生内部脱水而形成双键,因此不再具有游离羟基的特殊吸收峰[25-26]。海藻酸的特征峰1 742.82 cm-1和海藻酸单糖的特征峰1 731.91 cm-1为游离-COOH 的-C=O的伸缩振动吸收峰,而海藻酸单糖钙中由于游离-COOH与钙发生结合,这2个特征峰完全消失,偏移至1 601.09 cm-1处,说明海藻酸单糖与钙离子形成了海藻酸单糖钙[20]。综合分析,海藻酸、海藻酸降解形成的海藻酸单糖及海藻酸单糖钙的结构并未发生本质变化,三者依然保持了单糖的基本结构,且海藻酸单糖与Ca2+结合生成海藻酸单糖钙。
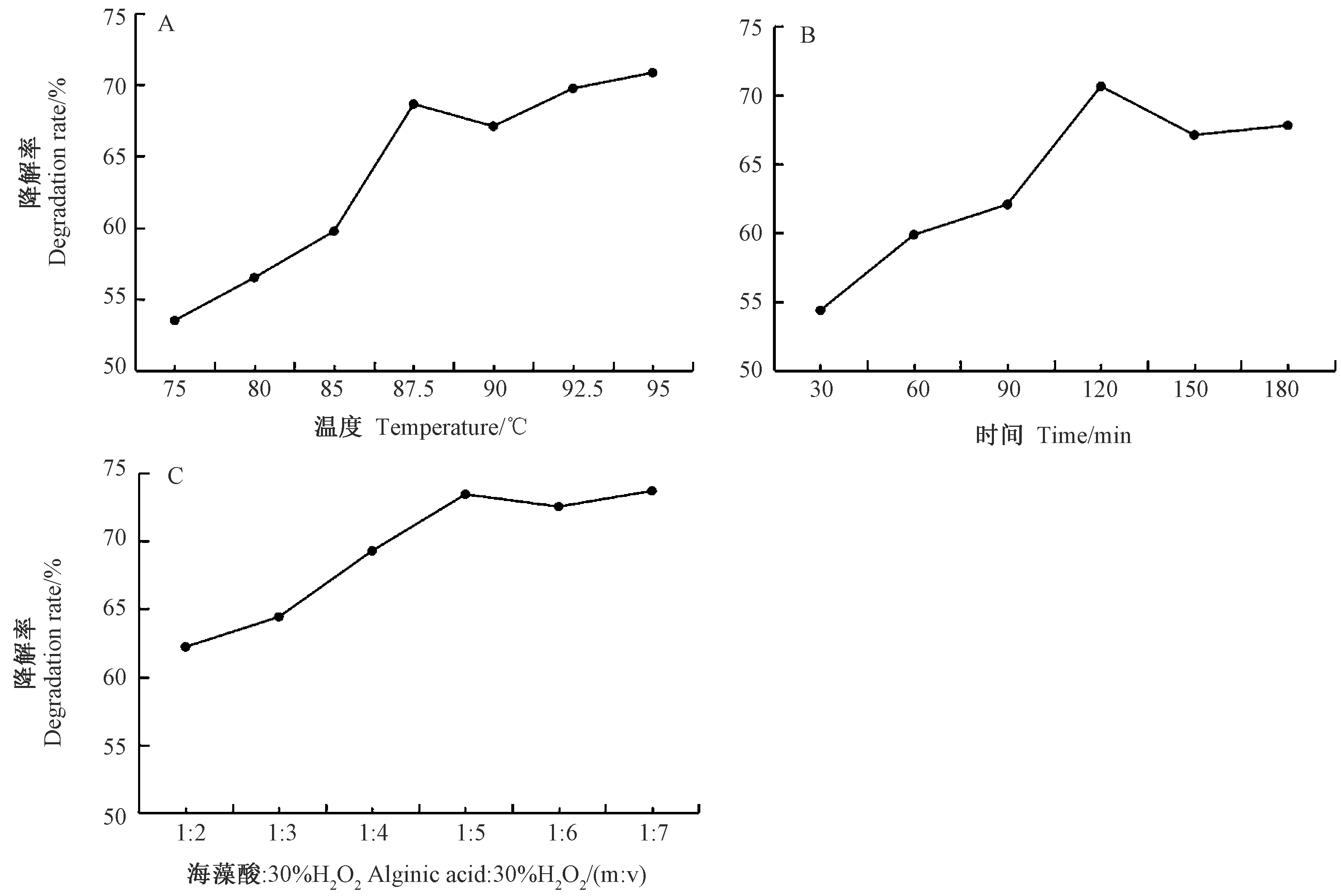
图2 海藻酸氧化降解温度(A)、时间 (B)和30%H2O2比值(C)对其降解率的影响Fig.2 Effect of oxidation degradation temperature(A),time(B) and 30%H2O2 ratio(C) of alginic acid on its degradation rate
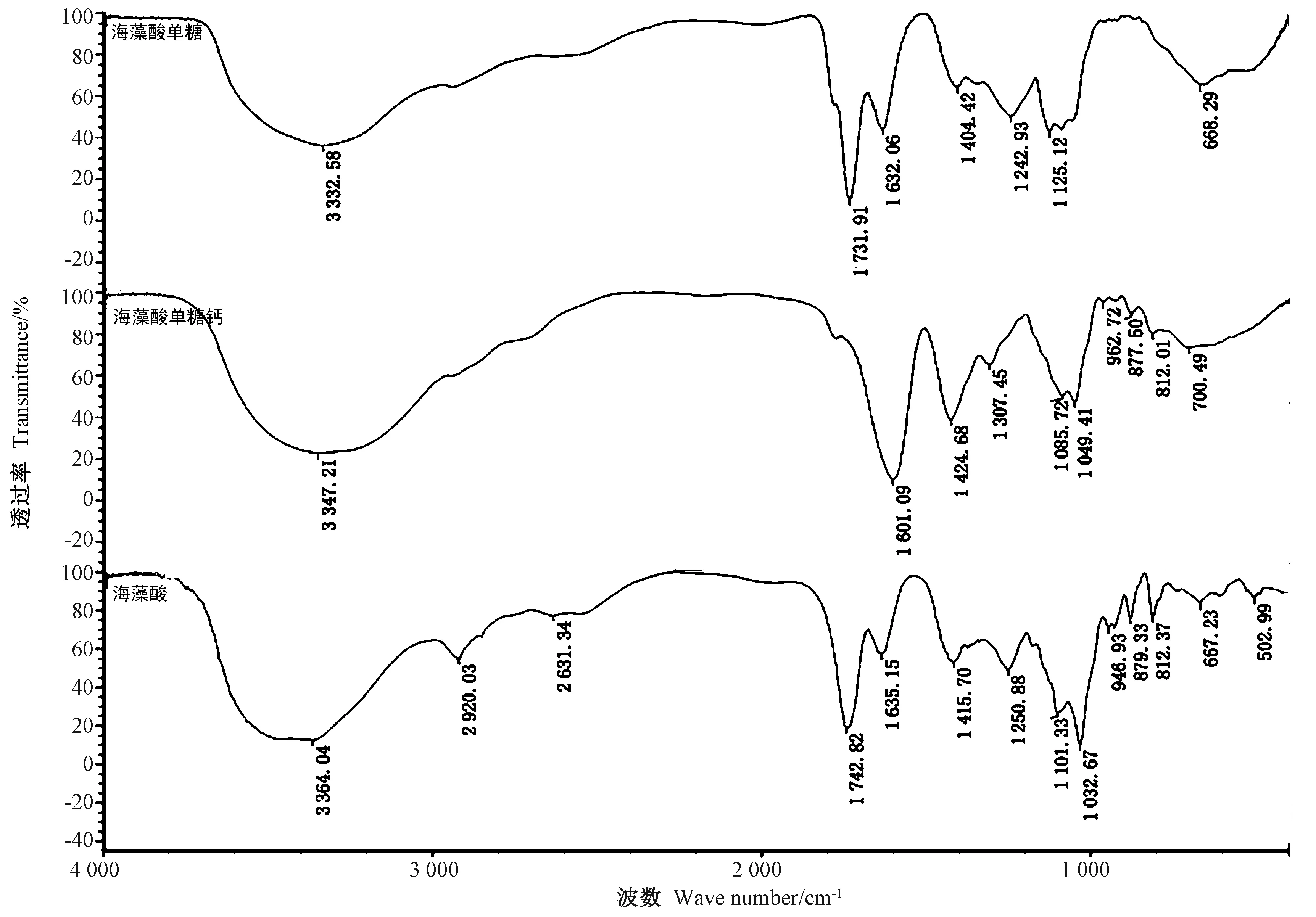
图3 海藻酸、海藻酸单糖与海藻酸单糖钙的傅里叶红外光谱比较Fig.3 FTlR spectra of alginic acid, alginic acid monosaccharide and conjugate complex with calcium
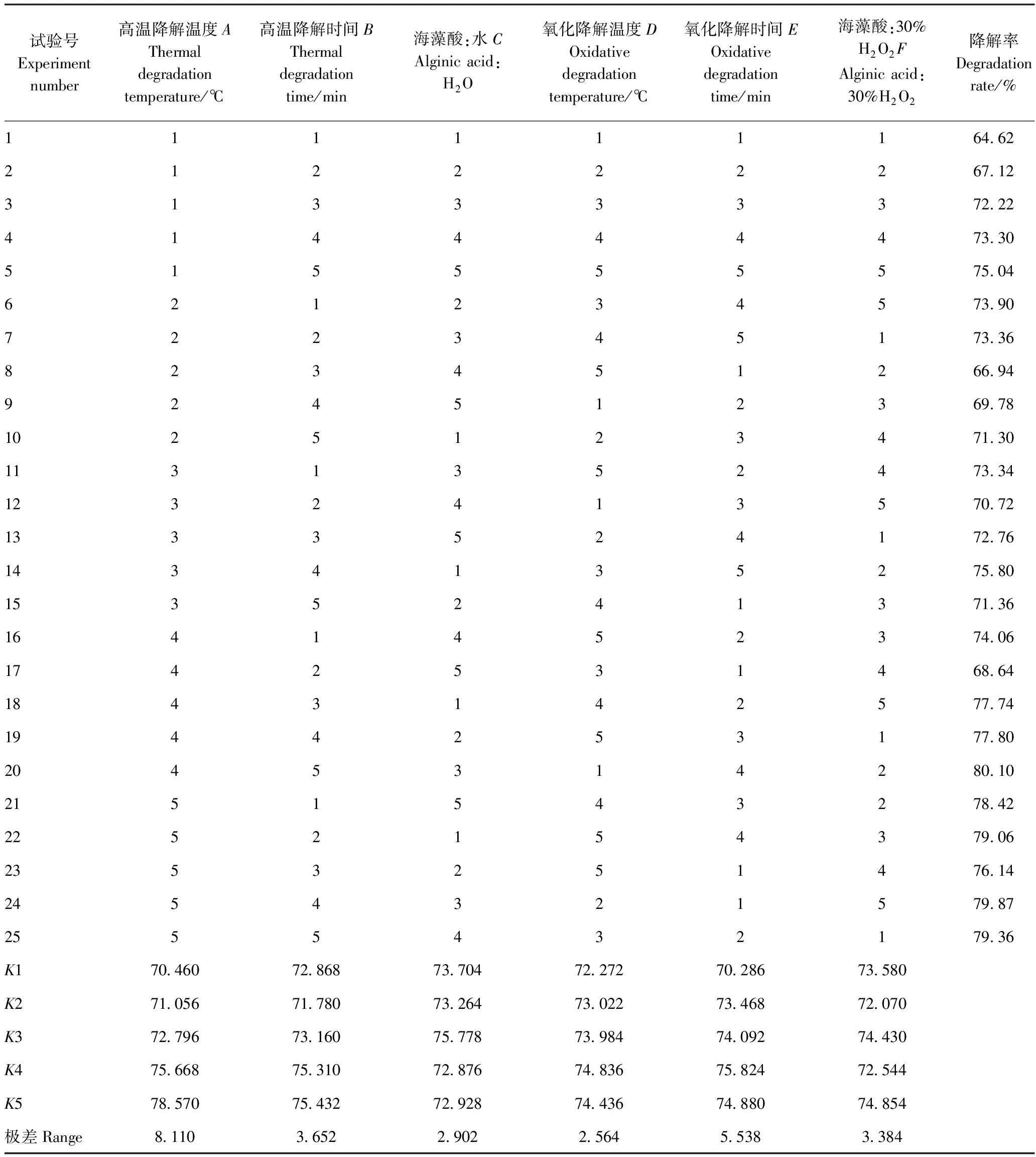
表3 海藻酸降解正交试验结果Table 3 Orthogonal test results of alginic acid degradation
2.3.2 薄层色谱分析结果 β-D-甘露糖醛酸和α-L-古洛糖醛酸两种糖醛酸的分子式均为C6H10O7,其分子结构、分子量及分子极性与葡萄糖酸-δ-内酯(C6H10O6)相近[27]。由图4可知,TLC硅胶板上的葡萄糖酸-δ-内酯(泳道1)、海藻酸单糖(泳道2)出现比移(retardation facter,Rf)值相似的一个斑点,说明这2个分子的极性和大小均相似,同时也说明制备的海藻酸降解液中主要成分为单糖制品[26,28],即为海藻酸单糖。海藻酸单糖与钙结合生成的海藻酸单糖钙(泳道3),其物理性质与海藻酸单糖相比发生一些改变,在TLC硅胶板显示与海藻酸单糖的Rf值有差异性,即海藻酸单糖与钙结合生成一种新的物质——海藻酸单糖钙。
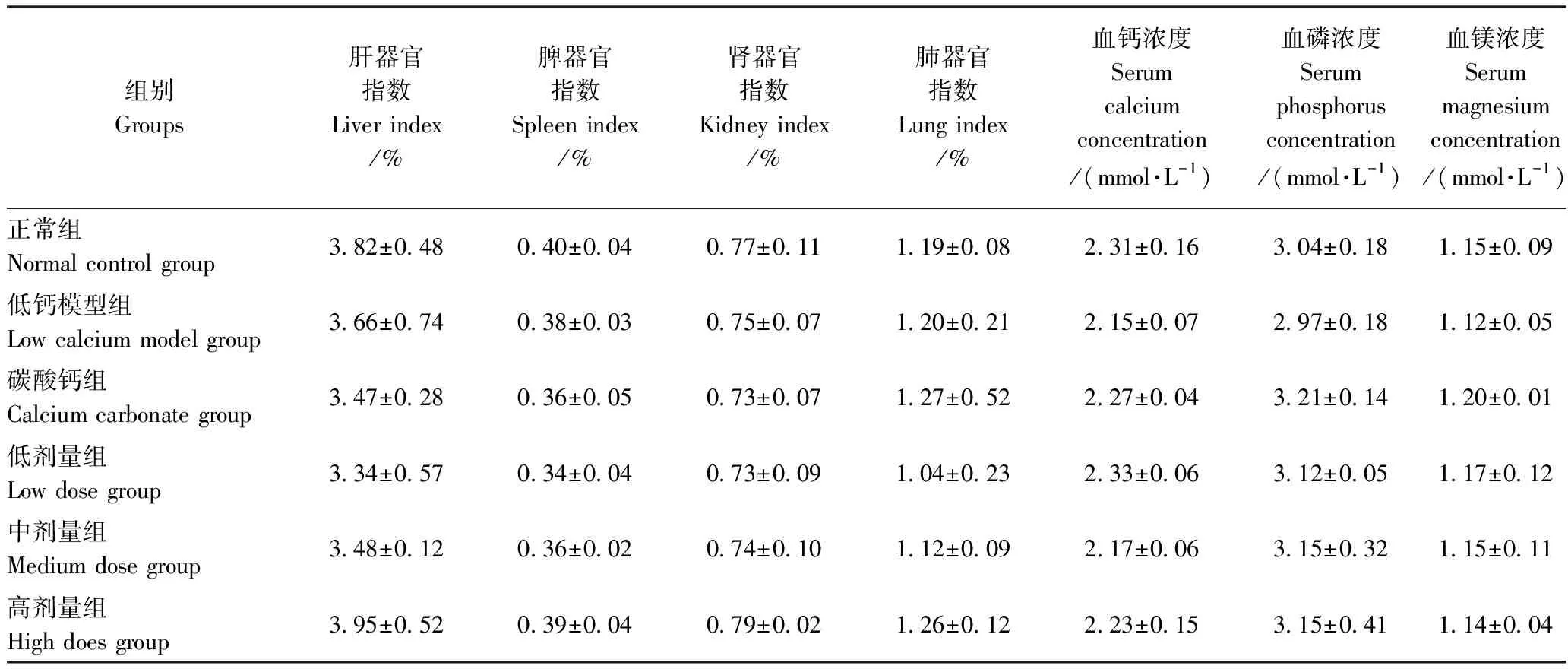
表4 大鼠内脏指数和血清指标(n=6)Table 4 Rat visceral index and serum index (n=6)

注:1:葡萄糖酸-δ-内酯;2:海藻酸单糖;3:海藻酸单糖钙。Note: 1: Glucono-δ-lactone. 2: Alginic acid monosaccharide. 3:Alginic acid monosaccharide calcium.图4 葡萄糖酸-δ-内酯、海藻酸单糖和海藻酸单糖钙薄层色谱分析图谱Fig.4 TLC of glucono-δ-lactone and alginic acid monosaccharide and conjugate complex with calcium
2.4 补钙功能动物试验评价结果
2.4.1 海藻酸单糖钙对大鼠体重的影响 由图5可知,喂食4周后各组大鼠的体重均有所增加,且试验结束后各试验组大鼠体重均与正常大鼠体重无显著差异(P<0.05)。

图5 海藻酸单糖钙对大鼠体重的影响Fig.5 The effect of alginic acid monosaccharide calcium on weekly body weight
2.4.2 大鼠内脏指数及血清分析 由表4可知,与正常组相比,低钙模型组、碳酸钙组和海藻酸单糖钙组的内脏指数无明显差异,表明海藻酸单糖钙对大鼠的内脏无损害。同时,低钙模型组、碳酸钙组和海藻酸单糖钙组中血钙、血镁和血磷浓度与正常组相比也未见明显差异。
2.4.3 骨碱性磷酸酶测定结果 骨碱性磷酸酶是评价骨质疏松与钙摄入不足的重要指标之一[29]。当体内钙营养不足时,生成的内骨组织不能钙化,骨细胞不能正常形成,导致成骨细胞分泌大量骨碱性磷酸酶入血,使其在血中的含量升高[30]。由图6可知,低钙模型组大鼠的骨碱性磷酸酶活性显著高于正常组;当喂食低钙饲料同时灌胃碳酸钙和海藻酸单糖钙后,碱性磷酸酶活性均较低钙模型组有不同程度的降低,其中中剂量和高剂量组大鼠碱性磷酸酶活性与低钙模型组相比显著降低。表明海藻酸单糖钙的补钙效果良好,在钙离子含量相同的情况下效果优于碳酸钙。

注:不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level. The same as following.图6 大鼠中骨碱性磷酸酶含量Fig.6 Bone alkaline phosphatase content in rats
2.4.4 股骨骨密度 由图7可知,与正常组相比,低钙模型组大鼠股骨骨密度显著降低,说明大鼠由于钙摄入不足导致股骨骨密度降低。在摄入碳酸钙和海藻酸单糖钙后,其骨密度均有不同程度的增加。与低钙模型组相比,碳酸钙组和海藻酸单糖钙中剂量及高剂量组均显著增加了大鼠股骨骨密度,而且海藻酸单糖钙增加骨密度的效果呈剂量依赖性。中剂量组与高剂量组的骨密度相比差异不显著,说明中剂量海藻酸单糖钙就能达到良好的补钙效果。同时,海藻酸单糖钙中剂量与碳酸钙组相比具有显著增加骨密度的效果,说明海藻酸单糖钙比碳酸钙的补钙效果更好。
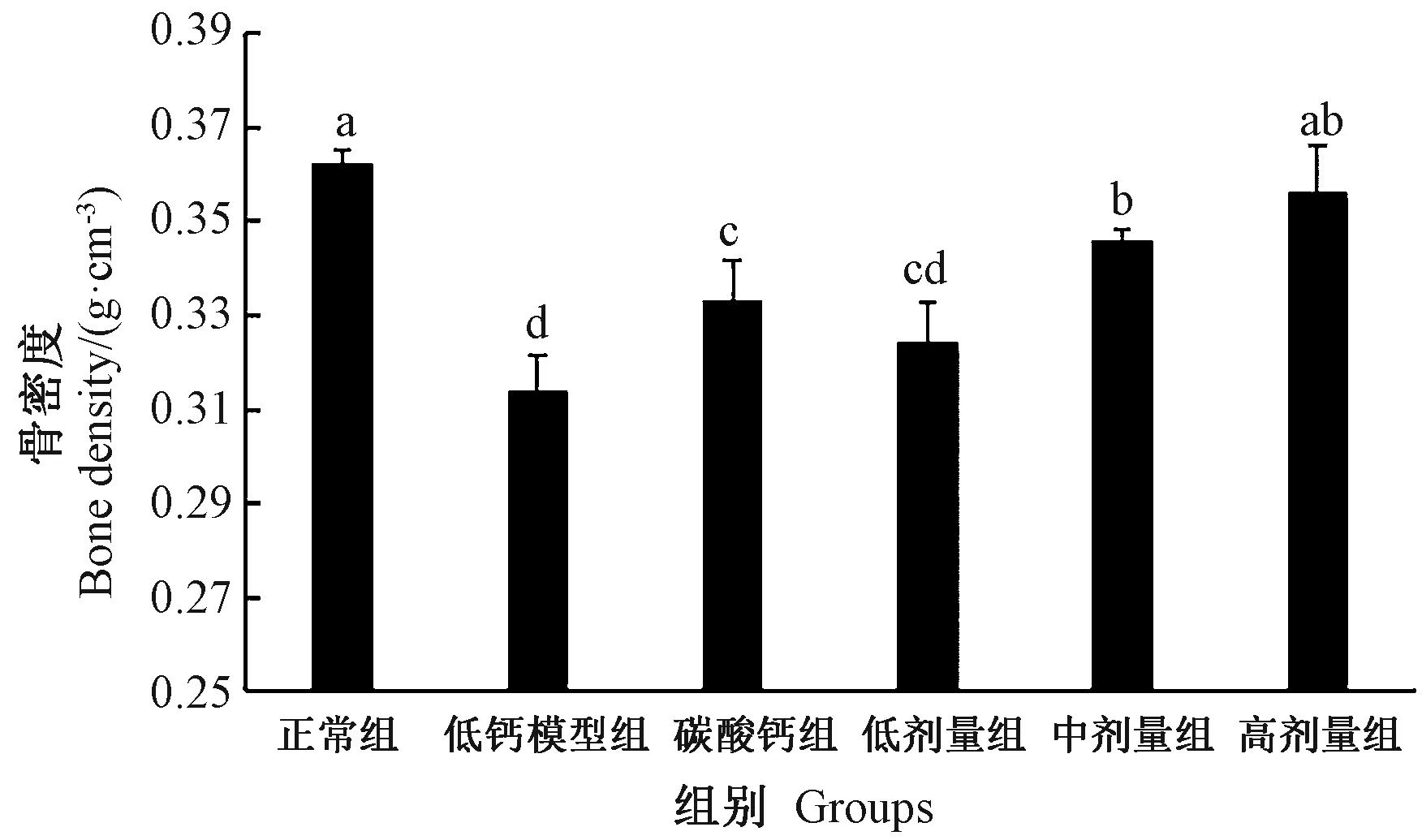
图7 大鼠股骨骨密度Fig.7 Femur bone density in rats
3 讨论
海藻酸结构很不稳定,无论是在水溶液中还是干燥状态的海藻酸,均会发生不同程度的降解[7],这是由于组成海藻酸的两种单糖β-D-甘露糖醛酸和α-L-古洛糖醛酸是以糖苷键结合而成的,而海藻酸的降解发生在1,4糖苷键处[31]。本研究发现随着高温降解温度的升高,降解时间的延长,料液比的降低,海藻酸降解率整体呈上升趋势,这与席国喜等[26]以干燥的海藻酸进行热降解处理,并通过热重法(thermogravimetry, TG)和差示扫描量热法(differential scaning calorimetry, DSC)等研究海藻酸的降解过程,发现海藻酸在60~170℃范围内,只脱去内部结合水的变化结果不一致,可能是由于干燥的海藻酸在60~170℃降解时并未发生糖苷键的断裂;但是李博等[31]和马成浩等[7]的研究结果显示海藻酸在60~140℃加热降解,不仅脱去内部水,而且表现为分子量减小,这与本研究结果一致,即海藻酸在水溶液中加热至60~140℃时,发生糖苷键的断裂,形成更小分子的糖。本研究中,温度升高至135℃时或降解时间过长时,海藻酸降解产物的颜色加深,并伴有焦味,影响产品品质。
氧化剂H2O2能够在溶液中产生羟自由基,羟基自由基会随机夺取糖苷键上的H原子,从而导致海藻酸的糖苷键断裂,产生更小分子量的糖[32]。曹柳[27]认为H2O2氧化降解海藻酸钠主要发生在前30 min,2 h后降解速率趋于平缓,而且H2O2浓度越高及温度越高,海藻酸降解越快,更容易得到相对分子量小的寡糖。随着氧化降解温度的升高,可以使H2O2产生更多的羟基自由基,同时高温也能够促进海藻酸寡糖进一步降解,促进海藻酸降解产生更多的单糖[27-28]。在H2O2氧化降解海藻酸的研究中H2O2都是按照溶液体系的百分比添加[27-28],不能够明确H2O2与海藻酸的用量比例,本研究首次明确了降解海藻酸使用30%H2O2的用量,使H2O2氧化降解海藻酸的用量更加科学。同时,H2O2在92.5℃加热2 h完成对海藻酸的降解后,使用淀粉碘化钾试纸未检测到溶液中有H2O2,说明H2O2能够自行降解,因而不会造成H2O2残留的问题。
海藻酸经高温降解和H2O2氧化降解得到的单糖并未发生结构的改变,而且能够与钙结合制成海藻酸单糖钙。从海藻酸、海藻酸单糖及海藻酸单糖钙的傅里叶变换红外光谱比较可知,海藻酸单糖钙是一种不同于海藻酸多糖和单糖的新物质,同时关键的官能团并没有变化。张真庆等[23]和刘亿婕[28]通过薄层色谱研究甘露糖醛酸、葡萄糖醛酸和古洛糖醛酸等单糖及其各自寡糖时发现,薄层色谱能够很好地分离不同分子量的寡糖,且相同分子量寡糖的Rf值相同。葡萄糖酸-δ-内酯、海藻酸单糖及结合钙都能够在硅胶板上形成单一的斑点,说明所制备的海藻酸降解液及钙盐都为单糖制品,且古洛糖醛酸和甘露糖醛酸的极性是相似的。因此,通过高温降解、氧化降解及醇沉后的海藻酸降解产物都为单糖,这也为制备海藻酸单糖提供了一种新的方法。
骨碱性磷酸酶是评价骨形成和骨转换的重要指标,可直接反映成骨细胞活性,促进骨盐形成,增加成骨活性,从而增加骨密度[30]。为期4周的动物试验表明,海藻酸单糖钙能够有效降低低钙大鼠模型血清内的骨碱性磷酸酶活性,而骨碱性磷酸酶活性与骨密度成反比,因此海藻酸单糖钙能够增加成骨细胞活性,这一结果在检测股骨骨密度时得到了证实,而且海藻酸单糖钙不会对大鼠产生不良影响。中剂量组的海藻酸单糖钙和碳酸钙都能够降低骨碱性磷酸酶的活性,通过检测大鼠股骨骨密度发现海藻酸单糖钙增加骨密度的效果显著优于碳酸钙组。因此在钙浓度相同的情况下,海藻酸单糖钙比碳酸钙更容易被机体利用。
4 结论
本研究结果表明,相对于单一方法,高温与氧化降解相结合的方法能够高效地得到海藻酸单糖,且海藻酸单糖能够与钙源贝壳粉反应合成海藻酸单糖钙。海藻酸单糖钙的补钙功能动物试验结果表明,海藻酸单糖钙能在动物体内显著发挥其补钙效果且对内脏器官无明显损伤。本研究为海藻酸单糖及其结合钙的制备提供了新的方法,同时海藻酸单糖钙有望为骨质疏松人群提供一种新的、安全性高的高效补钙制剂。但是,海藻酸单糖钙在人体内如何影响人体骨密度的机制还有待考证,糖醛酸能否在人体内发挥其特有活性也有待进一步研究。

