低温贮藏对猕猴桃果实成熟软化相关基因表达影响
朱婷婷 陈景丹 方筱琴 刘 璐 秦 娟 陈 伟 杨震峰 施丽愉
(浙江万里学院生物与环境学院,浙江 宁波 315100)
猕猴桃(ActinidiachinensisPlanch)是猕猴桃科猕猴桃属常绿藤本果树,营养丰富,具有极高的营养保健价值,且肉质鲜美,风味独特,深受人们喜爱[1]。猕猴桃一般每年9月份成熟,采收时气温较高,且猕猴桃属于典型的呼吸跃变型果实,极易变软腐烂,失去食用价值。低温贮藏是猕猴桃采后保鲜的一种重要手段。研究表明,低温贮藏能有效维持猕猴桃果实的硬度,延缓腐烂速率,改善果实着色,减少营养物质的消耗,从而延缓果实的成熟衰老,提高果实的贮藏品质[2]。但有关猕猴桃果实低温贮藏淀粉降解与果实软化进程之间关系的研究鲜见报道。
果实成熟过程中产生大量内源乙烯,并参与果实多糖水解、香味物质产生、硬度下降等其他生理生化的调控。Gwanpua等[3]和马秋诗[4]研究发现,低温贮藏可抑制猕猴桃果实乙烯的产生,延缓果实的成熟软化。此外,低温可促进葡萄果实1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxilic, ACC)合成并激活ACC氧化酶(ACC oxidase, ACO)活性[5],增强梨果实ACC合成酶基因表达,从而促进内源乙烯的合成[6]。在植物中,ACC合成酶(ACC synthase,ACS)和ACO被认为是乙烯合成关键酶,两者均通过调节ACC活性来调控乙烯的生成和释放。Li等[6]研究发现,低温可能改变梨果实中乙烯信号转导通路的下游元件,降低ETR1的表达;殷学仁[7]发现低温可诱导猕猴桃果实中大部分乙烯信号转导基因的表达。乙烯一旦合成后,通过乙烯受体(ethylene receptor,ETR)感知,经过信号转导途径(signal transduction pathway)诱导与乙烯反应相关基因的表达,从而发挥乙烯的生物学效应[8]。通过对拟南芥、烟草等模式植物相关突变体的分离和基因组学分析,基本确立了植物的乙烯信号转导的线性模型,该模型主要由5个级别元件组成,分别为乙烯受体(ETRs)、CTR1(constitutive triple response 1)、EIN2(ethylene ins ensitive 2)、EIN3/EILs(ethylene insensitive 3/EIN3 like)和乙烯响应因子(ERFs)[7,9-11]。目前,相关文献报道大部分集中于乙烯调控采后猕猴桃成熟软化的机制研究,有关低温贮藏对乙烯调控成熟软化相关机制的报道较少。
猕猴桃果实中含有大量的淀粉。有研究表明,淀粉的快速降解是猕猴桃采后快速软化的主要原因,且乙烯促进淀粉降解使猕猴桃果实成熟软化[12-13]。而低温可有效降低猕猴桃淀粉酶活性,延缓淀粉降解[14],在马铃薯中α-淀粉酶StAmy23、β-淀粉酶StBAM1和StBAM9受低温影响[15]。据报道,淀粉降解涉及多种酶,包括葡聚糖水合双激酶(glucan water dikinase,GWD)、磷酸化葡聚糖水合双激酶(phosphoglucan water dikinase,PWD)、双特异性磷酸酶(dual-specificity phosphate,DSP4,又名starch excess4,SEX4)、LSF1/2 (like SEX four 1/2)、α-淀粉酶(α-amylase,AMY)、β-淀粉酶(β-amylase,BAM)、异淀粉酶(isoamylase,ISA)、极限糊精酶(limit dextrinase,LDA)、葡聚糖磷酸化酶(α-glucanglucan phospholylase,PHS)和歧化酶(disproportionating enzyme,DPE)等[16-17],目前鲜有文献报道采后猕猴桃低温贮藏影响淀粉降解酶相关基因的表达,关于低温调控乙烯介导的淀粉降解相关机制的文献更少。
本研究以红阳猕猴桃果实为试验材料,研究低温贮藏对猕猴桃果实品质的影响,并结合实时荧光定量PCR分析低温处理对果实采后贮藏期间淀粉降解相关基因表达的影响,以期解释低温延缓果实软化与果肉淀粉降解之间的关系。
1 材料与方法
1.1 材料与处理
供试猕猴桃果实品种为红阳,采自浙江省宁波市东钱湖种植基地,果实于花后124 d采收并运回实验室进行处理。将猕猴桃果实随机分成2组,每组60个,重复3次。低温处理(LT):置于4℃低温恒温培养箱中贮藏42 d,贮藏期间每隔7 d取样1次;对照(CK):置于25℃恒温培养箱中贮藏12 d,贮藏期间每隔2 d取样1次。每次随机取样,果肉用液氮速冻,置于-80℃保存备用。
1.2 猕猴桃果实总可溶性固形物、硬度和淀粉含量测定
参考梁敏华[18]的方法,随机取5个猕猴桃果实,取位于果实赤道部位(包含少量外、中果肉和果心)进行榨汁,用GMK-701AC便携式数字糖度计(G-WON公司,韩国)测定其总可溶性固形物(total soluble solids,TSS)含量,重复测定3次。猕猴桃果实硬度和淀粉含量参照陈景丹等[12]的方法测定。
1.3 猕猴桃果实乙烯释放速率测定
参考陈伟等[19]的方法,随机选取5个猕猴桃果实置于密闭的容器中,分别置于相应贮藏温度下2 h后抽取气体1 mL,用岛津2014C型气相色谱仪(岛津,日本)测定乙烯含量,同时以标准乙烯气体作标准曲线,计算果实的乙烯释放速率。气相色谱检测条件参考文献[20]。
1.4 猕猴桃果实RNA提取及cDNA合成
参考陈景丹等[12]的方法,称取少量猕猴桃果肉粉末,用植物RNA提取试剂盒(Omega Bio-Tek 公司,美国)提取总RNA。以猕猴桃总RNA为模板,采用SuperRT cDNA 第一链合成试剂盒(康为世纪生物科技有限公司,江苏),按照试剂盒说明书将总RNA逆转录为cDNA。
1.5 实时荧光定量PCR分析
从猕猴桃基因组数据库下载各基因全长序列,运用Primer 6软件设计荧光定量PCR引物(表1),其中AcAMY1、AcAMY3、AcBAM1、AcBAM3、AcGWD、AcPWD、AcISA3、AcLDA1基因引物序列参考文献[12]。以cDNA为模板,采用SYBR Green荧光染料法以Actin作为内参基因[12],CFX96 Touch用荧光定量PCR仪(Bio-Rad,美国)进行测定,并设置阴性对照,每个样品进行3次生物学重复。试验数据采用2-ΔΔCt法[21]分析。
2 结果与分析
2.1 低温贮藏对猕猴桃果实硬度、TSS含量、乙烯释放速率和淀粉含量的影响
猕猴桃果实在常温贮藏(CK)过程中硬度呈现前期缓慢下降,贮藏8 d后迅速下降,而低温贮藏(LT)有效延缓了猕猴桃果实的快速软化,未出现快速软化情况(图1-A)。常温贮藏过程中,猕猴桃果实中TSS含量呈逐渐升高趋势,低温延缓了TSS的积累(图1-B)。 常温贮藏前期,猕猴桃乙烯释放速率没有变化,贮藏8 d后出现乙烯跃变,而低温贮藏过程中猕猴桃乙烯释放速率一直处于较低水平,无明显变化(图1-C)。 此外,猕猴桃果实乙烯出现跃变时间也是果实快速软化的时期,低温(4℃)贮藏可抑制猕猴桃果实乙烯释放速率的升高,推迟呼吸跃变高峰的到来。由图1-D可知,在猕猴桃采后贮藏过程中,随着贮藏时间延长淀粉含量呈下降趋势,与常温贮藏相比,低温贮藏有效延缓了猕猴桃淀粉含量的快速下降,表明低温延缓果实软化可能与淀粉降解和乙烯释放量有关。
2.2 猕猴桃果实采后乙烯合成基因表达分析
由图2可知,常温贮藏期间,猕猴桃果实采后乙烯合成基因AcACS1和AcACO1在贮藏前期未表达,贮藏8 d后两基因表达量开始急剧上升,这与常温贮藏猕猴桃果实乙烯释放速率在贮藏8 d后开始急剧上升相关;低温贮藏期间,AcACS1和AcACO1基因表达量始终保持在一个恒定的低水平,且相对表达量明显低于常温贮藏后期,表明低温能抑制乙烯合成关键酶基因AcACS1和AcACO1的表达,这可能与猕猴桃果实采后低温贮藏抑制乙烯释放速率有关。
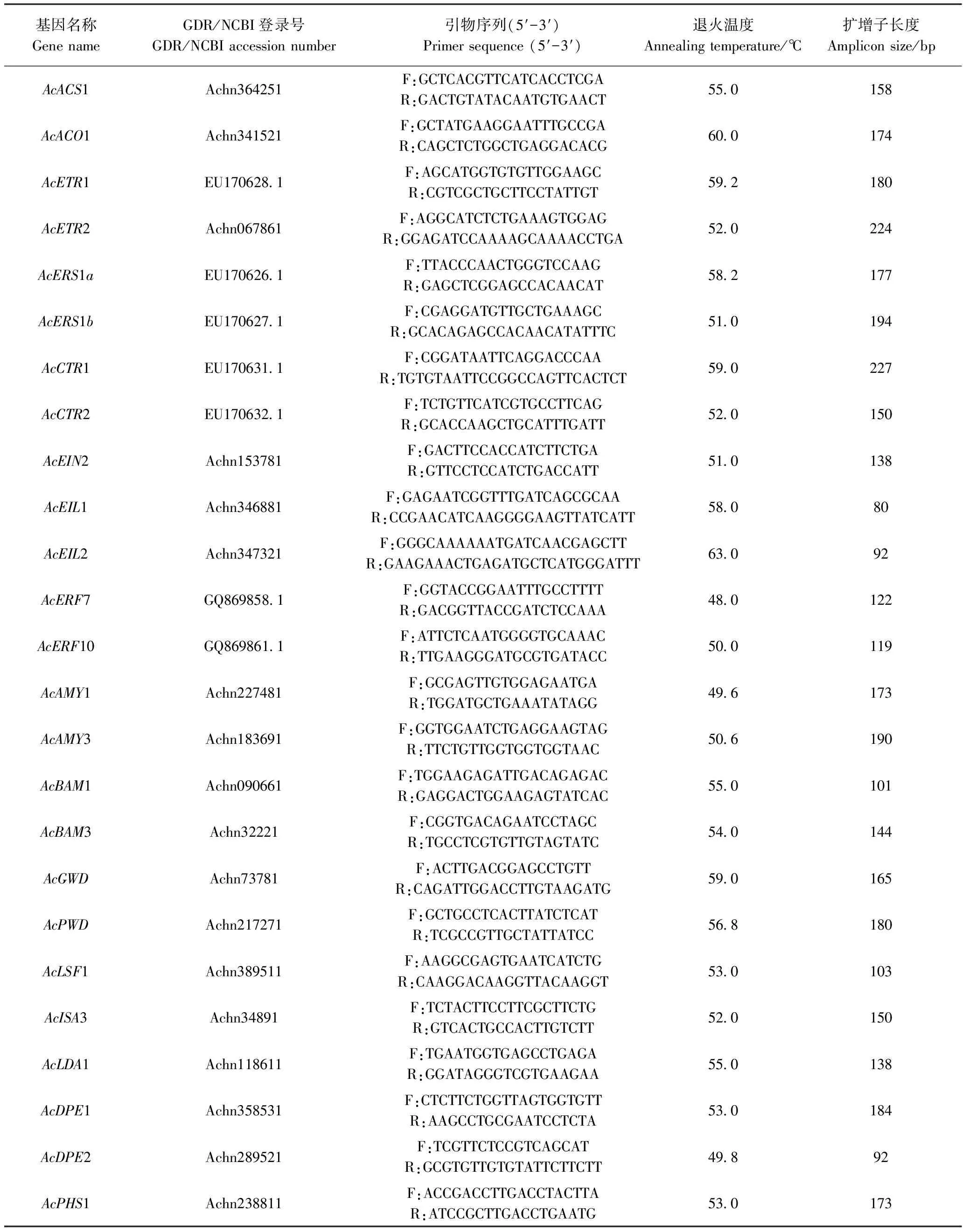
表1 qPCR扩增引物序列Table 1 Primers sequences used for qPCR and amplicon characteristics
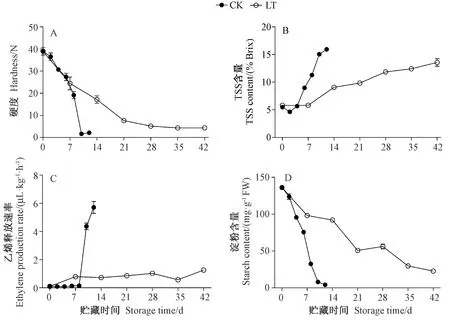
图1 贮藏期间猕猴桃果实硬度(A)、总可溶性固形物含量(B)、乙烯释放速率(C)和淀粉含量(D)的变化Fig.1 Content changes of hardness(A), total soluble solids(B), ethylene production rate(C) and starch content(D) in postharvest kiwifruit during storage
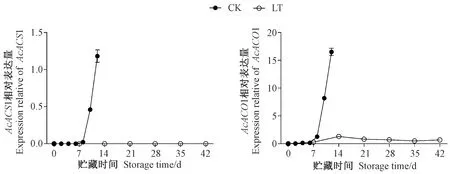
图2 贮藏期间猕猴桃果实中AcACS1和AcACO1基因的表达Fig.2 Expressions of AcACS1 and AcACO1 in postharvest kiwifruit during storage
2.3 猕猴桃果实采后乙烯转导信号途径基因表达分析
由图3可知,低温贮藏采后猕猴桃果实乙烯转导信号途径AcETRs基因表达各异。低温贮藏猕猴桃果实AcETR1相对表达量在整个贮藏期间变化较小,与常温贮藏先上升后下降的趋势不同。低温贮藏猕猴桃果实AcERS1a相对表达量先上升后下降再缓慢上升,在贮藏7 d时其表达量是常温贮藏6和8 d的3~4倍,而常温贮藏下AcERS1a相对表达量随贮藏时间的延长不断上升。同时,与常温贮藏相比,低温贮藏抑制了猕猴桃果实AcETR2和AcERS1b基因的表达。
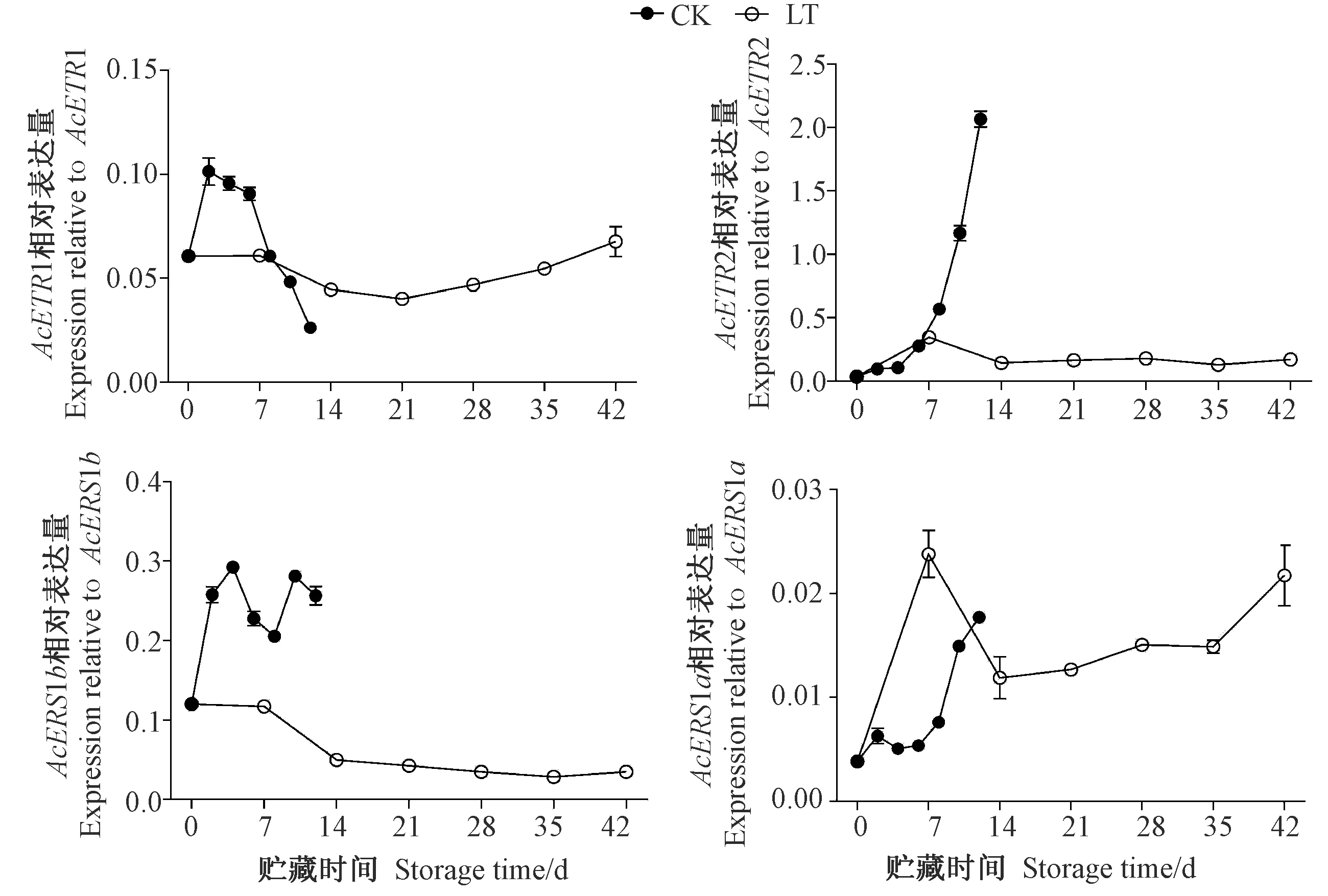
图3 贮藏期间猕猴桃果实中AcETRs和AcERSs基因的表达Fig.3 Expressions of AcETRs and AcERSs in postharvest kiwifruit during storage
由图4可知,在低温贮藏过程中,猕猴桃果实中的AcCTR1和AcCTR2相对表达量呈先上升后下降的趋势,峰值与常温贮藏期间的最高表达量基本接近,而AcEIN2相对表达量先上升后基本保持不变,其相对表达量高于常温贮藏,说明低温可以诱导AcEIN2的表达。
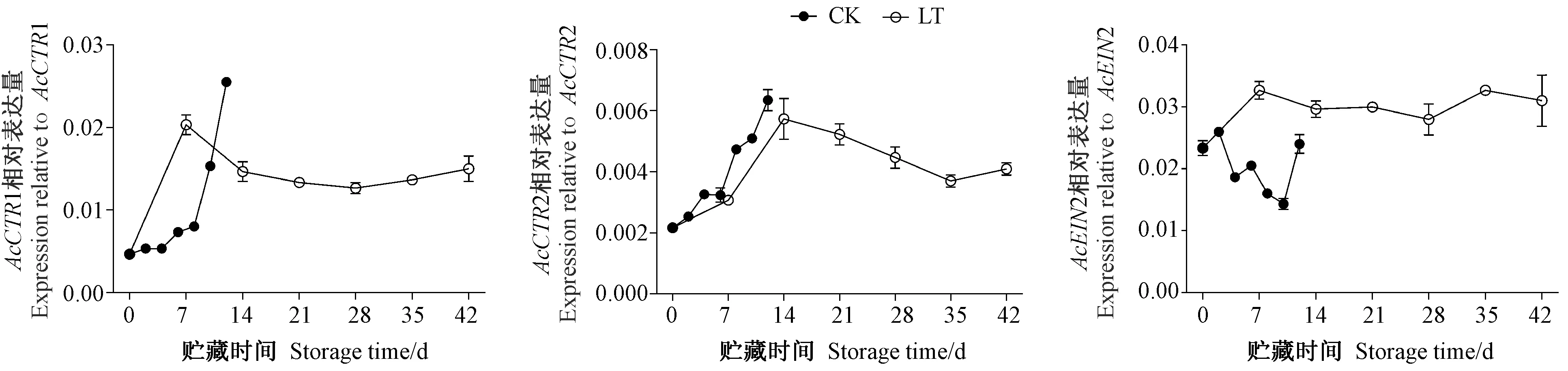
图4 贮藏期间猕猴桃果实中AcCTRs和AcEIN2基因的表达Fig.4 Expressions of AcCTRs and AcEIN2 in postharvest kiwifruit during storage
由图5可知,在贮藏过程中,猕猴桃果实中AcEILs的表达在低温贮藏7 d时较初采收时显著增强(P<0.05),其中,AcEIL1、AcEIL2相对表达量先上升后缓慢下降,贮藏后期又上升,表明低温能诱导采后猕猴桃果实AcEIL1、AcEIL2的表达,并在整个贮藏期间维持在较高的表达水平。与AcEILs类似,猕猴桃果实中AcERFs也受到低温诱导,其中,在贮藏前期AcERF7相对表达量呈先上升后下降的趋势,贮藏后期其相对表达量相对稳定;而AcERF10对低温应答较强,贮藏7 d时猕猴桃果实中AcERF10表达较贮藏0 d上调100倍,贮藏28 d时其相对表达量达到峰值,较贮藏0 d上调117倍。
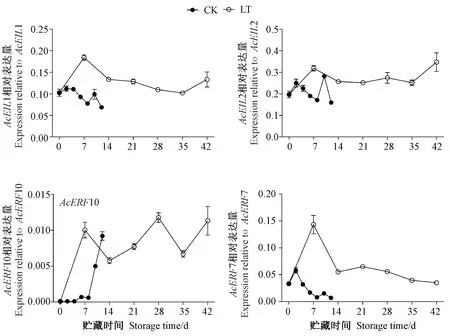
图5 贮藏期间猕猴桃果实中AcEILs和AcERFs基因的表达Fig.5 Expressions of AcEILs and AcERFs in postharvest kiwifruit during storage
2.4 猕猴桃果实采后淀粉降解酶基因表达变化
由图6可知,整个贮藏期间,常温贮藏猕猴桃果实AcGWD、AcPWD和AcLSF1相对表达量均呈快速下降趋势;而低温贮藏下,AcGWD相对表达量在贮藏前期呈下降趋势,贮藏7 d后开始逐渐上升,表明低温在贮藏后期可诱导AcGWD的表达,而AcPWD和AcLSF1相对表达量在贮藏前期与常温贮藏时表现出相似的趋势,但贮藏7 d后其表达水平保持稳定,且AcLSF1相对表达量高于常温贮藏。

图6 贮藏期间猕猴桃果实中AcGWD、AcPWD和AcLSF1基因的表达Fig.6 Expressions of AcGWD、AcPWD and AcLSF1 in postharvest kiwifruit during storage
由图7可知,在低温贮藏期间,猕猴桃果实AcAMY1相对表达量呈先上升后下降的趋势,但总体上AcAMY1相对表达量低于常温贮藏,表明低温能抑制AcAMY1表达;低温贮藏期间AcAMY3相对表达量呈逐渐上升趋势,且在贮藏后期AcAMY3相对表达量高于常温贮藏;低温贮藏期间AcBAM1相对表达量无明显变化,AcBAM3相对表达量呈先缓慢上升后保持稳定的趋势,但总体上两者的相对表达量均低于常温贮藏,表明低温能抑制β-淀粉酶基因AcBAM1和AcBAM3的表达。

图7 贮藏期间猕猴桃果实中AcAMYs和AcBAMs基因的表达Fig.7 Expressions of AcAMYs and AcBAMs in postharvest kiwifruit during storage
由图8可知,整个贮藏过程中,常温贮藏猕猴桃果实AcISA3相对表达量呈先上升后下降的趋势,而低温贮藏AcISA3相对表达量始终保持较低的表达水平;常温贮藏AcLDA1相对表达量先上升随后略微上下波动,而低温贮藏AcLDA1相对表达量呈先略微下降后再升高再下降的趋势,但整个贮藏期间低温贮藏的AcLDA1相对表达量均低于常温贮藏,表明低温能抑制AcISA3和AcLDA1表达。
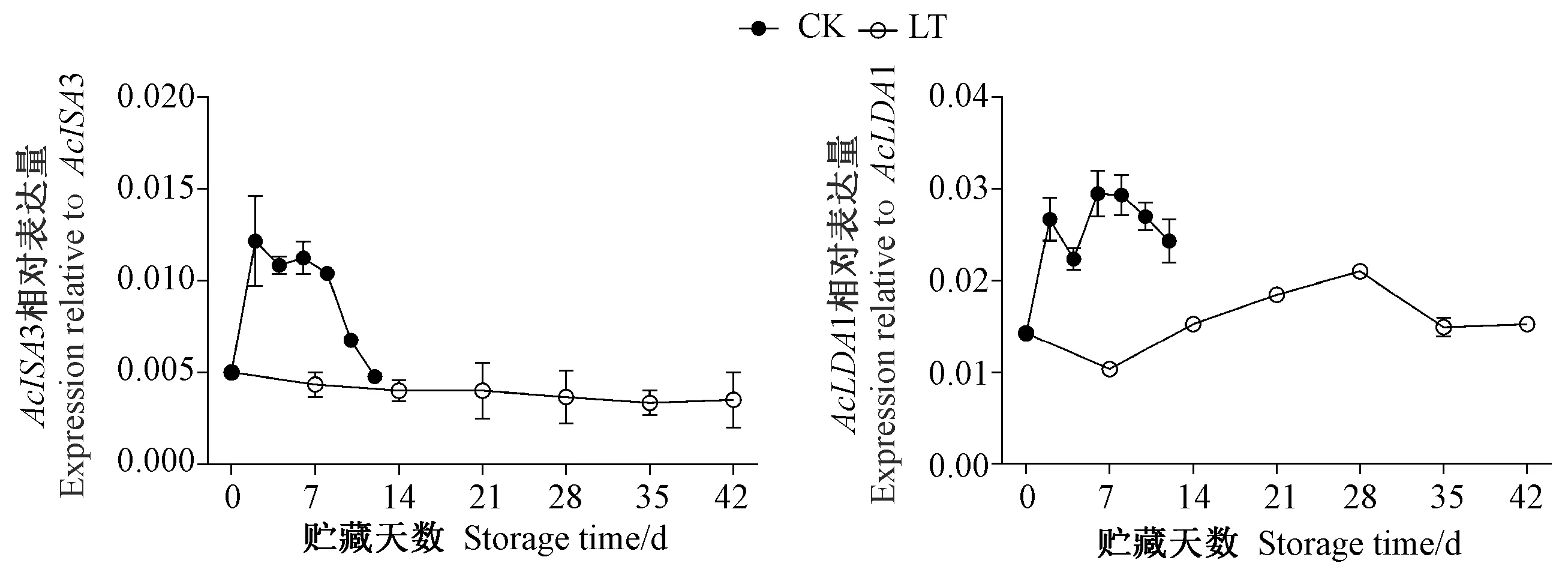
图8 贮藏期间猕猴桃果实中AcISA3和AcLDA1基因的表达Fig.8 Expressions of AcISA3 and AcLDA1 in postharvest kiwifruit during storage
由图9可知,常温贮藏过程中,猕猴桃果实中AcDPE1相对表达量呈先上升后下降再上升的变化趋势;低温贮藏AcDPE1始终保持较低的表达水平,且在整个低温贮藏期间,AcDPE1相对表达量低于常温贮藏,表明低温能抑制AcDPE1的表达。常温贮藏前期AcDPE2相对表达量上升,随后上下略微波动,而低温贮藏猕猴桃果实AcDPE2相对表达量随着贮藏时间的延长而逐渐增强,但整个低温贮藏前期其相对表达量均低于常温贮藏。常温贮藏期间,猕猴桃果实中AcPHS1相对表达量呈下降趋势,而低温贮藏期间其呈先略微下降后上升的趋势,且在低温贮藏7 d后AcPHS1相对表达量高于常温贮藏中后期。表明低温能诱导AcDPE2和AcPHS1的表达。
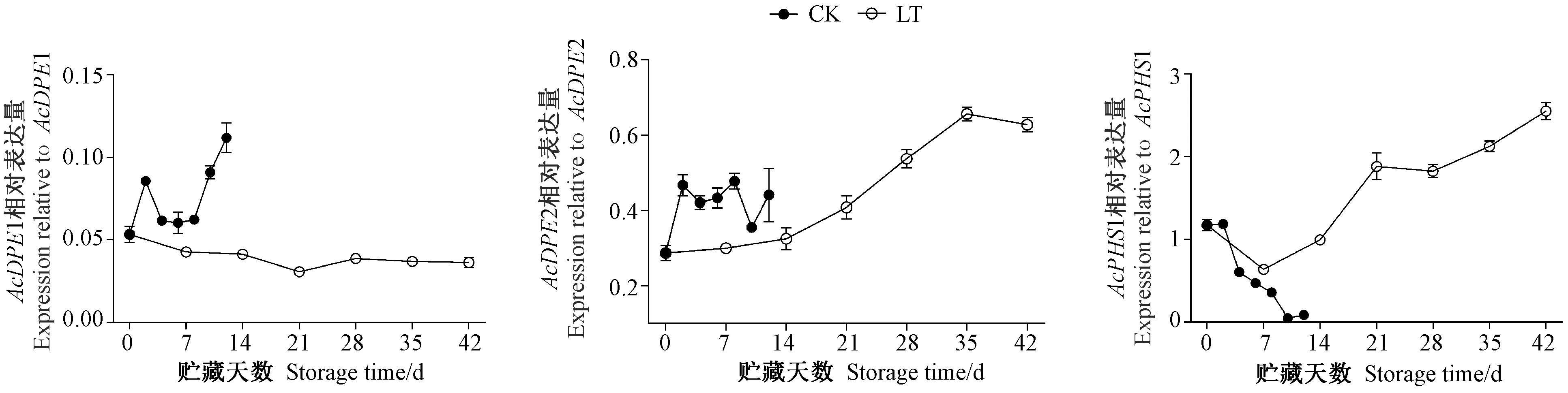
图9 贮藏期间猕猴桃果实中AcDPEs和AcPHS1基因的表达Fig.9 Expressions of AcDPEs and AcPHS1 in postharvest kiwifruit during storage
3 讨论
猕猴桃采后成熟软化与淀粉降解、乙烯合成密切相关,淀粉降解是果实快速软化阶段的主要原因[12,22]。在香蕉[23]、苹果[24]、猕猴桃[25]等果实中,淀粉含量变化受到乙烯释放速率的影响。乙烯和1-MCP处理能分别促进和抑制淀粉酶相关基因的表达,从而影响淀粉降解,最终延缓果实软化进程[11]。本研究结果表明,采后低温贮藏能抑制猕猴桃果实中的乙烯释放速率,显著延缓果实硬度和淀粉含量的下降以及TSS积累速度的上升。推测低温可能通过抑制乙烯释放量,进而延缓淀粉降解,最终延缓果实成熟软化。
Wang等[26]研究发现MdACS3a基因的突变体抑制苹果果实成熟过程中乙烯的合成。在软溶质、硬溶质和不溶质桃果实中,低温通过抑制PpACO1基因表达,使乙烯合成量仍保持极低水平,延缓制猕猴桃果实成熟软化[27]。表明低温可通过抑制猕猴桃果实中乙烯合成相关基因AcACO和AcACS的表达,从而减少内源乙烯合成,这与香蕉[28]中的研究结果相一致。此外,有研究发现,硬溶质和软溶质桃果实的PpEIN受低温诱导表达,而PpCTR1只在硬溶质果实中受低温诱导表达[29]。在海沃德猕猴桃中,EIL1-4均可被低温处理明显诱导[30]。本研究结果表明,在低温贮藏下,猕猴桃果实中乙烯信号转导途径基因显示不同的表达模式,如低温抑制了AcETR1、AcETR2、AcERS1b基因的表达;AcERS1a、AcEIL1、AcEIL2、AcCTR1、AcCTR2、AcERF7均先上升再下降后稳定表达;AcEIN2、AcERF10受低温诱导保持较高的表达水平,这与殷学仁[7]的研究结果相似。综上所述,乙烯信号转导基因在低温下存在不同的应答模式,但与果实采后成熟软化无直接联系,更可能是参与逆境应答[7],还需进一步研究。因此,低温抑制果实后熟软化的效应主要是通过抑制乙烯合成相关酶起作用,而不是抑制乙烯信号转导。
周晨卉[2]和戚雯烨等[14]研究发现低温可有效降低猕猴桃果实中淀粉酶活性,推迟淀粉酶活性高峰到达的时间在一定程度上延缓了淀粉的降解。本试验中,低温抑制了淀粉酶相关基因AcAMY1、AcBAM1、AcBAM3、AcISA3、AcLDA1和AcDPE1的表达。在海沃德猕猴桃中发现,AdAMY1和AdBAM3.1/3L/9在猕猴桃采后淀粉降解中呈正相关[31];陈景丹等[12]研究发现猕猴桃果实中AcAMY1、AcAMY3、AcBAM1、AcBAM3和AcDPE1是淀粉降解的关键基因。推测本研究中低温主要通过抑制AcAMY1、AcBAM1、AcBAM3和AcDPE1的表达,从而延缓淀粉的降解,最终影响猕猴桃果实采后快速软化阶段的进程。此外,有关苹果贮藏品质的研究表明,除低温外,乙烯也是调控淀粉酶基因的表达进而调节淀粉代谢的重要因素[23,32]。苗红霞等[33]研究发现,在相对高温下,持续高乙烯释放量主要促进了宝岛蕉果实中支链淀粉的降解;Nascimento等[34]发现,BAM基因表达量与乙烯释放量呈显著正相关。在猕猴桃果实中,淀粉降解的关键基因AcAMY1、AcAMY3、AcBAM1、AcBAM3和AcDPE1同样受乙烯调控表达[11]。在本研究中,低温只抑制了猕猴桃果实贮藏8 d后乙烯的释放速率,但延缓了整个贮藏期间果实中淀粉的降解。这表明猕猴桃果实贮藏前期淀粉的降解以及淀粉降解基因AcAMY1、AcBAM1、AcABAM3和AcDPE1表达主要受低温影响,而在贮藏后期,即在乙烯开始释放阶段,淀粉酶降解基因表达的变化主要与低温抑制乙烯释放有关。本研究结果为解释低温影响猕猴桃果实乙烯释放速率、淀粉降解与果实软化提供了理论依据,但乙烯对淀粉代谢途径的调节机制尚不明确,仍需进一步探究。
4 结论
低温是延缓猕猴桃采后成熟软化有效手段之一,低温对猕猴桃果实采后成熟软化的影响与抑制乙烯释放和淀粉降解密切相关。本研究结果表明,低温抑制了果实贮藏后期乙烯合成相关酶基因AcACO、AcACS的表达,使乙烯含量保持较低水平,减缓了果实成熟软化。同时,低温抑制了贮藏期间淀粉降解相关基因AcAMY1、AcBAM1、AcBAM3、AcISA3、AcLDA1和AcDPE1的表达。贮藏后期淀粉降解相关基因AcAMY1、AcBAM1、AcABAM3、AcLDA1和AcDPE1的抑制表达可能与低温抑制内源乙烯合成水平有关。本研究为进一步探究低温贮藏能有效延缓猕猴桃后熟软化与淀粉降解之间的关系提供了理论依据。

